偏头痛被认为是一种中枢神经和血管发生 某些功能障碍而导致的疾病,表现为单侧或双侧 头痛,有搏动性,以反复发作性头痛为主要症 状[1, 2]。病因和发病机制尚未完全明确,主要的发 作机制依赖于血管源性学说,皮层扩散性抑制学 说等[3],目前三叉神经血管学说日益受到广大学 者的关注。瞬时受体电位通道家族M8(transient receptor potential melastatin 8 channels,TRPM8) 亚型在三叉神经血管中起着重要的作用[4],亦有 TRPM8 参与偏头痛发作的研究[5, 6]。谷氨酸受体 (NMDAR)能解除Mg2+ 对Ca2+ 内流的抑制,使 Ca2+ 大量进入神经元内,从而出现钙超载,并触 发细胞内钙敏感性的信号级联,促进蛋白激酶A (PKA)的激活[7],导致细胞膜蛋白受体TRPM8 表达上调。本研究拟通过动物实验来探讨TRPM8 在偏头痛发病机制中的作用。 1 材料与方法 1.1 实验动物
清洁级健康雄性Sprague-Dawley(SD) 大 鼠20 只由四川省医学科学院/ 四川省人民医院动 物实验中心提供,合格许可证号:SYXK(川) 2008-110,平均体重180~200 g,鼠龄2~3 个月。 1.2 实验器材
显微镜(日本Nikon 公司);精密天平分析 仪(Sartorius 公司);微量移液器(法国Gilson 公 司);荧光显微镜(日本Nikon 公司);电泳仪、 电泳槽和转膜系统(美国Bio-Rad 公司)。 1.3 实验试剂
硝酸甘油注射液(北京益民药业有限公司), NMDAR 抗体(北京博奥森公司),PKA 抗体(英 国Abcam 公司),TRPM8 抗体(英国Abcam 公司), 10% 水合氯醛(天津市瑞金物化学品有限公司), 细胞膜蛋白与细胞浆蛋白提取试剂盒(江苏碧云 天生物有限公司),四甲基乙二胺(TEMED)(美 国Sigma 公司)。 1.4 硝酸甘油偏头痛模型建立及行为学观察
将20 只大鼠进行编号,按随机数字表法随 机分为模型组和空白对照组,每组10 只。模型组 依照Tassorelli 法[8] 建立无先兆偏头痛大鼠模型: 在颈背部每周1 次皮下注射硝酸甘油,每次剂量均为10 mg/kg,共5 周。空白对照组用等量生理盐 水代替硝酸甘油行颈背部皮下注射,共5 周,分 笼普通喂养。注入了硝酸甘油的大鼠,在数分钟 后则出现耳朵发红,烦躁不安,两前肢高频率搔 头,攀爬鼠笼的次数显著增加,这些现象约1~2 h 后消失,然后大鼠表现出困倦、闭眼、不活动等状 态[9];出现上述表现后,按照下列标准予以评分[10]: (1)梳理毛发行动:10 次评为1 分(之后每出现 1 次加0.1 分),(2)围着铁笼来回打转:2 次评 为1 分(之后每出现1 次加1 分),(3)攀爬笼子: 3 次评为1 分(之后每出现1 次加1 分),(4)烦 躁:往返运动1 次计1 分,(5)咬尾:1 次计1 分, (6)耳朵发红:出现则为1 分,以30 min 为一个 观察时间段,对每只受试大鼠的以上行为做评分 记录,总分达6 分及6 分以上者则视为造模成功。 1.5 标本采集及处理
两组大鼠于行为学评分后用10% 水合氯醛 (3.5 mL/kg)麻醉,固定于手术台上,打开胸腔, 剥离心包,暴露心脏,输液头皮针头从心尖搏动 处插到升主动脉,止血钳固定针头,快速注入生 理盐水约150 mL 直到大鼠肝脏、肺、胸壁血管及 四肢逐渐变苍白,再将50 mL 4% 多聚甲醛先快后 慢注入其中一部分大鼠体内,直到大鼠尾巴变硬 则停止灌注,大鼠俯卧于手术台上,暴露并剥去 颅骨,暴露大脑,去除其表面的硬脑膜,将大脑 组织整体翻起,暴露颅底的三叉神经节,将三叉 神经节完整剥离并剪断,剥去其表面的硬脑膜, 放入4% 多聚甲醛中固定,4℃保存;另一部分大 鼠麻醉灌注后直接开颅取颅底三叉神经节,并迅 速放于液氮中保存,备用。 1.6 免疫组化法检测NMDAR 表达
将三叉神经节标本放入不同浓度梯度乙醇中 脱水至沉底、透明,石蜡包埋,行5 μm 厚度冠状 切片。切片经脱蜡、水化,封闭内源性过氧化物酶 及微波抗原修复后,滴加山羊血清封闭液(1 : 200), 室温孵育20 min 后,用吸水纸吸去封闭液;滴加 兔抗大鼠一抗(NMDAR 抗体,1 : 200),37℃下 放置1 h 后放入4℃冰箱过夜或37℃下放置2 h 以 上,PBS 洗3 次,每次5 min;再滴加生物素羊抗 兔二抗(1 : 200),37℃放置0.5~1 h,PBS 洗3 次, 每次5 min;最后滴加约50 μL 辣根过氧化物酶标 记的链亲和素,37℃放置0.5~1 h,PBS 洗3 次,每次5 min。DAB 显色,苏木素复染,盐酸酒精 分色,氨水返蓝,脱水、透明,中性树胶封片。 每个标本随机选取20 张切片,每张切片在400 倍 光镜下随机选取10 个视野进行观察,采用Image- Pro Plus 6.0图像分析系统对每一张切片进行分析, 以NMDAR 阳性细胞的平均光密度(OD)来表示 NMDAR 表达水平。 1.7 免疫荧光检测PKA 蛋白表达
取上述抗原修复后切片,滴加山羊血清封闭 液(1 : 100),室温孵育30 min 后倾去多余液体, 不洗;滴加1%BSA 稀释的兔抗大鼠一抗(PKA 抗体, 1 : 100),37℃下放置1 h 后放入4℃冰箱过夜或 37℃下放置2 h 以上,PBS 洗3 次,每次5 min; 再滴加荧光标记的山羊抗兔二抗(1 : 100),避光, 37℃孵育30 min,PBS 洗3 次,每次5 min;最后 用5 μg/mL DAPI 对细胞核染色,抗荧光淬灭制剂 封片。每个标本随机选取20 张切片,每张切片在 100 倍光镜下随机选取10 个视野进行观察,采用 Image-Pro Plus 6.0 图像分析系统对每张切片进行图 像采集和分析,以PKA 阳性细胞的OD 值来表示 PKA 表达水平。 1.8 Western blot 检测TRPM8 表达
将液氮中储存的三叉神经节标本取出并撵碎 (每5 min 加入液氮1 次),预冷的PBS 洗涤, 加入10 μL/100 mg 组织蛋白裂解液和1 mL/100 mg 的PMSF,分装于EP 管中,并置于冰浴中 20~30 min 使蛋白充分裂解,震荡仪震荡混匀。 4℃ 11 000 rpm 离心10~20 min,将上清液分装于0.5 mL EP 管中,行SDS-PAGE 蛋白电泳,转膜(湿转法), 封闭,抗原抗体反应及显色。采用Quantity One 图 像分析软件测量条带的光密度值,以靶蛋白灰度/β-actin 灰度比值表示TRPM8 的相对表达量。实 验重复3 次。 1.9 统计学分析
采用SPSS 17.0 统计学软件对数据进行分析 处理,符合正态分布的计量资料以均数± 标准差 (x±s)表示,两组间均数的比较采用t 检验;相 关性分析采用Pearson 相关分析。P<0.05 为差异有 统计学意义。 2 结果 2.1 两组大鼠行为学评分结果
与对照组比较,每周模型组大鼠行为学评分 均明显升高(P<0.05),且均高于6 分,提示造模 成功,见表 1。
| 表 1 两组大鼠行为学评分比较(x±s) |
NMDAR 阳性表达呈棕黄色。对照组中神经细 胞NMDAR 表达较弱,模型组神经细胞中NMDAR 呈强阳性表达(图 1)。通过分析显示模型组 NMDAR 表达水平(0.420±0.033)明显高于对照 组(0.120±0.015)(t=242.355,P<0.01)。
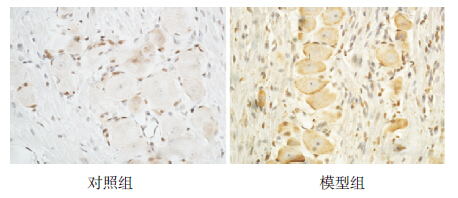 |
图 1 免疫组化法检测两组大鼠三叉神经组织中 NMDAR 的表达(DAB 显色,×400) NMDAR 表达于细胞 膜和细胞质中,其阳性表达呈棕黄色。对照组中神经细胞NMDAR 表达较弱,模型组神经细胞中NMDAR 呈强阳性表达。 |
PKA 蛋白表达呈绿色荧光。对照组中神经细 胞PKA 蛋白表达较弱(0.160±0.034),模型组神 经细胞中PKA 蛋白呈强阳性表达(0.410±0.057), 与对照组比较差异有统计学意义(t=83.104, P<0.01),见图 2。
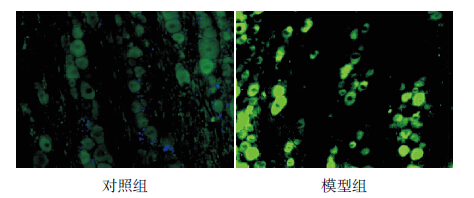 |
图 2 免疫荧光法检测两组大鼠三叉神经组织中PKA 蛋白的表达(DAPI,×400) PKA 蛋白表达于细胞膜和细胞 质中,绿色荧光为PKA 的阳性表达。对照组中神经细胞PKA 蛋 白表达较弱,模型组神经细胞中PKA 蛋白呈强阳性表达。 |
Western blot 检测结果显示模型组TRPM8 表 达水平(149±14)高于对照组(62±8)(t=560.93, P<0.01),见图 3。
 |
图 3 Western blot 检测两组大鼠三叉神经组织中 TRPM8 的表达 |
模型组大鼠行为学评分与TRPM8 水平之间呈 正相关(r=0.822,P<0.01),说明TRPM8 的表达 水平越高,行为学评分越高,症状越典型,提示 TRPM8 可能参与了偏头痛的发病机制。 2.6 模型组NMDAR 与TRPM8 的相关性分析
模型组大鼠三叉神经组织中NMDAR 水平与 TRPM8 水平之间呈正相关(r=0.794,P<0.01), 说明NMDAR 表达增加,TRPM8 表达亦增加,提 示NMDAR 可能与TRPM8 共同参与了偏头痛的发 病机制。 3 讨论
偏头痛是一种血管和/ 或神经功能紊乱性反 复发作性慢性疾病,有些还伴有畏光、声音恐惧、 恶心、呕吐、腹痛等症状。近年来,偏头痛发病 率有逐年上升的趋势,而且伴随年龄趋于年轻化, 该病严重影响了患者的学习和日常生活,其中儿 童偏头痛发作的特点:(1)大多数偏头痛患儿具 有家族遗传史[11];(2)发作时间较短,常常持续 时间为2~48 h,少数持续仅约1 h;(3)发生部 位以额部最为好发,其次是一侧或双侧额颞部[12]; (4)女性患者疾病发作可能与雌二醇有极大的关 系,常常在妊娠期停止发作或发作次数明显减少, 周期缩短[13];(5)搏动性及中、重度头痛不明显。
对年龄较大的儿童偏头痛患者而言,常见的 先兆症状为眼前出现瞬间的强光束、一侧视觉消 失、眼前闪现金星或各种形态的黑点,往往发生 在头痛前半小时,然而有先兆偏头痛只占很少部 分。无先兆偏头痛占70%~85%,发作时患儿常寻 找一个安静、光线暗淡的地方躺下,避免声音和 光线刺激,易受外界环境或者学习压力而反复发 作,因此也是本次实验研究观察的要点。
然而,偏头痛的发作机理还不完全清楚,目 前公认的机理主要依赖于三种学说:即神经源性、 血管源性和三叉神经血管学说[14]。目前,三叉神 经血管学说作为主流学说受到广大学者们的关注, 该学说是将血管源性和神经源性学说融入一体: 中枢血管强烈扩张,神经炎性递质的大量释放, 使三叉神经受内部和外部因素刺激,神经递质产 生,将痛觉信号沿三叉神经传导至三叉神经脊束 核,再经过脑干前端、丘脑传入皮层,使大脑皮 层产生炎症反应[15]。最终导致偏头痛发生,很好 的诠释了偏头痛的发生和发展。
在此研究中,考虑到临床儿童偏头痛多为无 先兆偏头痛,以此为研究出发点,所以建立无先 兆硝酸甘油偏头痛大鼠模型。该模型支持三叉神 经血管学说:由于NTG 释放出的NO 通过血脑屏 障激活了血管周围的三叉神经末梢,释放神经肽, 使脑膜血管过度紧张,血浆蛋白渗出,肥大细胞 脱颗粒,从而导致脑膜神经血管系统产生神经性 炎症[16],这种伤害性刺激沿着三叉神经传入纤维传至三叉神经核尾部,冲动达到延脑化学感受器, 引起恶心、呕吐;传入下丘脑,出现畏光;传入 大脑皮层产生疼痛[17]。这再一次验证了以往学者 研究的三叉神经血管理论具有真实性和可重复性, 故本研究认为三叉神经节是偏头痛发生发展的重 要枢纽。
本实验研究在偏头痛动物模型制作成功后, TRPM8 表达水平较对照组明显升高,说明TRPM8 可能参与了偏头痛的发生和发展过程。但TRPM8 表达的增加也会导致冷痛觉过敏[18]。TRPM8 参与 慢性疼痛的机制中,主要是炎症组织中蛋白激酶 和磷酸激酶的激活,导致细胞膜蛋白受体TRPM8 表达上调,通道开放阈值下降,突触严重受损, 对疼痛感应部位产生痛觉过敏和超敏[19]。故偏头 痛大鼠三叉神经节中TRPM8 蛋白表达是上调的, 这与以往的其他研究结果一致。
NMDAR 可以通过条件性钙离子内流调节突 触传导、突触可塑性和神经细胞变性[20]。本实验 通过建立硝酸甘油偏头痛大鼠模型的结果显示: NMDAR 表达上调能使PKA 激活,PKA 膜转位促 使NMDAR 磷酸化,两者之间的恶性循环导致偏头 痛的发生与发展,更说明NMDAR 的调节在偏头痛 发作中发挥着不可或缺的作用[21]。而TRPM8 的激 活主要依赖PKA 的激活[7],然而,本研究通过对 NMDAR 与TRPM8 表达水平相关性分析得出结论: NMDAR 与TRPM8 灰度值之间呈正相关,提示 NMDAR 表达增加,TRPM8 表达亦增加,再一次 验证了在偏头痛发作中,TRPM8 升高与NMDAR 表达密切相关[5],而PKA 可能作为NMDAR 与 TRPM8 之间的桥梁,共同参与偏头痛的发作。然 而,能否证明TRPM8 参与偏头痛发作机制,它将 通过怎样的途径发挥调节作用,还需加大样本量, 作进一步考察。
| [1] | Soon YY, Siow HC, Tan CY. Assessment of migraineur referred to a specialist headache clinic in Singapore: diagnosis, treatment strategies, outcomes, knowledge of migraine treatments and satisfaction[J]. Cephalalgia, 2005, 25(1): 122-132. |
| [2] | 方洁, 王子才. 托吡酯治疗儿童偏头痛的临床研究[J]. 中国当代儿科杂志, 2006, 8(6): 509-510. |
| [3] | Xiao Y, Richter JA, Hurley JH. Release of glutamate and CGRP from trigeminal ganglion neurons: Role of calcium channels and 5-HT1 receptor signaling[J]. Moll Pain, 2008, 4: 12. |
| [4] | Chasman DI, Schurks M, Anttila V, et al. Genome-wide association study reveals three susceptibility loci for common migraine in the general population[J]. Nat Genet, 2011, 12(7): 695-843. |
| [5] | Markus Schurks. Genetics of migraine in the age of genome-wide association studies[J]. J Headache Pain, 2012, 13(1): 1-9. |
| [6] | Greg A, Zameel M. New directions in migraine[J]. Weir and Cader BMC Medicine, 2011, 9: 116. |
| [7] | Devesa I, Ferrer-Montiel A. Neurotrophins, endocannabinoids and thermo-transient receptor potential: a threesome in pain signaling[J]. Eur J Neurosci, 2014, 39(3): 353-362. |
| [8] | Tassorelli C, Greco R, Morocutti A, et al. Nitricoxide-induced neuronal activation in the central nervous system as an animal model of migraine: mechanisms and mediators[J]. Funct Neurol, 2001, 16(4 Suppl): 69-76. |
| [9] | Sarria I, Gu J. Menthol response and adaptation in nociceptive-like and nonnociceptive-like neurons: role of protein kinases[J]. Moll Pain, 2010, 6: 47. |
| [10] | 朱晓凤, 韩月臣, 樊兆民, 等. 热凝脑膜中动脉对硝酸甘油致偏头痛大鼠三叉神经尾核c-foes基因表达的影响[J]. 山东大学耳鼻喉眼学报, 2010, 24(1): 61-64. |
| [11] | 杨丽萍, 张育才. 儿童偏头痛的临床研究进展[J]. 临床儿科杂志, 2005, 23(4): 246-247. |
| [12] | 吴希如, 林庆. 小儿神经系统疾病基础与临床[M]. 北京: 人民出版社, 2000: 633-637. |
| [13] | 陈锦泳, 尹昭. 儿童和青少年偏头痛[J]. 新医学杂志, 2009, 40(12): 771-774. |
| [14] | 郭琳, 洪治平. 硝酸甘油型实验性偏头痛模型原理与研究现状[J]. 中国疼痛医学杂志, 2004, 10(6): 357-364. |
| [15] | 吴敏, 陈美娟. 偏头痛发病机制的研究进展[J]. 四川生理科学杂志, 2007, 29(4): 173-176. |
| [16] | 张敏. 偏头痛发病机制的研究进展[J]. 中国临床医生, 2010, 38(9): 14-15. |
| [17] | 姚宝珍, 丁琼, 凌伟, 等. 儿童偏头痛的临床特点及脑电图表现[J]. 中国当代儿科杂志, 2002, 4(5): 395-396. |
| [18] | 郭张华, 陈建平. NMDA 受体在神经病理性疼痛中作用的研究进展[J]. 中国疼痛医学杂志, 2013, 19(3): 173-176. |
| [19] | Proudfoot CJ, Garry EM, Cottrell DF, et al. Analgesia mediated by the TRPM8 cold receptor in chronic neuropathic pain[J]. Curr Biol, 2006, 16(16): 1591-1605. |
| [20] | Kayo T, Kempski O, Hermann A, et al. Cluster analysis of mRNA expression levels identifies multiple sequential patterns following focal cerebral ischemia[J]. Turk Neuron Surge, 2012, 22(4): 441-447. |
| [21] | 朱正萍, 杨晓苏. PKC-γ/NMDAR1在硝酸甘油致偏头痛大鼠发病机制中的作用探讨[D].中南大学硕士学位论文, 2009. |
 2015, Vol. 17
2015, Vol. 17



