脑 白 质 损 伤(cerebral white matter damage, CWMD)是早产儿比较特异的脑损伤类型,是导致 存活早产儿产生神经发育缺陷的重要原因。在美国,极低及超低出生体重儿占每年新生儿的 1.5%, 其中有 50% 通过头 MRI 检查发现患有不同程度的 CWMD[1],存活者中 5%~10% 患有脑瘫,50% 的患儿存在认知,行为或注意力缺陷方面问题 [2]。白 质病变唯一确诊依据就是影像学证据,CT 有射线 损害,且对白质病变早期诊断的敏感性及特异性 差,在新生儿的临床应用受到限制。超声可作为 CWMD 早期诊断的常规筛查项目,但对非囊性脑 室周围白质损伤诊断的特异性不高,且对中度以 下的损害诊断效果欠佳,相关研究发现超声通常 难以分辨出小于 0.5 cm 的病灶 [3]。常规 MRI 序列 很难早期发现局部病变,常用于晚期的随访,目 前已应用较广泛的弥散加权成像(diffusion-weighted imaging,DWI)技术,利用水分子的弥散运动特 性成像,可用于 CWMD 早期诊断,相关的临床报 道也很多。但以上检查手段均是对脑损伤进行定 性评价,近些年新出现的弥散张量成像(diffusion tensor imaging,DTI)技术是目前唯一可以无创的观 察和定量描述活体脑白质纤维束的检查方法,相 对 T1 加权、T2 加权及 DWI 序列,弥散张量成像 在检测脑白质的髓鞘化及发育中白质的微细结构 变化方面具有明显优势,能定量的评估白质纤维 的发育及损伤情况,经过后期处理后获得的各向 异性图及白质纤维束的显示使对脑白质的观察更 加直观。目前 DTI 在早产儿 CWMD 中的应用国内 仍少有报道。
微小型 CWMD 是根据 MRI 表现定义的脑损 伤 类 型,表 现 为 T1 加 权 高 信 号 和 T2 加 权 低 信 号,伴随 MRI 应用的普遍,此种损伤类型越来越 多见 [4, 5],本研究在分析早产儿常规头 MRI 序列及 DWI 的变化的基础上,利用 DTI 的表观弥散系数 (apparent diffusion coefficient,ADC)值及各项异性 分数(fractional anisotropy,FA)值对不同损伤程度 的微小型 CWMD 进行了定量评价。 1 资料与方法 1.1 研究对象及分组
选取 2011 年 11 月至 2012 年 4 月在中国医科 大学附属盛京医院住院治疗的 31 例早产儿,住院 期间平均在校正胎龄 35 周时完成常规 MRI、DWI 及 DTI 序列,入选条件为:(1)母亲产前有不良 病史(胎膜早破、母孕期患病、宫内窘迫、胎盘 早剥和前置胎盘等);(2)产时、生后有窒息、复苏抢救史、代谢性酸中毒、电解质紊乱、循环 功能障碍和感染等危险因素;(3)住院期间临床 表现有呼吸暂停、抽搐、喂养困难、原始反射异 常和肌张力改变;(4)排除其他脑病 ,如遗传代 谢性脑病、低血糖脑病、胆红素脑病、先天性脑 发育异常、围产期窒息等所致急性选择性神经元 坏死及脑室周围出血性及缺血性梗死。根据影像 学检查将 31 例早产儿分为正常组(n=10)、局灶 性 CWMD 组(n=11)和广泛性 CWMD 组(n=10)。 本研究获得监护人同意。 1.2 头部 MRI 检查及 DTI 图像处理
采用 GE Signa Hbxt 3.0 T 磁共振仪,扫描参 数:T1WI,SE 序 列 TR=320 ms,TE=9.28 ms,常 规进行矢状面和轴面扫描;T2WI:快速 FSE 序列, TR=5 500 ms,TE=100 ms,常规进行轴面扫描;视 野 17 cm×17 cm~22 cm×22 cm,矩阵 182×256, 层 厚 5 mm。DWI 采 用 EPI-SE 法,TR=5 500 ms, TE=88 ms,梯度磁场从 x、y、z 轴 3 个方向施加, b 值均为 700 s/mm2 。视野 19 cm×38 cm,矩阵: 128×72,层厚 5 mm。DTI 序列采用非同一直线上 的 13 个弥散梯度,所有序列耗时约 20 min 左右, 扫描前以苯巴比妥钠 5 mg/kg 静脉注射镇静。
利用 GE 公司 Functool 软件对 DTI 原始图像进 行处理得 FA 值、ADC 值及彩色 FA 图像,感兴趣 区在 DWI 上选定,为侧脑室顶层面,临近侧脑室 周围区域,因为此处为 CWMD 的高发区。 1.3 CWMD 分类
目前国际上尚无早产儿 CWMD 的分类标准, 本研究基于 MRI 检查技术,根据病灶范围来界定 白质损伤的程度 [6],结合 DWI 及常规序列表现分 为:局灶性 CWMD:侧脑室前后角、半卵圆中心 白质有单个或多个(<3 处)局灶性损伤;广泛性 CWMD:病灶数 >3 处或胼胝体等深层脑白质受累, 而不伴有皮层下白质受累。 1.4 统计学分析
采用 SPSS 17.0 统计学软件进行处理,计量资 料数据以均数 ± 标准差(x±s)表示,计数资料 以率(%)表示。组间比较采用单因素方差分析 或 χ2 检验,相关性分析采用 Pearson 系数检验, P<0.05 为差异有统计学意义。 2 结果 2.1 一般临床资料
三组的性别、分娩方式、胎龄、出生体重、 检查时间及校正胎龄的差别均无统计学意义。广 泛 CWMD 组的 1 min 及 5 min Apgar 评分明显低于 局灶 CWMD 组和正常组,差异有统计学意义,局 灶组与正常组之间 Apgar 评分的差别无统计学意 义。见表 1~2。
| 表 1 各组性别及分娩方式构成比较 [ 例(%)] |
| 表 2 各组的基本临床资料比较 (x±s) |
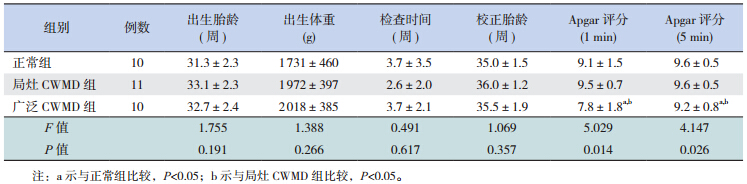
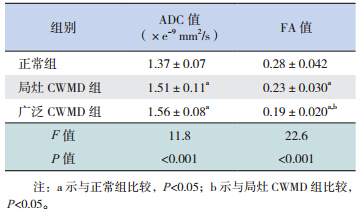
局灶性 CWMD 表现为侧脑室前后角、 半卵圆 中心白质有小于 3 处的局灶性损伤(图 1),广泛 性 CWMD 表现为胼胝体等深层脑白质受累,或病 灶处 >3 处,而不伴有皮层下白质受累(图 2); 急性期 T1WI 为高信号或正常,T2WI 为低信号或 正常。部分严重病例常规 T1WI 及 T2WI 改变不明显,主要为 DWI 高信号,晚期复查时严重病例可形成 囊性脑室周围白质软化(PVL),表现为 T2WI 高 信号或 T2WI 大片不规则的高信号常伴有脑室扩张。
 |
图 1 局灶性 CWMD 组常规序列及 DWI 序列表现A、B、C 分别为局灶性 CWMD 的患儿 T1WI、T2WI 及 DWI,右侧侧脑室后角可见点状病灶(箭头所示),T1WI 呈高信号,T2WI 呈低信号,DWI 呈高信号。 |
 |
图 2 广泛性 CWMD 组常规序列及 DWI 序列表现A、B、C 分别为广泛性 CWMD 患儿 T1WI、T2WI 及 DWI, 可见侧脑室周围点状病灶(箭头所示),T1WI 呈高信号,T2WI 呈低信号病灶 >3 处,DWI 呈高信号。 |
本研究中,局灶性 CWMD 组 11 例中伴有白 质软化灶的 3 例,广泛性 CWMD 组 10 例中伴有 Ⅰ ~ Ⅱ级脑室内出血的 3 例,伴有软化灶的 4 例, 有脑室扩张的 2 例。 2.3 DTI 检查 ADC 值及 FA 值比较
三组的侧脑室周围 ADC 值差异有统计学意 义(P<0.05),表现为局灶性 CWMD 组及广泛性 CWMD 组的 ADC 值高于正常组,但局灶性 CWMD 组 与 广 泛 性 CWMD 组 之 间 差 异 无 统 计 学 意 义 (P>0.05)。3 组的侧脑室周围 FA 值差异有统计 学意义,表现为局灶性 CWMD 组和广泛性 CWMD 组均低于正常组,广泛性 CWMD 组明显低于局灶 性 CWMD 组,差异均有统计学意义(P<0.05)。 见表 3,图 3~4。
| 表 3各组 ADC 值及 FA 值比较(x±s) |
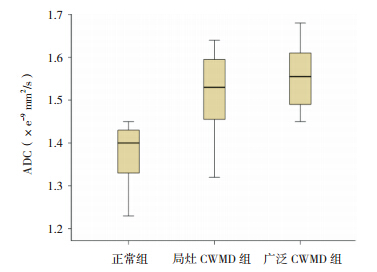 |
图 3 各组 ADC(表观弥散系数)值分布差异 可 见正常组与局灶性损伤组及广泛性损伤组比较分布差异均较大, 而两个损伤组之间比较分布差异不大。 |
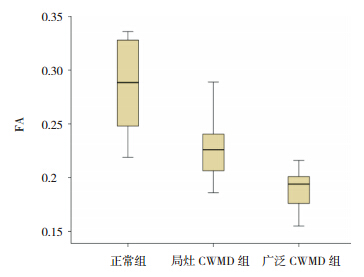 |
图 4 各组 FA(各项异性分数)值分布差异 可见 三组之间分布差异均较大。 |
三组 ADC 值及 FA 值呈负相关(r=-0.617, P=<0.01)。 2.5 FA 图比较
2.5 FA 图比较 通过后处理的彩色 FA 图可观察 FA 值的高低,红色的 FA 值最高,蓝色的最低。本研究从 FA 图 可看出,侧脑室周围白质区域的 FA 值随正常组、 局灶 CWMD 组及广泛 CWMD 组依次减低,见图 5。
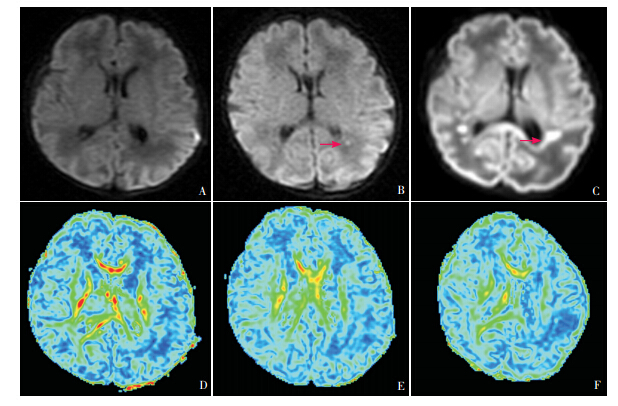 |
图 5 三组同一层面DWI序列及彩色FA图对比 A、B、C 为同一层面 DWI 序列,A 为正常组;B 为局灶性 CWMD 组, 可见左侧侧脑室后脚高信号改变(箭头所示);C 为广泛性 CWMD 组,可见两侧侧脑室后脚多处高信号,局部融合成片(箭 头所示),且有胼胝体受累。D、E、F 为同一层面的彩色 FA 图,可见随损伤程度加重侧脑室周围红色逐渐减少,蓝色逐渐增多。 |
CWMD 是早产儿比较特异的脑损伤形式,缺 氧缺血和宫内感染是其最重要的致病因素 [7]。大脑 前、中、后动脉深穿支的终末供血区均位于侧脑 室旁白质,对缺氧缺血的耐受差,易受损伤,因 此侧脑室旁为 CWMD 的高发区,所以本研究选取 侧脑室旁为感兴趣区(ROI)进行研究。
脑白质髓鞘化是脑发育成熟的重要标志,形 成髓鞘的少突胶质细胞(oligodendrocyte,OL)一 旦受损便会引起髓鞘化延迟,但它的易损性是成 熟依赖性的 [6],成熟的 OL 相对不容易受损伤, 23~32 周早产儿脑白质 OL 前体细胞较多,损伤后 会导致髓鞘化不良,引起白质减少及脑室扩大。
现已应用较广泛的 DWI 技术无论何种程度的 白质损伤在早期便可显示病变区域的高信号,本 研究中广泛性 CWMD 组有的病例首次头 MRI 检查 在生后 1~2 周内完成,表现为 DWI 高信号,伴有 深层脑白质受累,T1WI 及 T2W1 无明显信号改变, 提示早期诊断方面 DWI 比常规 MRI 更具优势,此 点已被证实 [8, 9] 。
DTI 是 DWI 基础上发展起来的一种新的磁共 振成像技术,其在扫描过程中施加一个弥散敏感梯度脉冲,通过对各种参数的测定定量分析水分 子的在各个方向的弥散特征反映白质的发育及损 伤情况,在各种参数中 ADC 值及 FA 值是比较敏 感的 [10];ADC 反映了水分子的弥散能力,主要是 由组织的含水量决定的,而脑白质中,水分子主 要沿轴突的方向弥散,这种弥散方向的依赖性称 为各项异性,而 FA 被认为是最理想测定各向异性 的参数 [11],它代表了沿轴突的弥散与总弥散的比 值,取值范围 0~1,越接近 1 表示各向异性程度 越大,正常脑白质发育过程中含水量逐渐减少, ADC 值逐渐降低,而伴随轴突髓鞘化的逐步完善, 神经纤维逐渐成熟,水分子的在垂直轴突方向上 弥散受到限制,各项异性 FA 值逐渐增加 [12],因此 ADC 值及 FA 值会随胎龄及日龄的不同而不同,而 本研究在中各组在胎龄及日龄上都是有均衡可比 性的。
一般认为,各向异性的变化与轴突的完整性 和髓鞘的成熟度有关 [13],CWMD 是常伴有白质细 微结构及水分子扩散度的改变,而这些改变往往 是与损伤程度相关的,研究表明髓鞘形成迟缓及 神经束受损的情况下,其各向异性会明显降低, 因此 DTI 能早期客观的评价 CWMD[14, 15, 16],本研究中 局灶性 CWMD 组及广泛性 CWMD 组与正常组比较,FA 值及 ADC 值均有明显变化,差异有统计学意义, 证实了 DTI 在 CWMD 评价中的意义。
本研究中有 5 例患儿为头 MRI 复查,比较相 同较正胎龄的正常组患儿 ADC 值高,而 FA 值低, 提示 CWMD 后的神经纤维的发育受到了影响。
ADC 值与 FA 值在评价脑白质发育及损伤中 敏感度也不相同,本研究中 ADC 值及 FA 值存在 一定相关性,但局灶 CWMD 组与广泛 CWMD 组之 间 ADC 值比较差异不明显,这里可能受到样本量 少的影响,但也可能提示在脑白质的发育损伤的 评价中参数 FA 要比 ADC 值更精确,相关研究发 现健康的早产儿在纠正胎龄足月时与正常足月儿 相比较,ADC 值无明显差异,而早产儿组中中央 白质区域的 FA 值要比足月儿组低 [17],这可能是因 为相对组织中水含量的变化,轴突髓鞘化及发育 的变化程度更大,持续时间更长,而后者往往更 能体现白质纤维的发育及损伤程度。
基于 DTI 技术经后期处理得到的各向异性 FA 图可较直观的观察白质区域的成熟度,本研究中 随损伤程度的加重,FA 图的颜色变化较明显,且 常常为整体的颜色变化,提示并非单一的神经纤 维发育受累;本研究中检查的时间大部分脑白质 处在髓鞘化过程中,尚未发育成熟,图像中为大 片的蓝、绿颜色,对某一具体部位的病变的可能 并不能用肉眼分辨,仍需测量 FA 值做定量的分析。
综上 DTI 技术可定量评估微小型 CWMD 程度。 在 CWMD 评价方面,FA 值比 ADC 值可能更加准 确。同时,DTI 也可用于远期预后的评估,国外有 关于早产儿在学龄期或青春期的认知运动缺陷与 DTI 参数之间关系的研究,证明有认知及运动缺陷 的早产儿特定部位的 FA 值都较低 [18]。因此进行不 同程度 CWMD 的动态 DTI 研究对判断远期预后是 有重要意义的。
| [1] | Volpe JJ. Cerebral white matter injury of the premature infantmore common than you think[J]. Pediatrics, 2003, 112(1):176-179. |
| [2] | Wilson-Costello D, Friedman H, Minich N, et al. Improved neurodevelopmental outcomes for extremely low birth weight in-fants in 2000-2002[J]. Pediatrics, 2007, 119(1):37-45. |
| [3] | Inder TE, Huppi PS, Zientara GP, et a1. Early detection of periventricular leukoma lacia by diffusion weighted magnetic resonanceimaging techniques[J]. J Pediatr, 1999, 134(5):631-634. |
| [4] | Niwa T, de Vries LS, Benders MJ, et al. Punctate white matter lesions in infants:new insights using susceptibility-weighted imagine[J]. Neuroradiology, 2011, 53(9):669-679. |
| [5] | Bassi L, Chen A, Merchant N, et al. Diffusion Tensor Imaging in preterm infants with punctate white matter lesions[J]. Pediatric Research, 2011, 69(6):561-566. |
| [6] | 陈丹, 毛健, 李娟, 等. 晚期早产儿CWMD 临床特点及磁共 振影像学发现[J]. 中国当代儿科杂志, 2010, 12(5):321-326. |
| [7] | Back SA, Riddle A, McClure MM. Maturation-dependent vulnerability of perinatal white matter in premature birth[J]. Stroke, 2007, 38(2 Suppl):724-730. |
| [8] | Counsell SJ, Allsop JM, Harrison MC, et al. Diffusion-weighted imaging of the brain in preterm infants with focal and diffuse white matter abnormality[J]. Pediatrics, 2003, 112(1):1-7. |
| [9] | Inder TE, Scott JW, Mogridge NB, et al. Defining the nature of the cerebral abnormalities in the premature infant:a qualitativemagnetic resonance imaging study[J]. J Pediatr, 2003, 143(2):171-179. |
| [10] | Van Pul C, Buijs J, Janssen MJA, et al. Selecting the best index for following the temporal evolution of apparent diffusiong coefficient and diffusion anisotrophy after hypoxic-ischemic white matter injury in neonates[J]. AJNR Am J Neuroradiol, 2005, 26(3):469-481. |
| [11] | Sorensen AG, Wu O, Copen WA, et al. Human acute cerebral ischemia:detection of changes in water diffusion anisotropy by using MR imaging[J]. Radiology, 1999, 212(3):785-792. |
| [12] | Lebel C, Walker L, Leemans A, et al. Microstructural maturationg of the human brain from childhood to adulthood[J]. NeuroImage, 2008, 40(3):1044-1055. |
| [13] | Arfanakis K, Haughton VM, Carew JD, et al. Diffusion tensor MR imagine in diffuse axonal injury[J]. AJNR AM J Neuroradiol, 2002, 23(5):794-802. |
| [14] | Chenevert TL, Brunberg JA, Pipe JG. Anisotrpic diffusion in human white matter:demonstration with MR techniques in vivo[J]. Radiology, 1990, 177(2):401-405. |
| [15] | Tam EW, Ferriero DM, Xu D, et al. Cerebellar development in the preterm neonate:effect of supratentorial brain injury[J]. Pediatr Res, 2009, 66(1):102-106. |
| [16] | Neil J, Miller J, Mukherjee P, et al. Diffusion tensor imaging of normal and injured developing human brain -a technical review[J]. NMR Biomed, 2002, 15(7-8):543-552. |
| [17] | Huppi PS, Murphy B, Jeier SE, et al. Microstructural brain development after perinatal cerebral white matter injury assessed by diffusion tensor magnetic resonance imaging[J]. Pediatrics, 2001, 107(3):455-460. |
| [18] | Skranes JS, Vangberg TR, Kulseng S, et al. Clinical findings and white matter abnormalities seen on diffusion tensor imaging in adolescents with very low birth weight[J]. Brain, 2007, 130(3):654-666. |
 2015, Vol. 17
2015, Vol. 17