癫癎是危害儿童身心健康和认知功能的神经 系统的重要疾病之一,目前发病机制还不完全清 楚,遗传因素在其中占有重要的地位。哺乳动物 雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是一种进化上高度保守的苏氨酸 / 丝氨酸 蛋白激酶,其广泛参与到包括神经发育在内的多 项生理病理过程。目前研究表明,mTOR 信号通路 的异常激活和癫癎的发生发展有着重要联系 [1],动 物实验发现,雷帕霉素不仅可以控制癫癎发作, 还能够改善甚至逆转相关的病理改变 [2]。然而,该 信号通路异常介导癫癎发生发展的分子机制仍不 是十分清楚。
mTOR 基因上存在许多单核苷酸多态性(SNP) 位点,其中 rs2295080 位于该基因的启动子区,与 基因的转录活性相关,rs2536 位于该基因的 3' 非 翻译区(3'UTR),能够影响 miRNA 的结合 [3]。 以上两个 SNP 位点能够分别在转录和翻译水平调 控 mTOR 基因的表达,导致 mTOR 信号通路活性 的改变,进而可能与癫癎的发生发展相关。本研 究以我国中部地区儿童为研究对象,通过对癫癎 患儿以及健康对照儿童 mTOR 基因 SNP rs2295080 和 rs2536 位点的检测,探讨 mTOR 基因多态性与 儿童癫癎易感性的相关性。 1 资料与方法 1.1 研究对象
2010 年 9 月至 2012 年 9 月我院神经内科门诊 或住院的 480 例癫癎患儿作为研究对象,所有患 儿均行脑电图(EEG)、头颅 CT 或 MRI 检查,诊 断标准参照 2005 年国际抗癫癎联盟(ILAE)和国 际癫癎局(IBE)对癫癎的最新定义 [4]。480 例癫 癎患儿中,难治性癫癎(RE)116 例,非 RE 364 例。RE 患儿的入选标准为:临床上每月 4 次以上 频繁的癫癎发作,应用抗癫癎药物进行正规治疗 且血药浓度在有效范围之内,两年以上仍不能控 制发作,同时排除了进行性中枢神经系统疾病或 占位性病变。并选择同时期体检正常的汉族儿童 503 例作为对照组。本研究经我院学术伦理委员会 讨论通过并获得家长书面知情同意。
癫癎组 480 例患儿中,男 277 例,女 203 例, 均为汉族,平均年龄 5.1±3.2 岁;对照组儿童 503 例,男 296 例,女 207 例,均为汉族,平均年龄 5.5±3.5 岁。两组儿童的年龄、性别差异无统计学 意义(P>0.05)。 1.2 基因组 DNA 的提取
采集患儿静脉血 2 mL,用 DNA 抽提试剂盒 (Axygen)提取基因组 DNA,并测定其浓度。 1.3 mTOR 基因多态性分析
针 对 mTOR 的 两 个 SNP 位 点 rs2295080 和rs2536,分别设计引物(上海生工公司合成): mTOR rs2295080-F:5'-GTGGGTCTGGACATTACGCC -3';mTOR rs2295080-R:5'-CAGTCCATCTTCTCCCTATACCTG-3';mTOR rs2536-F:5'-TGCAGCAGGGTTCTGGGATGTTT-3';mTOR rs2536-R: 5'-TTTAGTTGAGTATTTGTTCTGCTCAGAATT-3'。
PCR 反应体系为:基因组 DNA 100 ng,dNTP 200 μM,MgCl2 1.5 mM,上 下 游 引 物 各 0.5 μM, Taq DNA 聚 合 酶(TAKARA)1 U,加 水 至 终 体 积 25 μL。PCR 反 应 条 件:94 ℃ 预 变 性 3 min; 然 后 94 ℃ 变 性 30 s,55 ℃ 退 火 30 s,72 ℃ 延 伸 30 s,35 个 循 环; 最 后 72 ℃ 延 伸 5 min。 取 5 μL PCR 扩增产物分别利用限制性内切酶(NEB)FokI (rs2295080)和 EcoRI(rs2536)进行酶切处理后, 于 3% 琼脂糖凝胶中电泳 30 min 观察条带并判定 基因型。 1.4 统计学分析
利用 SPSS 17.0 统计软件进行统计学分析,频 率计数法计算癫癎组和对照组基因型和等位基因 频率,并利用 Hardy-Weinberg 遗传平衡定律检验。 各组间基因型频率分布和等位基因频率分布比较 采用 χ2 检验,关联程度采用 logistic 回归分析,以 OR 和 95%CI 表示,P<0.05 为差异有统计学意义。 2 结果 2.1 mTOR 基因多态性的判读
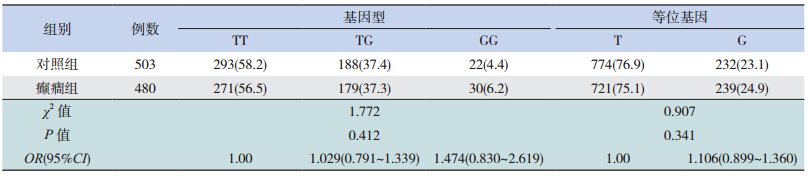
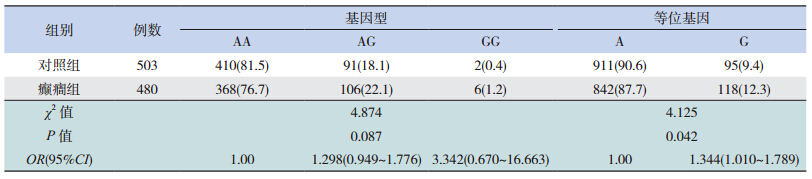
利 用 PCR-RFLP 对 mTOR 基 因 多 态 性 进 行 检 测: 对 于 rs2295080 位 点,PCR 扩 增 产 物 为 222 bp,经 FokI 酶切后,TT 基因型为 167 和 55 bp 两个片段,TG 基因型为 222、167 和 55 bp 3 个片 段,GG 基因型为 222 bp 1 个片段(图 1);对于 rs2536 位 点,PCR 扩 增 产 物 为 149 bp,经 EcoRI 酶切后,AA 基因型为 149 bp 1 个片段,AG 基因 型 为 149、121 和 28 bp 3 个 片 段,GG 基 因 型 为 121 和 28 bp 两个片段(图 1)。
 |
图 1 mTOR 基因两个 SNP 位点基因型的确定rs2295080 位点的 3 个基因型分别为 TT、TG 和 GG;rs2536 位 点的 3 个基因型分别为 GG、AG 和 AA。 |
癫癎组和对照组两组经检验均符合 HardyWeinberg 遗传平衡定律,说明其具有群体代表性。 对于 rs2295080 位点,癫癎组和对照组中的基因型 及等位基因频率差异均无统计学意义(表 1)。对 于 rs2536 位点,癫癎组和对照组中的基因型分布 总体差异无统计学意义(P=0.087),但癫癎组的G 等位基因频率高于对照组,表明 G 为易感等位 基因(OR=1.344,P=0.042,95%CI:1.010~1.789) (表 2)。
| 表 1癫癎组和对照组间 rs2295080 位点基因型及等位基因频率比较 [ 例(%)] |
| 表 2癫癎组和对照组间 rs2536 位点基因型及等位基因频率比较 [ 例(%)] |
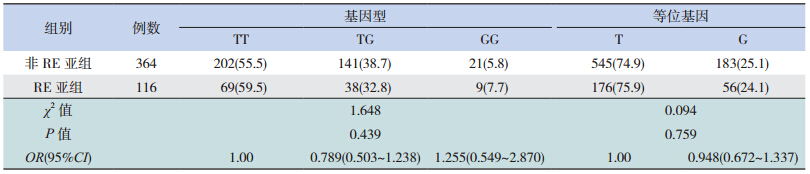
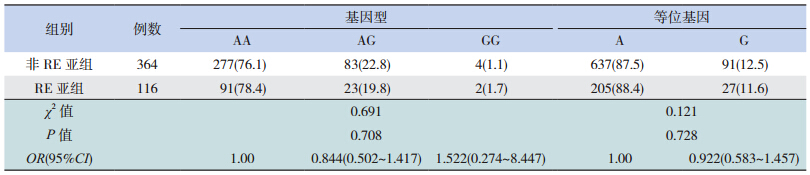
RE 亚 组 和 非 RE 亚 组 rs2295080 位 点 和 rs2536 位点的基因型及等位基因频率差异均无统 计学意义(表 3~4)。
| 表 3RE 亚组和非 RE 亚组间 rs2295080 位点基因型及等位基因频率比较 [ 例(%)] |
| 表 4RE 亚组和非 RE 亚组间 rs2536 位点基因型及等位基因频率比较 [ 例(%)] |
mTOR 基 因 定 位 于 染 色 体 1p36.2 上,编 码 的 蛋 白 质 含 有 2 549 个 氨 基 酸 残 基,分 子 量 为 289 KD,是一种保守的丝氨酸 / 苏氨酸蛋白激酶。 mTOR 在 人 体 内 以 两 种 复 合 物 的 形 式 存 在,即 mTORC1 和 mTORC2,其受上游多种信号途径调控, 主要包括 PI3K/Akt 通路的激活作用和 LKB1/AMPK 通路的抑制作用 [5, 6],然后 mTOR 通过磷酸化核糖 体 S6 蛋白激酶(RSK)和起始因子 4E 结合蛋白 (4E-BPs)等多种翻译因子调节细胞的生长、增殖、 分化和代谢 [6, 7]。
在大脑皮层的发育过程中,mTOR 信号通路 发挥了关键的作用 [7],该通路受到多种因子的负调 控,其中包括肿瘤抑制基因 TSC1 和 TSC2,以及 它们的上游调控子 PTEN、NF1 和 STRADA 等 [8]。 这些基因的突变会导致 mTOR 信号通路的异常激 活,从而产生异常的分化、增殖和生长等细胞学 效应,并引发多种遗传性癫癎疾病,例如结节性 硬化症、多发性神经纤维瘤、Proteus 综合征、羊 水过多 - 巨颅 - 症状性癫癎综合征等。最近的几 组研究表明,在半侧巨脑畸形所致的顽固性癫癎 患儿体内,存在 PI3K、AKT3 和 mTOR 基因的突 变 [9, 10]。在一项以婴儿痉挛和 Lennox-Gastaut 综合 征为代表的癫癎性脑病患儿新生突变的筛查中, 也发现了 mTOR 基因的突变,并且该突变不伴随 脑部畸形 [11]。这些结果表明,mTOR 上游的调控 因子以及 mTOR 自身的异常与癫癎的发病相关。 然而,mTOR 信号通路异常介导癫癎发生发展的下 游分子机制仍不十分清楚,从已有的研究推测, 其可能与离子通道、细胞凋亡、炎症因子、胶质 增生和突触可塑性等一系列的异常相关 [12]。
目前,mTOR 基因上已发现有 3 000 多个 SNP 位点,其中 rs2295080 位点定位于该基因的启动子区域,被证明与转录调控相关,含有等位基因 T 的启动子具有较高的转录活性,相应的基因型为 TT 的个体 mTOR 的 mRNA 水平较高 [13];rs2536 位 点定位于该基因的 3' 非翻译区,被认为与 miRNA 的结合相关,包含两种等位基因的序列,分别能 结合不同的 miRNA,从而在翻译水平调控 mTOR 的表达 [14]。鉴于 mTOR 在 PI3K/AKT/mTOR 信号通 路中的核心作用,推测其多个功能性的 SNP 位点 可能参与到该信号通路的调控中,特别是以上两 个 SNP 位点,它们能分别在转录和翻译水平调控 mTOR 基因的表达,进一步导致 mTOR 通路活性 的改变,从而可能和多种疾病相关联。目前研究 得比较多的是 mTOR 基因多态性和癌症的相关性: mTOR rs2295080 与多种癌症的易感性相关,携带 TT 基因型人群的患病风险增加 [15];mTOR rs2536 与前列腺癌以及小儿急性淋巴细胞白血病具有相 关性 [14, 15],但与其他类型的癌症并未发现关联。 虽然已知 mTOR 信号通路异常和癫癎的发病相关, 但 mTOR 基因多态性与癫癎的相关性还未见报道, 在小儿癫癎中进行该基因多态性的研究,对于阐 明 mTOR 信号通路的异常激活导致癫癎发生发展 的机制具有重要意义。
本 研 究 探 讨 了 mTOR 基 因 两 个 多 态 性 位 点和小儿癫癎易感性的相关性,其中 SNP 位点 rs2295080 与小儿癫癎易感性未见相关性,而 SNP 位点 rs2536 的 G 等位基因频率在癫癎组中显著高 于对照组,表明 G 可能为癫癎的易感等位基因; 另外,RE 和非 RE 患儿以上两个 SNP 位点基因频 率的分布没有显著性差异。然而,在癫癎患儿体内, SNP 位点 rs2536 是如何致病的,其激活 mTOR 信 号通路并影响患儿神经系统功能的相关机制还不 清楚,这是我们下一步探索和研究的重点。本研 究探讨的是 mTOR 基因的两个多态性与小儿癫癎 易感性的相关性,而并非 mTOR 基因突变研究,此外研究对象的父母,特别是对照组儿童父母血 液的获取也存在一定难度,因此并没有检测研究 对象父母相应的基因型和等位基因频率。
综上所述,mTOR 基因 SNP 位点 rs2536 与小 儿癫癎易感性可能存在相关性,但是该位点导致 mTOR 信号通路的异常激活,进而介导癫癎发生的 具体机制还需要继续深入研究。同时,通过扩大 样本量和增加 mTOR 基因 SNP 位点等手段,有助 于深入探索 mTOR 基因多态性和癫癎的相关性, 从而进一步揭示 mTOR 信号通路介导癫癎发生发 展的分子机制。
| [1] | Lipton JO, Sahin M. The neurology of mTOR [J]. Neuron, 2014, 84(2):275-291. |
| [2] | Zeng LH, Rensing NR, Wong M. The mammalian target of rapamycin signaling pathway mediates epileptogenesis in a model of temporal lobe epilepsy [J]. J Neurosci, 2009, 29(21):6964-6972. |
| [3] | Shao JB, Li Y, Zhao PW, et al. Association of mTOR polymorphisms with cancer risk and clinical outcomes:a metaanalysis[J]. PloS one, 2014, 9(5):e97085. |
| [4] | Fisher RS, van Emde Boas W, Blume W, et al. Epileptic seizures and epilepsy:definitions proposed by the International League Against Epilepsy (ILAE) and the International Bureau for Epilepsy (IBE) [J]. Epilepsia, 2005, 46(4):470-472. |
| [5] | Kwiatkowski DJ. Tuberous sclerosis:from tubers to mTOR [J]. Ann Hum Genet, 2003, 67(Pt1):87-96. |
| [6] | Inoki K, Corradetti MN, Guan KL. Dysregulation of the TSCmTOR pathway in human disease [J]. Nat Genet, 2005, 37(1):19-24. |
| [7] | Crino PB. mTOR:A pathogenic signaling pathway in developmental brain malformations [J]. Trends Mol Med, 2011, 17(12):734-742. |
| [8] | Galanopoulou AS, Gorter JA, Cepeda C. Finding a better drug for epilepsy:The mTOR pathway as an antiepileptogenic target[J]. Epilepsia, 2012, 53(7):1119-1130. |
| [9] | Lee JH, Huynh M, Silhavy JL, et al. De novo somatic mutations in components of the PI3K-AKT3-mTOR pathway cause hemimegalencephaly [J]. Nat Genet, 2012, 44(8):941-945. |
| [10] | Poduri A, Evrony GD, Cai X, et al. Somatic activation of AKT3 causes hemispheric developmental brain malformations [J]. Neuron, 2012, 74(1):41-48. |
| [11] | Epi4K Consortium; Epilepsy Phenome/Genome Project (Allen AS, Berkovic SF, Cossette P, et al). De novo mutations in epileptic encephalopathies [J]. Nature, 2013, 501(7466):217-221. |
| [12] | 林堃, 林元相, 康德智. mTOR 信号通路与癫癎[J]. 国际神经 病学神经外科学杂志, 2012, 39(2):168-172. |
| [13] | Cao Q, Ju X, Li P, et al. A functional variant in the MTOR promoter modulates its expression and is associated with renal cell cancer risk [J]. PLoS One, 2012, 7(11):e50302. |
| [14] | Li Q, Gu C, Zhu Y, et al. Polymorphisms in the mTOR gene and risk of sporadic prostate cancer in an Eastern Chinese population[J]. PLoS One, 2013, 8(8):e71968. |
| [15] | Huang L, Huang J, Wu P, et al. Association of genetic variations in mTOR with risk of childhood acute lymphoblastic leukemia in a Chinese population [J]. Leuk Lymphoma, 2012, 53(5):947-951. |
 2015, Vol. 17
2015, Vol. 17