2. 重庆医科大学附属成都第二临床学院/成都市第三人民医院 检验科, 四川 成都 610031;
3. 重庆医科大学附属儿童医院PICU, 重庆 400014
流感嗜血杆菌(Haemophilus influenzae,Hi) 是引起儿童细菌性结膜炎、结膜炎 - 耳炎症候群、 细菌性鼻窦炎、下呼吸道感染的常见病原菌 [1]。在 常规接种 Hib 联合疫苗前,Hib 是侵入性 Hi 的主 要亚型和 5 岁以下儿童细菌性脑膜炎的最常见病 因 [2],严重感染可以导致患儿致残或死亡。文献报 道,自 20 年前 Hib 结合疫苗问世以来 Hib 感染迅 速下降,且几乎没有出现能取代 Hib 重要位置的 其他亚群感染 [1, 3]。随着 Hib 感染的下降,全球范 围内对 Hi 的关注程度也随之降低,每千篇病原学 文章中与 Hi 相关文章比例从 1991 年的 18.4‰降 至 2009 年的 7‰ [4]。实际上,不可分型流感嗜血 杆 菌(non-typeable Haemophilus influenzae,NTHi) 可能正在悄然取代 Hib 成为重要的儿童呼吸道感 染病原菌,但并未得到应有的关注 [1]。本课题组 前期在一项针对儿童下呼吸道感染病原菌的研究 中发现 Hi 在 2001~2006 年成都地区儿童下呼吸 道感染病原菌中排列第一,占下呼吸道感染病原 菌的 21%[5]。同期分子分型研究发现其中 NTHi 占 99.6%[6, 7, 8]。既往国内对儿童 Hi 感染临床流行病学 背景以及同一地区、长时间跨度的病原菌耐药动 态少有系统报道。为追踪同一地区近两年 0~17 岁 住院患儿 Hi 阳性分离者的基本临床流行病学特 征及 β- 内酰胺酶阴性氨苄西林耐药(β-lactamasenonproducing-ampicillin-resistant,BLNAR)和含有多 重耐药机制的 β- 内酰胺酶阳性阿莫西林克拉维酸 耐 药(β-lactamase-producing-amoxicilli/clavulanateresistant,BLPACR)菌株等耐药动态,本课题组以 本地区一家综合性三甲医院为研究现场进行回顾 性断面调查,现报告如下。 1 资料与方法 1.1 研究对象
以成都市第三人民医院住院患儿痰液或咽拭 子标本 Hi 分离阳性者为研究对象进行回顾性断面 调查。 1.2 数据库建立
进入医院微生物室信息系统,以 Hi 为关键词 检 索 2011 年 6 月 1 日 至 2013 年 5 月 31 日 0~17 岁住院患儿痰液或咽拭子标本 Hi 分离阳性住院患儿的基本信息,查阅电子病历并建立数据库。儿 科疾病诊断标准参照《诸福棠实用儿科学》 [9],儿 童社区获得性肺炎(community-acquired pneumonia, CAP)诊断标准和分度标准采用中华医学会儿科学 分会呼吸学组 2013 年修订的“儿童社区获得性肺 炎管理指南(2013 修订)” [10] 标准。 1.3 标本采集
痰液采集通过一次性鼻导管或气管插管负 压吸取痰液;咽拭子采集方法为左手用压舌板压 住患儿舌头,待患儿发“啊 -”音时,右手持无 菌拭子擦拭双侧咽扁桃体及咽后壁(避免触及舌 部),将拭子头浸入采集液中。痰液和咽拭子采 样合格标准为:涂片细胞学检查显示中性粒细胞 >25 个 / 低 倍 视 野(×100 倍),鳞 状 上 皮 细 胞 <10 个 / 低倍视野(×100 倍),或白细胞 / 鳞状 上皮细胞≥ 10[11]。 1.4 流感嗜血杆菌培养和鉴定
操作严格按照“全国临床检验操作规程”第 2 版进行。将质控合格的痰及咽拭子标本常规接种 于哥伦比亚血琼脂平板、嗜血杆菌巧克力平板及 麦康凯平板,血平板培养基为 5% 脱纤维绵羊血; 嗜血杆菌巧克力平板另加2.5 U/mL去甲万古霉素。 挑取嗜血杆菌巧克力平板上湿润、光滑、易乳化 的菌落,用 V 因子、X 因子及 V+X 因子纸片行 Hi 初筛实验,再用 NH 鉴定卡进一步鉴定。培养基及 因子纸片均购自英国 OXOID 公司,NH 鉴定卡购 自美国 Thermo Scientific 公司。 1.5 药物敏感试验
用法国生物梅里埃 ATB 药敏卡进行药敏试验。 用 ATCC49247 Hi 标准菌株进行质控,标准菌株购 自卫生部临检中心,药敏结果判断依据美国临床 实验室标准化研究所(CLSI)2012 年标准执行 [12]。 1.6 β- 内酰胺酶测定
用英国 OXOID 公司提供的头孢硝基噻吩显色 反应法检测。 1.7 统计学分析
采用 SPSS 20.0 统计软件进行统计学分析,计 数资料以例数和百分率(%)表示,组间比较采用 χ2 检验或 Fisher 确切概率法,P<0.05 为差异有统 计学意义。 2 结果 2.1 基本情况
2011 年 6 月至 2013 年 5 月 0~17 岁住院患儿 送检痰液和咽拭子标本分离出 Hi 117 株,排除同 一患儿同一时段和不同时段采集多份标本分离出 的 Hi 菌株 6 株,Hi 分离阳性患儿共 111 例纳入调 查,男 63 例,女 48 例。年龄段分布:0~28 d 7 例 (6.3%),29 d~1 岁 32 例(28.8%),2~3 岁 37 例(33.3%),4~6 岁 25 例(22.5%),7~17 岁 10 例(9.0%)。时间分布:1~12 月分别为 12 例、 2 例、12 例、10 例、22 例、10 例、5 例、3 例、4 例、7 例、18 例和 6 例,时间分布趋势见图 1,纳 入调查的 24 个月均有 Hi 检出,两个年度的共同 检出高峰均在 5 月和 11 月。
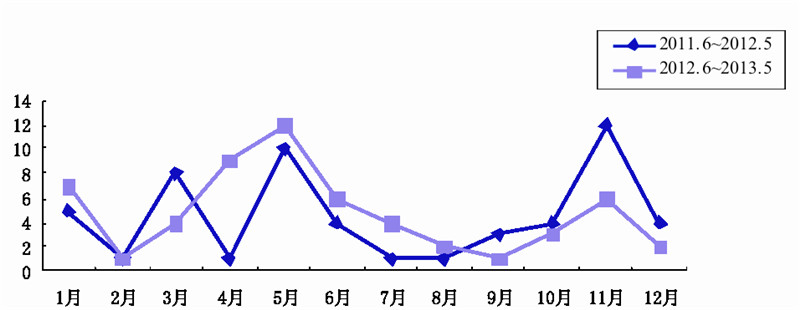 |
图 1 Hi 阳性检出月份分布 |
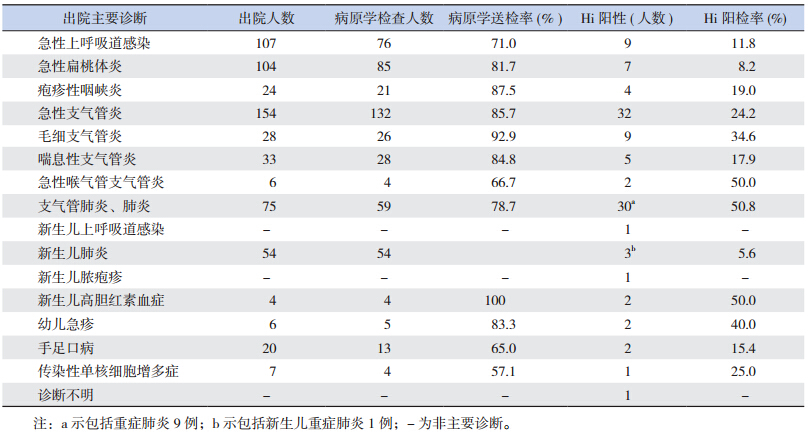
117 株 Hi 中痰液分离 87 株(74.4%),咽拭 子 30 株(25.6%),不同疾病病原学送检情况及 Hi 阳性检出情况见表 1。111 例 Hi 阳性患儿中呼吸道感染性疾病 102 例(91.9%),其他疾病 9 例 (8.1%)。其中以支气管肺炎及肺炎患儿 Hi 检出 率最高,急性喉气管支气管炎阳检率次之,其他 依次为毛细支气管炎、急性支气管炎、喘息性支 气管炎、疱疹性咽峡炎、急性上呼吸道感染、急 性扁桃体炎等,新生儿肺炎检出率最低。上述疾 病患儿出院总数为 622 例,病原学检查 511 例, 病原学送检率 82.2%,Hi 总阳检率 21.7%。本组未 发现脑膜炎病例,肺炎患儿 Hi 检出率达到 51%, 27 例 CAP 中 10 例重症肺炎均存在不同程度的意 识障碍和呼吸困难,2 例患儿出现呼吸衰竭,全部 患儿胸片均显示不同程度的肺浸润表现。
| 表 1 主要诊断与 Hi 阳检率 |
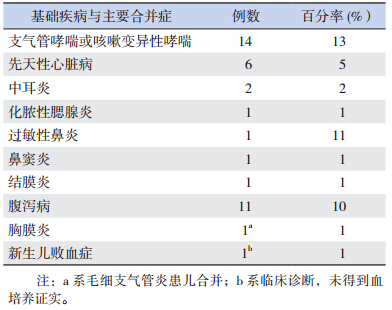
患儿基础疾病和主要合并症见表 2,常见基 础疾病依次为支气管哮喘或咳嗽变异性哮喘、先 天性心脏病,常见合并症依次为腹泻病、中耳炎、化脓性腮腺炎、鼻窦炎、结膜炎等。分别有 1 例 合并胸膜炎,1 例合并新生儿败血症,5 例患儿从 痰液或咽拭子中分离出其他病原菌,包括肺炎链 球菌 3 例,金黄色葡萄球菌 2 例。全部患儿治愈或好转出院,无一例死亡。
| 表 2 患儿基础疾病与主要合并症 (n=111) |
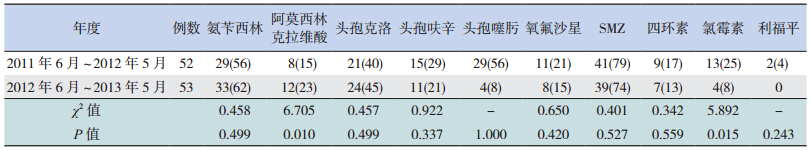
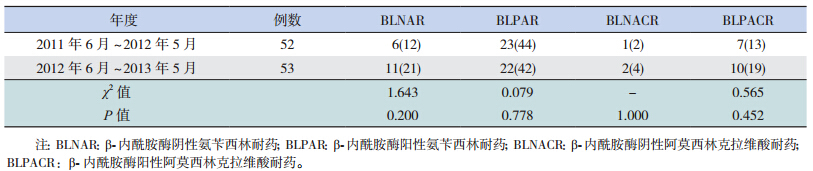
Hi 阳性检出者中剔除药敏试验结果不全 6 例, 共 105 例纳入统计分析。第一年度 Hi 产 β- 内酰 胺酶的产酶率为 44%(n=52),第二年度为 42% (n=53),两年间比较差异无统计学意义(χ2=0.079, P=0.778)。两年间 Hi 菌株耐药率比较见表 3,除 阿莫西林克拉维酸(P=0.010)和氯霉素(P=0.015) 外,余差异无统计学意义。β- 内酰胺酶阴性氨 苄西林耐药菌株(BLNAR)和 β- 内酰胺酶阳性 阿莫西林克拉维酸耐药菌株(BLPACR)两年间 均有增长,分别从 12% 增加到 21%,13% 增加到 19%,但差异未显示出统计学意义,见表 4。
| 表 3 Hi 菌株耐药率 [n(%)] |
| 表 4 Hi 菌株耐药表型变化[n(%)] |
近 20 年来,多个国家的监测数据显示 NTHi 侵入性感染发生率因年龄不同和地域不同有所差 异。 美 国 1989 年 Hi 侵 入 性 感 染 80% 为 Hib、 17% 为 NTHi 导 致,2008 年 3% 为 Hib、68% 为 NTHi;1999~2008 年间 NTHi 年发生率是 0.99/10 万, 发生率最高是 1 岁内婴儿(5.87/10 万)和 >65 岁 的 成 人(4.09/10 万) [13]。1992~2006 年,14 个 将 Hi 常规进行血清型鉴定的国家监测数据显示与上 年同比侵入性非 Hib 型感染性疾病上升 3.5% 且主 要由 NTHi 引起,NTHi 感染占 97%[14]。确诊下呼吸道感染病原菌标本目前公认最可靠的方法是经 胸廓细针穿刺活检,但临床上并不被常规采用, 因此,通常采用其他非直接诊断标本采样,如血液、 痰液和支气管肺泡灌洗液(broncho-alveolar lavage, BAL)培养 [1]。研究认为尽管下呼吸道感染患儿痰 和 BAL 培养常被鼻咽部微生物污染,但此类标本 按标准流程收集仍能够提供有价值的下呼吸道微 生物定植的信息 [15, 16]。20%~94% 的 CAP 患儿合格 痰液标本和 BAL 中被检出 NTHi[17, 18, 19]。过去认为会 厌炎是特有的侵入性 Hib 疾病 [1],本组病例未见会 厌炎诊断病例,但 4 例急性喉气管支气管炎住院 患儿中 2 例检出 Hi,患儿存在不同程度的喉梗阻,是否属于 Hi 侵入性感染尚需在前瞻性研究中进一 步证实。值得注意的是,本研究有 7 例新生儿患儿, 其中高胆红素血症合并败血症 1 例未得到血培养 证实,另 1 例重症肺炎合并心肌损害和脑病患儿 临床经过险恶。国外文献报道新生儿 NTHi 侵入性 感染发生率为 1.6~4.9/1 000 活产婴 [20, 21, 22],多数新生 儿 NTHi 侵入性感染病例缺乏典型表现,病情进展 迅猛并伴随着高病死率,早产儿暴发病例通常在 24 h 内死亡。因此新生儿 Hi 感染应引起临床医师 高度警惕。
NTHi 气道定植是引起气道感染和组织损伤的 主要病因 [23],国外文献报道顽固的细菌性支气管 炎在 <5 岁的儿童常见,以慢性咳嗽为特征且临床 难以辨别 [24, 25],而顽固性细菌性支气管炎患儿痰 液 Hi 阳性检出率达到 81%[26]。本研究中毛细支气 管炎、急性支气管炎和喘息性支气管炎住院患儿 Hi 阳性占有相当的比例,是否属于继发或原发性 细菌性支气管炎尚需进一步研究证实。NTHi 是引 起慢性化脓性中耳炎、鼻窦炎的重要原因,也是 儿童细菌性结膜炎和结膜炎耳炎症候群的常见病 原菌 [27, 28],本研究中呼吸系统感染合并中耳炎、 鼻窦炎、结膜炎仅各 1 例,诊断率偏低,推测与 我国儿童呼吸道感染患儿未常规进行耳镜检查导 致中耳炎和鼻窦炎临床诊断率低有关。
β- 内酰胺酶仍然是 Hi 耐 β- 内酰胺类药物的 主要机制,过去 10 年中全球大多数地区菌株 β- 内 酰胺酶阳性率在 10%~25% 之间,而部分亚洲国家 和地区则达到 55%[1]。本研究中产 β- 内酰胺酶 Hi 菌株较本课题组 2004~2006 年报道的 40.2% 略有 增加 [5];氨苄西林耐药率较上一调查年度有所上 升,与 2004~2006 年间同地区的 40.6% 相比增长 了 21.66%[5];除头孢噻肟耐药率持续保持在较低水 平并较 2004~2006 年间同一地区的 12.5% 下降近 1 倍外,头孢呋辛和头孢克洛耐药率两年间差异无 统计学意义 [5],上述 β- 内酰胺类耐药率的变化与 产 β- 内酰胺酶菌株的变化不完全保持一致,菌株 耐药机制的变化尚待进一步的前瞻性研究证实。
1984 年 前 全 球 未 分 离 到 BLNAR 和 对 β- 内 酰 胺 类 药 物 耐 药 的 非 β- 内 酰 胺 酶 依 赖 性 中 介 (BLNAI)菌株,1990 年代 BLNAR 开始小幅上升, 但 2000 年以后 BLNAR 和 BLNAI 菌株在不同国家 和地区快速增长 [1]。本研究中 BLNAR 从上一年度的 12% 增长至 21%,明显高于 2010 年杭州 1.32% 和厦门 2.99% 的增长幅度 [29, 30],也略高于 Ito 等 [31] 报道 2007 年日本 NTHi 菌株的 17.6%。BLNAR 基 因型对多种抗菌素耐药,其耐药机制主要是青霉 素结合蛋白改变致 β- 内酰胺类抗菌素与其结合能 力降低以及外膜蛋白通透性改变致抗菌药物进入 菌体内减少导致耐药发生 [32]。多重耐药机制菌株 BLPACR 的出现和蔓延与 BLNAR 及 BLNAI 类似, 由于 BLPACR 除存在 β- 内酰胺酶耐药机制外,尚 存在与 BLNAR 类似的 PBPs 基因突变。本研究中 BLPACR 菌株从上一年度的 13% 增长至 19%。由 于 BLPACR 菌株对阿莫西林克拉维酸以及其他常 用口服抗菌药物有更高的耐药率,BLPACR 菌株的 增长将导致更加严峻的临床问题。各本地区临床 抗生素监管或抗生素的调整使用,菌株耐药基因 突变等都是影响 BLNAR 和 BLPACR 变化趋势的关 键因素,两者均呈现增长趋势使相应抗菌素敏感 率降低值得持续监测和进一步探讨。
综上,Hi 在 0~17 岁儿童呼吸道感染性疾病 中扮演着重要角色,BLNAR 和 BLPACR 呈现增长 趋势将使临床面临更加严峻的抗生素选择压力。
| [1] | Van EJ, Slack MPE, Ladhani S, et al. Non-typeable Haemophilus influenzae, an under-recognised pathogen[J]. Lancet Infect Dis, 2014, 14(12):1281-1292. |
| [2] | Peltola H. Worldwide Haemophilus influenzae type b disease at the beginning of the 21st century:global analysis of the disease burden 25 years after the use of the polysaccharide vaccine and a decade after the advent of conjugates[J]. Clin Microbiol Rev 2000, 13(2):302-317. |
| [3] | Gessner BD, Adegbola RA. The impact of vaccines on pneumonia:key lessons from Haemophilus influenzae type b conjugate vaccines[J]. Vaccine, 2008, 26(suppl 2):B3-B8. |
| [4] | NTHi-Watch. NTHi-Watch[DB/OL]. http://nthi-watch.griffith.edu.au/ (accessed Jan 10, 2013). |
| [5] | 黄成, 王晓蕾, 张砺, 等. 2001-2006 年成都市儿童医院常见 下呼吸道病原菌分布及耐药性检测[J]. 中国当代儿科杂志, 2008, 10(1):17-20. |
| [6] | 田国忠, 李学春, 张砺, 等. 流感嗜血杆菌表型和脉冲场 凝胶电泳分型研究[J]. 中华微生物学和免疫学杂志, 2009, 29(1):79-83. |
| [7] | 田国忠, 邵祝军, 张砺, 等. 多重聚合酶链反应检测流感嗜 血杆菌[J]. 中华流行病学杂志, 2008, 29(8):806-809. |
| [8] | Tian GZ, Zhang L, Li MC, et al. Genotypic Characteristics of Haemophilus influenzae Isolates from Pediatric Pneumonia Patients in Chengdu City, Sichuan, China[J]. J Microbiol, 2009, 47(4):494-497. |
| [9] | 董声焕, 张亚梅, 刘玉秀, 等. 呼吸系统疾病[M]// 胡亚美, 江载芳. 诸福棠实用儿科学( 上册). 第7 版. 北京:人民卫 生出版社, 2010:1139-1265. |
| [10] | 中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委 员会. 儿童社区获得性肺炎管理指南(2013 修订)(下)[J]. 中华儿科杂志, 2013, 5(11):856-862. |
| [11] | Murdoch DR, O'Brien KL, Driscoll AJ, et al. Laboratory methods for determing pneumonia etiology in children[J]. Clin Infect Dis, 2012, 54(Suppl 2):S146-S152. |
| [12] | Clinical and Laboratory Standards Institute (CLSI):Performance standards for antimicrobial susceptibility testing[S]. 2012, M100-S22. |
| [13] | MacNeil JR, Cohn AC, Farley M, et al. Current epidemiology and trends in invasive Haemophilus influenzae disease-United States, 1989-2008[J]. Clin Infect Dis, 2011, 53(12):1230-1236. |
| [14] | Ladhani S, Slack MPE, Heath PT, et al. Invasive Haemophilus influenzae disease, Europe, 1996-2006[J]. Emerg Infect Dis 2010, 16(3):455-463. |
| [15] | Courcol RJ, Damien JM, Ramon P, et al. Presence of alveolar macrophages as a criterion for determining the suitability of sputum specimens for bacterial culture[J]. Eur J Clin Microbiol, 1984, 3(2):122-125. |
| [16] | Klein DW, Beasley PA, Ilstrup DM, et al. Can microscopic screening be used to determine the suitability of sputum for culture of Haemophilus species?[J]. Am J Clin Pathol, 1986, 86(6):771-773. |
| [17] | Chiang WC, Teoh OH, Chong CY, et al. Epidemiology, clinical characteristics and antimicrobial resistance patterns of community-acquired pneumonia in 1702 hospitalized children in Singapore[J]. Respirology, 2007, 12(2):254-261. |
| [18] | De Schutter I, De Wachter E, Crokaert F, et al. Microbiology of bronchoalveolar lavage fluid in children with acute nonresponding or recurrent community-acquired pneumonia:identification of nontypeable Haemophilus influenzae as a major pathogen[J]. Clin Infect Dis, 2011, 52(12):1437-1444. |
| [19] | Ingarfield SL, Celenza A, Jacobs IG, et al. The bacteriology of pneumonia diagnosed in Western Australian emergency departments[J]. Epidemiol Infect, 2007, 135(8):1376-1383. |
| [20] | Falla TJ, Dobson SR, Crook DW, et al. Population-based study of non-typable Haemophilus infl uenzae invasive disease in children and neonates[J]. Lancet, 1993, 341(8849):851-854. |
| [21] | Heath PT, Booy R, Azzopardi HJ, et al. Non-type b Haemophilus influenzae disease:clinical and epidemiologic characteristics in the Haemophilus influenzae type b vaccine era[J]. Pediatr Infect Dis J, 2001, 20(3):300-305. |
| [22] | Gkentzi D, Slack M, Ladhani S. The burden of nonencapsulated Haemophilus influenzae in children and potential for prevention[J]. Curr Opin Infect Dis, 2012, 25(3):266-272. |
| [23] | Clancy RL, Dunkley M. Acute exacerbations in COPD and their control with oral immunization with non-typeable Haemophilus influenzae[J/OL]. Front Immunol, 2011, 2:7. |
| [24] | Marchant JM, Masters IB, Taylor SM, et al. Utility of signs and symptoms of chronic cough in predicting specific cause in children[J]. Thorax, 2006, 61(8):694-698. |
| [25] | Marchant JM, Masters IB, Taylor SM, et al. Evaluation and outcome of young children with chronic cough[J]. Chest, 2006, 129(5):1132-1141. |
| [26] | Donnelly D, Critchlow A, Everard ML. Outcomes in children treated for persistent bacterial bronchitis[J]. Thorax, 2007, 62(1):80-84. |
| [27] | Block SL, Hedrick J, Tyler R, et al. Increasing bacterial resistance in pediatric acute conjunctivitis (1997-1998)[J]. Antimicrob Agents Chemother, 2000, 44(6):1650-1654. |
| [28] | Bingen E, Cohen R, Jourenkova N, et al. Epidemiologic study of conjunctivitis-otitis syndrome[J]. Pediatr Infect Dis J, 2005, 24(8):731-732. |
| [29] | 程薇, 钱利强, 华春珍, 等. 儿童呼吸道标本分离的流感嗜 血杆菌耐药模式研究[J]. 检验医学, 2010, 25(3):192-195. |
| [30] | 徐和平, 马晓波, 郑燕青, 等. 厦门地区呼吸道感染患儿嗜 血杆菌的临床分布及耐药性分析[J]. 检验医学与临床, 2011, 8(16):1927-1930. |
| [31] | Ito M, Hotomi M, Maruyama Y, et al. Clonal spread of betalactamase-producing amoxicillin-clavulanate-resistant (BLPACR) strains of non-typeable Haemophilus influenzae among young children attending a day care in Japan[J]. Int J Pediatr Otorhinolaryngol, 2010, 74(8):901-906. |
| [32] | Ubukata K, Shibasaki Y, Yamamoto K, et al. Association of aminoacid substitutions in penicillin-binding protein 3 with beta-lactam resistance in beta-lactamase-negative ampicillinresistant Haemophilus influenzae[J]. Antimicrob Agents Chemother, 2001, 45(6):1693-1699. |
 2015, Vol. 17
2015, Vol. 17