支气管哮喘(简称哮喘)是一种以慢性气道 炎症为特征的异质性疾病,具有喘息、气促、胸 闷和咳嗽的呼吸道症状病史,伴有可变的呼气气 流受限,呼吸道症状和强度可随时间而变化。近 年来儿童的发病率逐年增高,严重威胁着儿童的 身体健康,我国哮喘病死率位居全球第一,造成 了巨大的社会负担。因此,哮喘的发病机制及其 治疗的研究已成为世界各国学者的研究热点。哮 喘的发病机制极其复杂,尚有许多机制仍不是很 清楚。近来越来越多的研究发现,瘦素在肥胖、 II 型糖尿病、冠心病和癌症等许多领域已经被研 究和重视,在呼吸系统疾病包括哮喘的发病中的 作用也越来越受到重视 [1]。国外研究证明在小鼠和 人的肺泡及支气管上皮细胞表面,肺组织内被激 活的淋巴细胞和肥大细胞表面均有瘦素受体的表 达 [2, 3, 4, 5]。但在不同严重程度哮喘肺组织中瘦素及其 受体的表达情况变化研究甚少,因此本研究采用 Western blot、免疫组化方法和实时荧光定量 PCR (Real-time PCR)法,定量分析不同严重程度的哮 喘小鼠肺组织中瘦素及其受体的蛋白和 mRNA 的 表达,为研究瘦素与哮喘的发病机制的关系奠定 基础,从分子和基因水平探讨哮喘的发病机制开 辟一个新的途径。糖皮质激素作为哮喘的一线用 药,具有强的抗炎作用。但其对哮喘小鼠肺组织 中的瘦素及其受体是否也有一定的影响还存在争 议,因此本研究用布地奈德吸入治疗干预哮喘小 鼠,进一步探讨布地奈德对瘦素及其受体的影响。 1 材料与方法 1.1 材料
卵白蛋白(Ovalbumin,OVA)、氢氧化铝干 粉(Sigma,美国),兔抗小鼠瘦素及兔抗小鼠瘦 素受体 /OB-Rb 多克隆抗体(北京博奥森生物技 术有限公司),SP 免疫组化染色试剂盒及浓缩型 DAB 试剂盒(北京中杉金桥生物技术有限公司), TRIzol RNA 抽提液、反转录试剂盒、扩增试剂盒、 瘦素及其受体 OB-Rb 基因引物(宝生物工程有限 公司),RIPA 裂解液、SDS-PAGE 凝胶配制试剂 盒(上海碧云天生物技术公司)。 1.2 动物分组及哮喘模型制作
40 只 4~6 周 龄 的 BALB/c 雄 性 小 鼠,体 重18~20 g,购买并饲养于中国医科大学附属盛京医 院实验动物中心 SPF 动物房。按随机数字表法分 为对照组、诱喘 3 d 组、诱喘 7 d 组和布地奈德干 预组,每组 10 只。参考国内外文献制备模型的优 化方案 [6, 7],并加以改良,以 OVA 致敏和激发的方 法建立哮喘模型:实验组在实验的第 0、7、14 天 给予 10 μg OVA+1 mg AI(OH)3+0.4 mL 生理盐水混 悬液腹腔注射致敏;第 21~23 天给予 1%OVA 雾 化激发建立诱喘 3 d 哮喘模型组,第 21~27 天给予 1%OVA 雾化激发建立诱喘 7 d 哮喘模型组,每日 1 次,每次 30 min。布地奈德干预组在诱喘 7 d 小 鼠每次激发前 1 h 雾化吸入布地奈德混悬液 2 mL 进行干预;对照组不给予任何处理;末次激发后 24 h 内取材。 1.3 标本收集
5% 水合氯醛腹腔注射麻醉小鼠,固定,心尖 取血致死,开胸取新鲜双肺组织,将左肺以 10 倍 体积的 4% 多聚甲醛溶液固定,常规方法石蜡包 埋、切片,行苏木精 - 伊红(HE)染色及免疫组 织化学检测,右肺 -80℃保存用于 Western blot 法 及 Real-time PCR 法分析。 1.4 肺组织 HE 染色
常规二甲苯脱蜡及酒精复水,然后苏木素染 色、冲洗、伊红染色,最后梯度酒精脱水、二甲 苯透明及中性树胶封片。 1.5 免疫组化法检测肺组织中瘦素及瘦素受体蛋白表达
免疫组化步骤按说明书进行。每个样本随机 选取 10 张切片,切片常规脱蜡水化,3% H2O2 行 抗原修复 30 min,山羊血清封闭 30 min,加入以 1 : 320 稀释的兔抗小鼠瘦素及瘦素受体一抗,以 PBS 代替一抗作为阴性对照,4℃湿盒孵育过夜, 加生物素标记的抗兔 IgG 二抗孵育后,用 DAB 显 色液显色,苏木精复染,中性树脂固定封片,每 张切片随机选取 5 个视野进行图像采集,并利用 美国 universal imaging porporation 图像分析系统, meta morph 软件测定其光密度值(OD 值)进行比 较。 1.6 Western blot 测定肺组织中瘦素及瘦素受体的表达
参 照 说 明 书 提 取 小 鼠 肺 组 织 蛋 白,聚 丙 烯 酰 胺 凝 胶 电 泳(SDS-PAGE) 采 用 8% 与10% 的分离胶和浓缩胶,电泳条件:浓缩胶内 100 V×40 min,分 离 胶 内 120 V×120 min。 然 后 180 mA×70 min 电 转 移。 最 后 免 疫 学 检 测 时 一 抗 的 工 作 浓 度 为 1 : 500,二 抗 的 工 作 浓 度 为 1 : 5 000,增强化学荧光剂(ECL)用于化学曝光。 Western blot 图像应用 Image J 软件分析,以目的蛋 白与内参 GAPDH 灰度值的比值进行半定量分析。 1.7 Real-time PCR 法检测肺组织中的瘦素及瘦素受体 mRNA 的表达
参照 TRIzol 说明书对各组小鼠进行肺组织 总 RNA 提取,测 RNA 浓度后调整 RNA 体积,取 1 μg RNA 用逆转录试剂盒合成 cDNA。瘦素上游引 物:5'-CCCTTCCAGCCAGGTCATA-3',下游引物: 5'-TCCTCCAAAATCTACCTCCAACTC-3',片 段 长 度 87 bp;瘦素受体上游引物:5'-CCAGATTCGATATGGCTTAAGTGGA-3',下游引物:5'-CAGCGAACCTGGACCACATAGA-3',片段长度 129 bp; β-actin 上游引物:5'-CATCCGTAAAGACCTCTATGCCAAC- 3',下游引物:5'-ATGGAGCCACCGATCCACA-3', 片段长度 159 bp。反应体系(20 μL):上下游 引 物 各 1 μL,cDNA 模 板 1 μL,2×Eas Taq PCR SuperMix 10 μL,其 余 以 ddH2O 补 充。 扩 增 条 件:95 ℃ 预 变 性 5 min;95 ℃ 变 性 30 s,55 ℃ 退 火 45 s,72 ℃ 延 伸 45 s,35 个 循 环;72 ℃ 延 伸 10 min 终止反应。根据标准曲线,荧光定量 PCR 仪(ABI7500 型号)自动分析并计算出每个样本的 CT 值,瘦素及瘦素受体 mRNA 的相对表达量应用 2-ΔΔCT 方法得出相对倍数。 1.8 统计学分析
采用 SPSS 19.0 统计软件对数据进行统计学分 析,计量资料以均数 ± 标准差(x±s)表示,多 组间比较采用单因素方差分析,组间两两比较采 用 SNK-q 检验。 P<0.05 为差异有统计学意义。 2 结果 2.1 一般表现
哮喘组雾化激发后出现烦躁不安、呼吸急促、 抓耳挠鼻、腹肌抽搐和大小便失禁等表现,多次 激发后出现毛色失去光泽、体重增长缓慢;布地 奈德干预组上述症状较轻;对照组无上述症状。 2.2 各组小鼠肺组织病理改变
HE 染色可见诱喘 3 d 组小鼠支气管壁周围有 大量炎性细胞浸润,肺泡腔增大、破裂、融合, 诱喘 7 d 组小鼠肺组织炎症反应更加明显,支气管 壁周围及支气管内都有大量炎性细胞的渗出,布 地奈德干预组小鼠炎症细胞浸润均轻于两哮喘组。 对照组肺组织几乎无上述病理改变。见图 1。
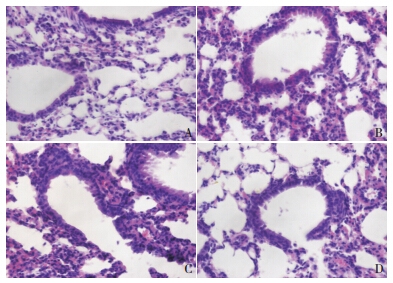 |
图 1 各组小鼠左肺组织病理形态学变化化(苏木精 - 伊 红染色,×400) A 为对照组;B 为诱喘 3 d 组;C 为诱喘 7 d 组; D 为布地奈德干预组。诱喘 3 d 组小鼠支气管壁周围有大量炎性细 胞浸润,肺泡腔增大、破裂以及融合;诱喘 7 d 组小鼠肺组织炎症 反应更加明显;而布地奈德干预组小鼠支气管壁周围炎症细胞浸 润均轻于两哮喘组;对照组肺组织几乎无上述病理改变。 |
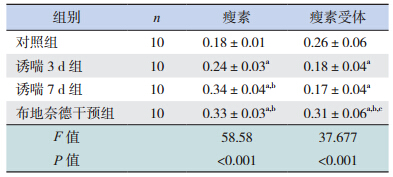
肺组织中瘦素蛋白在哮喘组表达均较对照组 显著增高(均 P<0.01);诱喘 7 d 组肺组织中瘦素 蛋白表达较诱喘 3 d 组显著增高(P<0.01);布地 奈德干预组肺组织中瘦素蛋白表达与诱喘 7 d 组比 较差异无统计学意义(P=0.297)。见表 1、图 2。
| 表 1 各组小鼠肺组织中瘦素及瘦素受体光密度值比较 (x±s) |
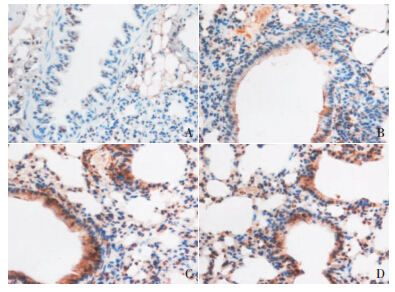 |
图 2 瘦素蛋白在各组小鼠肺组织中的表达(DAB 染色, ×400) A 为对照组;B 为诱喘 3 d 组;C 为诱喘 7 d 组;D 为 布地奈德干预组。棕褐色为瘦素阳性表达,其中对照组瘦素蛋白 表达最少;诱喘 3 d 组瘦素蛋白表达较少;诱喘 7 d 组和布地奈德 干预组瘦素蛋白表达较多。 |
肺组织中瘦素受体蛋白在哮喘组表达较对照 组均显著降低(均 P<0.01);诱喘 7 d 组肺组织 中瘦素受体蛋白表达与诱喘 3 d 组比较差异无统 计学意义(P=0.111);布地奈德干预组肺组织中 瘦素受体蛋白表达较对照组和哮喘组均显著增高 (P<0.01)。见表 1、图 3。
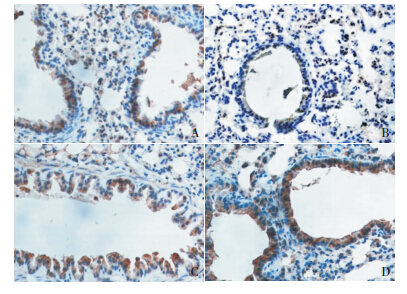 |
图 3 瘦素受体在各组小鼠肺组织中的表达(DAB 染色, ×400) A 为对照组;B 为诱喘 3 d 组;C 为诱喘 7 d 组;D 为 布地奈德干预组。棕褐色为瘦素受体阳性表达,其中对照组瘦素 受体蛋白表达较多;诱喘 3 d 组和诱喘 7 d 组瘦素受体蛋白表达较 少;而布地奈德干预组瘦素受体蛋白表达最多。 |
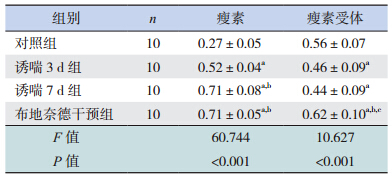
Western blot 结果表明诱喘 3 d 组瘦素表达较对照组明显增高(P<0.01);诱喘 7 d 组瘦素表 达较 3 d 组明显增高(P<0.01);布地奈德干预 组瘦素水平与诱喘 7 d 组相比差异无统计学意义 (P=0.108)。诱喘 3 d 组瘦素受体较对照组表达 明显降低(P<0.01);诱喘 7 d 组瘦素受体水平与 3 d 组比较差异无统计学意义(P=0.139);布地奈 德干预组瘦素受体表达较对照组和哮喘组均明显 增高(P=0.002)。见表 2、图 4。
| 表 2 各组小鼠肺组织中瘦素及瘦素受体蛋白水平比较 (x±s) |
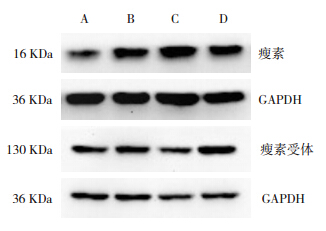 |
图 4 Western blot 检测肺组织中瘦素和瘦素受体蛋 白表达 A:对照组;B:诱喘 3 d 组;C:诱喘 7 d 组;D:布 地奈德干预组。 |
诱 喘 3 d 组 瘦 素 mRNA 水 平 较 对 照 组 明 显 增 高(P<0.01); 诱 喘 7 d 组 瘦 素 mRNA 水 平 较 3 d 组明显增高(P<0.01);布地奈德干预组瘦素 mRNA 水平与诱喘 7 d 组比较差异无统计学意义 (P=0.347)。瘦素受体 mRNA 水平在对照组、诱 喘 3 d 组、诱喘 7 d 组和布地奈德干预组中比较, 差异无统计学意义(P=0.963)。见表 3。
| 表 3 各组小鼠肺组织中瘦素及瘦素受体 mRNA 的相对 扩增倍数(x±s) |
瘦素主要是由白色脂肪合成和分泌的一种多 肽类激素,其受体在肺组织中广泛表达,具有免 疫调节和促炎作用 [8, 9]。近年来有研究显示,哮喘 病人血清瘦素水平较健康人明显升高 [10],随着患 者哮喘病情加重,血浆瘦素水平亦明显升高,瘦 素水平与哮喘严重程度呈正相关 [11, 12]。因而,瘦 素在哮喘发病中的作用逐渐受到重视。瘦素在哮 喘发病中的可能机制:(1)增加气道高反应性: Shore 等 [13] 用 OVA 致敏的 Balb/c 小鼠哮喘模型研 究发现,皮下注射瘦素可提高血清瘦素和 IgE 水 平,并加重气道高反应性,而皮下注射生理盐水 组气道反应无明显变化,提示瘦素可增加气道高 反应性;(2)加重气道炎症反应:Mancuso 等 [14] 发现给肺炎球菌肺炎的小鼠模型腹腔注射瘦素后, 其支气管肺泡灌洗液中中性粒细胞数、巨噬细胞 炎症蛋白、IL-6 和中性粒细胞趋化因子增高、肺 泡巨噬细胞杀菌能力增强,以及白三烯合成增加; Johnston 等 [15] 也发现,给予外源性瘦素可使暴露 于臭氧中的小鼠肺泡灌洗液中的脱落上皮细胞增 加,而上皮细胞脱落是支气管哮喘气道炎症的主 要机制之一;(3)调节 Th1/TH2 细胞反应:研究 证实,瘦素可协调促进 T 淋巴细胞增殖,并增加 CD4+T 细胞对丝裂原的增殖反应,从而改变 T 淋 巴细胞因子的产生,增加 Th1 细胞因子的表达, 减少 TH2 细胞因子的产生 [16, 17]。
本研究从分子和基因水平检测不同严重程度 哮喘小鼠肺组织中的瘦素及瘦素受体表达的变化, 结果显示在哮喘小鼠肺组织中,瘦素呈高水平表 达,瘦素受体呈低水平表达,这可能是由于升高的瘦素转运或者信号传导出现缺陷而产生了瘦素 抵抗现象。瘦素及其受体在气道上皮细胞中的表 达明显高于肺组织其他部位,这说明瘦素及其受 体可能主要通过对气道上皮细胞的改变参与哮喘 的发病。Beuther 等 [18] 在人的体外支气管上皮细胞 研究中发现瘦素可以降低转化生长因子 -β 的自发 性释放从而促进气道上皮细胞的增殖,在重度哮 喘患者的支气管上皮表面瘦素受体的表达相对降 低,而经过氟替卡松治疗后其表达明显升高,这 与本研究的结果一致。
糖皮质激素是控制哮喘气道炎症的首选药物, 因此本研究选用布地奈德雾化吸入干预哮喘小鼠, 经布地奈德雾化干预后哮喘小鼠肺组织中瘦素的 表达稍有减少,减少的并不明显,而瘦素受体表 达却明显升高,说明布地奈德在缓解哮喘的同时, 也改善了瘦素抵抗,瘦素又可以与足够的受体结 合而发挥生物学效应,这可能是哮喘难以控制的 原因之一。瘦素是肥胖者脂肪组织表达的促炎分 子,它能够独立于肥胖而促进哮喘的气道炎症, 并以中性粒细胞和 Th1 型炎症反应增强为特点 [19]。 此外,瘦素还可以直接作用于人的气道平滑肌细 胞,诱导其分泌血管内皮细胞生长因子以参与哮 喘气道重塑的发生 [20]。有研究发现,瘦素可通过 诱导气道平滑肌细胞表达 GR-β 以参与哮喘的激素 抵抗的发生。本研究结果显示通过布地奈德干预 后的哮喘小鼠肺组织瘦素受体明显升高,瘦素可 以与更多的瘦素受体结合而发挥生物学效应,瘦 素可诱导气道平滑肌表达 GR-β,进一步增加激素 抵抗,使哮喘更加难以控制。因此,进一步研究 瘦素及其受体与哮喘的发病机制的关系,可以为 临床的治疗难治性哮喘提供新的思路。
本研究表明在哮喘小鼠肺组织中,瘦素呈高 水平表达,瘦素受体呈低水平表达,布地奈德可 以上调瘦素受体的表达,而对瘦素表达无明显影 响。
| [1] | Vernooy JH, Ubags ND, Brusselle GG, et al. Leptin as regulator of pulmonary immune responses:Involvement in respiratory diseases[J]. Pulm pharmacol Ther, 2013, 26(4):464-472. |
| [2] | McGraw DW, Forbes SL, Kramer LA, et al. Transgenic overexpression of β2-adrenergic receptors in airway smooth muscle alters myocyte function and ablates bronchial hyperreactivity[J]. J Biol Chem, 1999, 274(45):32241-32247. |
| [3] | Nair P, Radford K, Fanat A, et al. The effects of leptin on airway smooth muscle responses [J]. Am J Respir Cell Mol Biol, 2008, 39(4):475-481. |
| [4] | Bruno A, Pace E, Chanez P, et al. Leptin and leptin receptor expression in asthma[J]. J Allergy Clin Immunol, 2009, 124(2):230-237. |
| [5] | Shin JH, Kim JH, Lee WY, et al. The expression of adiponectin receptors and the effects of adiponectin and leptin on airway smooth muscle cells [J]. Yonsei Med J, 2008, 49(5):804-810. |
| [6] | 孙妍, 王金荣, 韩秀珍, 等. 布地奈德对慢性支气管哮喘小 鼠肺组织HIF-1α 和VEGF 表达及气道重塑的影响[J]. 中国 当代儿科杂志, 2012, 14(8):622-627. |
| [7] | Jang HY, Kwon OK, Oh SR, et al. Mangosteen xanthones mitigate ovalbumin-induced airway inflammation in a mouse model of asthma[J]. Food Chem Toxicol, 2012, 50(11):4042-4050. |
| [8] | Adamczak M, Wiecek A. The adipose tissue as an endocrine organ[J]. Semin Nephrol, 2013, 33(1):2-13. |
| [9] | Suganami T, Tanaka M, Oqawa Y. Adipose tissue in nammation and ectopic lipid accumulation[J]. Endocr J, 2012, 59(10):849-857. |
| [10] | 杨敏, 陈艳萍. 支气管哮喘患儿血清瘦素水平与临床严重程 度的关系[J]. 临床急诊杂志, 2014, 15(1):27-29. |
| [11] | Yuksel H, Sogut A, Yilmaz O, et al. Role of adipokones and hormones of obesity in childhood asthma[J]. Allergy Asthma Immunol Res, 2012, 4(2):98-103. |
| [12] | Tsaroucha A, Daniil Z, Malli F, et al. Leptin, adiponectin, and ghrelin levels in female patients with asthma during stable and exacerbation periods[J]. J Asthma, 2012, 50(2):188-197. |
| [13] | Shore SA, Schwartzman IN, Mellema MS, et al. Effect of leptin on allergic airway responses in mice[J]. J Allergy Clin Immunol, 2005, 115(1):103-109. |
| [14] | Mancuso P, Huffnagle GB, Olszewski MA, et al. Leptin corrects host defense defects after acute starvation in murine pneumococcal pneumonia[J]. Am J Respri Crit Care Med, 2006, 173(2):212-218. |
| [15] | Johnston RA, Theman TA, Terry RD, et al. Pulmonary responses to acute ozone exposure in fasted mice:efect of leptin administration [J]. J Appl Physiol, 2007, 102(1):149-156. |
| [16] | 富东旭, 李大林, 李殿俊, 等. 瘦素对人类外周血T 淋巴细 胞增殖作用的影响[J]. 中国免疫学杂志, 2006, 7(22):604-611. |
| [17] | Lord GM, Matarese G, Howard JK, et al. Leptin modulates the T-cel immune respo nse an d reverses starvation induced immunosup pression[J]. Nature, 1998, 394(6696):897-901. |
| [18] | Beuther DA, Weiss ST, Sutherland ER, et al. Obesity and asthma[J]. Am J Respir Crit Care Med, 2006, 174(2):112-119. |
| [19] | Jarjour NN, Erzurum SC, Bleecker ER, et al. Severe asthma:lessons learned from the national heart, lung, and blood institute severe asthma research program[J]. Am Respir Crit Care Med, 2012, 185(4):356-362. |
| [20] | Shin JH, Kim JH, Lee WY, et al. The expression of adiponectin receptors and the effects of adiponectin and leptin on airway smooth muscle cells[J]. Yonsei Med J, 2008, 49(5):804-810. |
 2015, Vol. 17
2015, Vol. 17