2. 南京医科大学附属无锡市人民医院 检验科, 江苏 无锡 214000;
3. 南京医科大学第一附属医院儿科, 江苏 南京 210000)
支气管哮喘(简称哮喘)是一种异质性的多 因素疾病,现在认为哮喘与过敏性和非过敏性刺 激时 Th2 型细胞免疫应答水平高于 Th1 型细胞免 疫应答水平有关,从而导致慢性气道炎症 [1]。近 年来发现表观遗传学机制也可能起重要作用 [2], 但目前国内哮喘领域在表观遗传学方面的研究较 少。目前哮喘表观遗传学研究主要集中在两种调 控方式 [3, 4],即 DNA 甲基化和组蛋白修饰,其中 最主要的修饰是组蛋白的乙酰化修饰。组蛋白的 乙酰化与炎症基因诱导和细胞增殖有关。组蛋白 乙酰化和组蛋白去乙酰化分别由组蛋白乙酰基转 移酶(histone acetyltransferase,HAT)和组蛋白去 乙酰基酶(histone deacetylase,HDAC)所催化。内 源性的 HDAC 活性对维持 Th1 型免疫应答和 T 型 免疫应答平衡及抑制过度 Th2 型免疫应答起至关 重要的作用 [5]。但 HAT 与 HDAC 活性及组蛋白乙 酰化修饰与儿童哮喘及婴幼儿喘息的表现型的关 系目前不清楚。有研究显示 HDAC 的表达水平可 能与儿童哮喘的严重程度有关 [6],曲古抑菌素 A (trichostatin,TSA)作为 HDAC 抑制剂,是否对哮 喘有治疗作用,与常用的哮喘治疗药物糖皮质激 素作用有何差别有待研究。为此,本实验通过构 建哮喘小鼠模型,并分别予 HDAC 抑制剂 TSA 及 地塞米松(dexamethasone,Dex)进行干预,观察 哮喘中各种细胞因子及 HAT、HDAC 活性的变化 规律,比较 TSA 及 Dex 对其的治疗作用的差异, 探讨组蛋白乙酰化修饰在哮喘发病机制中的作用。 1 材料与方法 1.1 实验材料
SPF 级 6~8 周龄雄性 BALB/c 小鼠 32 只,购 自苏州大学比较医学中心,平均体重为 20±2 g, 无 卵 蛋 白 饮 食。 氢 氧 化 铝 凝 胶 及 卵 清 蛋 白 (ovalbumin,OVA)购于 Solarbio 公司(中国), TSA 购于 Beyotime 公司(中国),酶联免疫试剂 盒购于 Rabiotech 公司(美国),酶联免疫荧光法 试剂盒购于 Epigentek 公司(加拿大)。 1.2 动物分组及哮喘模型制备
小鼠按随机数字表法分为对照组、哮喘组、 激素治疗组和 TSA 治疗组,每组 8 只。哮喘小鼠 模型制作方法参照文献 [5]:在实验前及实验第 7、14 天,腹腔注射 10%OVA 溶液 0.1 mL+10% 氢氧 化 铝 凝 胶 0.2 mL 致 敏,每 日 1 次; 实 验 第 21、 23、25、27、29 天,0.2%OVA 溶液 50 μL 雾化激发, 每日 1 次,每次 30 min。对照组小鼠在致敏及激 发阶段各时间点分别以等量生理盐水替代注射和 雾化吸入。激素治疗组每次激发前 30 min 腹腔注 射 Dex 0.2 mL(1.0 mg/kg)。TSA 治疗组每次激发 前 30 min 腹腔注射 TSA 0.2 mL(1.0 mg/kg)。 1.3 标本采集及处理
于末次激发 24 h 后,各组小鼠行腹腔注射水 合氯醛(10 mg/kg)麻醉。眼球取血法取血 2 mL, 1 mL 置于含有乙二胺四乙酸(EDTA)抗凝剂的 1.5 mL 离心管中,待测血常规;另 1 mL 置于肝素 锂抗凝管中,离心 5 min,取血清用于检测细胞因子, 沉淀物用于分离单个核细胞。 1.4 Ficoll-Hypaque 密度分离法分离单个核细胞
取肝素锂抗凝的外周血 1 mL 与等量生理盐水 充分混合,沿管壁缓慢叠加于淋巴细胞分离液液 面上,注意保持清楚的界面。2800 rpm 水平离心 15 min。离心后管内分为 3 层,上层为血浆和生理 盐水,下层主要为红细胞和粒细胞,中间层为淋 巴细胞分离液,在上、中层界面处有一以单个核 细胞为主的白色云雾层狭窄带,单个核细胞包括 淋巴细胞和单核细胞。用毛细吸管插入到云雾层, 吸取单个核细胞,置于 1.5 mL 离心管中,加入 5 倍以上生理盐水,10 000 rpm 离心 1 min,洗涤细 胞 2 次。 1.5 血常规检测及 ELISA 法检测外周血细胞因子
EDTA 抗凝管上机检测血常规。IL-4、IL-8、 IFN-γ 试剂盒购自 Rabiotech 公司,所有步骤严格 按照试剂盒说明书执行。 1.6 酶联免疫荧光法检测外周血单个核细胞中HAT 和 HDAC 活性
HAT 和 HDAC 活性荧光分析试剂盒均购自 Epigentek 公司。所有步骤严格按照试剂盒说明书 执行。 1.7 统计学分析
应用 SPSS 19.0 统计学软件对数据进行统计学 分析,正态分布计量资料采用均数 ± 标准差(x±s) 表示,多组间比较采用方差分析,组间两两比较 采用 SNK-q 检验。P<0.05 为差异有统计学意义。 2 结果 2.1 哮喘症状
对照组小鼠在激发期间表现较为烦躁,无其 他阳性表现。哮喘组小鼠在激发期间出现焦躁不 安、呼吸急促、打喷嚏等阳性反应,但并不明显。 激素治疗组及 TSA 治疗组小鼠在激发期间亦表现 为焦虑、烦躁,但症状较哮喘组有所缓解。 2.2 各组血清细胞因子水平
哮喘组小鼠血清中 IL-4 和 IL-8 水平较对照组、 激素治疗组和 TSA 治疗组均升高(P<0.05),而 IL-4 和 IL-8 水平在对照组、激素治疗组和 TSA 治 疗组 3 组间比较差异均无统计学意义(P>0.05); 4 组间 IFN-γ 水平比较差异无统计学意义(P>0.05)。 见表 1。
| 表 1 各组小鼠血清细胞因子浓度比较 (x±s, pg/mL) |
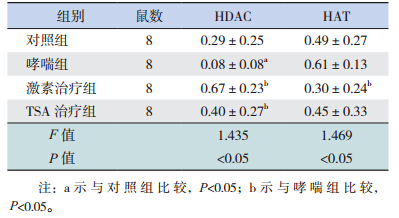
哮喘组小鼠 HDAC 活性较对照组、激素治疗 组和 TSA 治疗组均降低,HAT 活性较激素治疗组 明显升高(P<0.05);而 HDAC 和 HAT 活性在对 照组、激素治疗组和 TSA 治疗组 3 组间比较差异 均无统计学意义(P>0.05)。见表 2。
| 表 2 各组小鼠外周血单个核细胞中 HDAC 和 HAT 活性 比较 (x±s, RFU/(h·μg)) |
近几十年来,全球哮喘发病率持续升高,严 重影响患者的身心健康及生活质量,加重家庭和 社会的经济负担,已经成为全球关注的疾病。哮 喘亦是儿童常见的一种气道变应原性慢性炎症性 疾病,其发病机制与环境因素、遗传因素、气道 高反应性、炎性介质分泌增多、Th1/Th2 失衡等均 有密切关系。从病理上可分为过敏性哮喘和非过 敏性哮喘,但二者区别仍然不十分清楚。现在认 为哮喘与过敏性和非过敏性刺激时 Th2 型细胞免 疫应答水平高于 Th1 型细胞免疫应答水平有关, 从而导致慢性气道炎症。研究显示哮喘发病危险 因素中最重要的是遗传和环境因素,由于遗传背 景不可能在短时间内出现显著变化,因此,环境 因素可能起到关键作用。近年来,随着表观遗传 学的提出,人们已经认识到遗传和环境是密切相 关的两个因素,环境改变可以影响遗传。
随着研究的进一步深入,越来越多研究表明 表观遗传修饰在环境和遗传因素之间起到重要作 用,其中与哮喘发病机制密切相关的是组蛋白乙 酰化修饰 [1]。本研究建立了哮喘小鼠模型,通过对 小鼠症状的观察及相关因子的检测,验证 HDAC、 HAT 在哮喘发病中的作用,并研究 IL-4、IL-8 等 细胞因子与组蛋白乙酰化是否存在相关性,比较 Dex 与 TSA 疗效差异,进而以组蛋白乙酰化作为 切入点,研发新的哮喘治疗药物。
研究过程中发现,对照组小鼠在激发期间较 为烦躁,无其他阳性表现,可能由雾化过程中轻 度缺氧引起。哮喘组小鼠在激发期间出现焦躁不 安、呼吸急促、打喷嚏等哮喘症状,提示哮喘小 鼠模型构建成功。激素治疗组、TSA 治疗组小鼠 激发期间亦表现为焦虑、烦躁,但症状较哮喘组 有所缓解,提示 Dex 及 TSA 均有缓解哮喘症状的 作用。
本研究结果显示,与对照组组比较,哮喘组 血 清 中 IL-4 水 平 升 高,众 所 周 知,IL-4α 由 Th2 淋巴细胞分泌,说明哮喘模型小鼠体内存在 Th2 细胞优势反应及 Th1/Th2 型细胞因子比例失衡。 而 TSA 治疗组血液中 IL-4 水平低于哮喘组,且 哮喘症状减轻,提示去乙酰化酶抑制剂 TSA 对哮 喘有治疗作用,治疗机制则是通过抑制组蛋白乙酰化修饰,从而减少炎症因子分泌。然而经 Dex 治疗及 TSA 治疗后,IL-4 水平差异并不显著,说 明 Dex 及 TSA 降低炎性因子分泌的效果无明显差 异,可以推测 Dex 及 TSA 在治疗哮喘的机制方面 可能存在某些共同点。众所周知,糖皮质激素是 目前控制气道炎症最有效的药物,而其之所以能 够抑制炎症治疗哮喘主要是通过以下两种方式:
(1)抑制 HAT 活性、招募 HDAC2 而抑制炎症基 因的表达:糖皮质激素可以抑制 HAT 的活性,招 募 HDAC2,诱导组蛋白去乙酰化。在支气管哮喘 患者体内存在 HAT 活性的增高及 HDAC 活性的下 降,前炎症转录因子如 AP-1 和 NF-κB 介导 DNA 解螺旋,从而利于各种转录因子的结合诱导炎症 基因的表达。糖皮质激素一方面通过激活的激素 受体(GR)直接与 CRBE 连接蛋白或其他共刺激 因子结合来抑制 HAT 的活性,靶基因下调;一方 面则通过招募 HDAC2,诱导组蛋白去乙酰化,来 达到抑制哮喘炎症的作用 [7, 8, 9, 10, 11]。本研究结果显示 Dex 干预过的小鼠外周血中 IL-4 浓度较哮喘组明 显下降,而外周血单个核细胞中 HAT 活性亦下降, 证实了以上观点。(2)诱导组蛋白乙酰化来促进 抗炎因子表达:大剂量糖皮质激素可诱导乙酰化。 糖皮质激素与胞浆中 GR 的结合,GR 将与之结合 的糖皮质激素转移至细胞核内,结合至糖皮质激 素识别位点(GRE),并与 HAT 的共刺激因子连接, 诱导组蛋白乙酰化,从而增加抗炎因子的表达 [8, 9, 10, 11]。 本实验尚未对此机制进行探究,但可以证实糖皮 质激素及 TSA 均有诱导乙酰化作用。有研究发现, Dex 及 TSA 均能显著抑制哮喘小鼠辅助性 T 淋巴 细胞 2 型细胞因子 IL-4 的分泌,但都无升高 IFN-γ 的作用 [12],这与本实验结果是相符的。
另外,本研究中发现,哮喘组血清中的 IL-8 水平升高。IL-8 是哮喘发病相关细胞因子网络的 重要成员,具有趋化中性粒细胞、嗜酸性粒细胞、 T 淋巴细胞、单核细胞的作用,诱导中性粒细胞变 形、激活,使其定向游走,促进细胞内游离钙离 子浓度一过性升高,诱导其脱颗粒、释放蛋白水 解酶和氧自由基、花生四烯酸等一系列炎性介质, 诱导黏附分子的表达,引起呼吸爆发,从而促进 炎症反应 [13]。同时,IL-8 趋化并激活嗜酸性粒细 胞合成与释放阳离子蛋白,并能引起气道黏膜下 微血管通透性增加、腺体分泌亢进、平滑肌收缩及气道上皮细胞脱落,参与哮喘急性发作期和非 急性发作期的炎症反应,属调节哮喘气道炎症的 上调因子 [14]。本课题研究发现哮喘小鼠模型血清 中 IL-8 水平明显高于对照组,与有关哮喘患者的 报道结果相符 [15],因此可以看出 IL-8 参与哮喘的 炎症过程,故 IL-8 水平的监测可作为反映支气管 哮喘气道炎症和观察病情变化的重要指标。目前, 有实验证实经 Dex 干预后肺组织中 IL-8 和蛋白表 达水平明显低于哮喘组,而高于对照组 [16]。本研 究中,经 Dex 和 TSA 干预后亦见 IL-8 浓度较哮喘 组降低,且两组间差异无统计学意义,进一步证 实 Dex 与 TSA 在下调 IL-8 水平上没有明显差异。
本研究还发现,哮喘组 HDAC 活性较其余 3 组均降低,HAT 活性较激素治疗组明显升高,与 对照组、TSA 治疗组差异无统计学意义。有研究 证实,在哮喘患者的气道标本及肺泡灌洗液的巨 噬细胞中,HAT 活性明显升高,而 HDAC 活性则 降低,且哮喘患者体内 HAT 活性与升高的炎症基 因表达相关 [17]。本实验小鼠体内 HAT、HDAC 的 改变符合上述研究结果。在应用 TSA 后能显著缓 解小鼠哮喘症状,改善气道阻力及肺顺应性,减 轻小鼠肺部嗜酸性粒细胞浸润 [12],这一改变可能 与组蛋白乙酰化活化炎症基因有关。综合文献, 可知组蛋白乙酰化 / 去乙酰化修饰在哮喘发病中的 作用可能与诱导 Th1/Th2 失衡、调节炎症介质表 达等有关。(1)Th1/Th2 失衡:最近的研究显示 HDAC 在 Th1/Th2 型反应的产生与维持过程中起到 重要作用 [18]。在 T 细胞特异性 HDAC1 基因敲除 小鼠气道内发现炎症反应的增大,嗜酸粒细胞募 集,黏膜高反应性,肺实质炎症以及气道抵抗, Th2 分泌 IL-4 亦升高,倾向于 Th2 反应 [19]。应用 组蛋白去乙酰酶化抑制剂 TSA 可使 T 细胞高度乙 酰化,Th1/Th2 比值降低 [20],这与本实验小鼠研究 结果相符,充分证实 HDAC 有利于维持 Th1/Th2 平衡,反之乙酰化过程则将引起 Th1/Th2 失衡,从 而诱发哮喘发生。(2)炎症介质活化:炎性蛋白 TNF-α、IL-8 分泌增加,组蛋白乙酰化可能导致基 因转录,编码炎性蛋白,如 IL-8、TNF-α 等。但哮 喘发病还是否与组蛋白乙酰化 / 去乙酰化修饰增加 气道高反应性、氧化 / 硝化应激等有关,有待进一 步证实。
综上所述,本研究发现,哮喘模型小鼠体内IL-4 显著升高,出现以 Th2 细胞优势反应,存在 Th1/Th2 型细胞因子比例失衡。而 TSA 是通过抑 制组蛋白乙酰化修饰,减少炎症因子分泌。Dex 及 TSA 均能抑制哮喘小鼠 Th2 型细胞因子 IL-4 的分 泌,但都缺乏升高 IFN-γ 的作用。哮喘小鼠模型 血清中 IL-8 水平明显高于对照组,因此可以看出 IL-8 参与哮喘的炎症过程。经 Dex 和 TSA 干预后 外周血 IL-8 浓度水平明显低于哮喘组。本实验哮 喘小鼠体内 HAT 活性增高,HDAC 活性降低,应 用 TSA 后能显著缓解小鼠哮喘症状。Dex 与 TSA 治疗后 HDAC 活性均显著升高,但在降低 HAT 活性方面糖皮质激素更为显著。而这一结果并未 影响二者降低炎性因子分泌的作用。哮喘发病与 Th1/Th2 型细胞因子比例失衡、炎症介质活化等密 切相关,其还是否与组蛋白乙酰化 / 去乙酰化修饰 增加气道高反应性、氧化 / 硝化应激等有关,有待 进一步证实。
志谢:感谢无锡市人民医院检验科张健老师 在标本检测中给予的帮助。感谢无锡市人民医院 中心实验室穆会君老师、殷莹老师等在本实验中 给予的悉心指导。感谢郭赟、邢朝凤、潘姗姗在 实验过程中给予的帮助。
| [1] | Kuo CH, Hsieh CC, Lee MS, et al. Epigenetic regulation in allergic diseases and related studies[J]. Asia Pac Allergy, 2014, 4(1):14-18. |
| [2] | García MP, García-García A. Epigenome and DNA methylation in oral squamous cell carcinoma[J]. Methods Mol Biol, 2012, 863:207-219. |
| [3] | Kouzarides T. Chromatin modifications and their function[J]. Cell, 2007, 128(4):693-705. |
| [4] | Peterson S, Jackson V. Acetylation of H4 suppresses the repressive effects of the N-termini of histones H3/H4 and facilitates the formation of positively coiled DNA[J]. Biochemistry, 2008, 47(27):7053-7065. |
| [5] | Cui ZL, Gu W, Ding T, et al. Histone modifications of Notch1 promoter affect lung CD4+T cell differentiation in asthmatic rats[J]. Int J Immunopathol Pharmacol, 2013, 26(2):371-381. |
| [6] | Hew M, Bhavsar P, Torrego A, et al. Relative corticosteroid insensitivity of peripheral blood mononuclear cells in severe asthma[J]. Am J Respir Crit Care Med, 2006, 174(2):134-141. |
| [7] | Barnes PJ. How corticosteroids control inflammation:Quintiles Prize Lecture 2005[J]. Br J Pharmacol, 2006, 148(3):245-254. |
| [8] | Butler CA, McQuaid S, Taggart CC, et al. Glucocorticoid receptor β and histone deacetylase 1 and 2 expression in the airways of severe asthma[J]. Thorax, 2012, 67(5):392-398. |
| [9] | Barnes PJ, Ito K, Adcock IM. Corticosteroid resistance in chronic obstructive pulmonary disease:inactivation of histone deacetylase[J]. Lancet, 2004, 363(9410):731-733. |
| [10] | Barnes PJ, Adcock IM. Glucocorticoid resistance in inflammatory diseases[J]. Lancet, 2009, 373(9678):1905-1917. |
| [11] | Zhao XQ, Chen Y, Yuan YD. Evaluation on value of C-reactive protein, interleukin-8 in acute exacerbation of asthma[J]. Clin Focus, 2009, 24(14):1217-1220. |
| [12] | 李成业, 郭雪君, 甘丽杏, 等. 哮喘大鼠肺T 细胞中组蛋白 去乙酰基酶1 的表达及对组蛋白修饰的影响[J]. 中国呼吸与 危重监护杂志, 2010, 9(3):259-263. |
| [13] | Shi L, Wang L, Wang B, et al. Regulatory mechanisms of betacellulin in CXCL8 production from lung cancer cells[J]. J Transl Med, 2014, 12:70. |
| [14] | Mereado N, To Y, Kobayashi Y, et al. p38 mitogen-activated protein kinase-γ inhibition by long-acting β2 adrenergic agonists reversed steroid insensitivity in severe asthma[J]. Mol Pharmacol, 2011, 80(6):1128-1135. |
| [15] | Qiao J, Li A, Jin X, et al. Mastic alleviates allergic Inflammation in asthmatic model mice by inhibiting recruitment of eosinophils[J]. Am J Respire Cell Mol Biol, 2011, 45(1):95-100. |
| [16] | Barnes PJ. Role of HDAC2 in the Pathophysiology of COPD[J]. Annu Rev Physiol, 2009, 71:451-464. |
| [17] | Grausenburger R, Bilic I, Boucheron N, et al. Conditional deletion of histone deacetylase 1 in T cells leads to enhanced airway inflammation and increased Th2 cytokine production[J]. J Immunol, 2010, 185(6):3489-3497. |
| [18] | Li CY, Peng J, Ren LP, et al. Roles of histone hypoacetylation in LAT expression on T cells and Th2 polarization in allergic asthma[J]. J Transl Med, 2013, 30(11):26. |
| [19] | Zhao L, Chen CN, Hajji N, et al. Histone deacetylation inhibition in pulmonary hypertension:therapeutic potential of valproic acid and suberoylanilide hydroxamic acid[J]. Circulation, 2012, 126(4):455-467. |
| [20] | Batra S, Balamayooran G, Sahoo MK. Nuclear Factor-κB:a key regulator in health and disease of lungs[J]. J Arch Immunol Ther Exp, 2011(59):335-351. |
 2015, Vol. 17
2015, Vol. 17