Ph 阳 性 急 性 淋 巴 细 胞 白 血 病(Philadelphia chromosome-positive acute lymphoblastic leukemia, Ph+ ALL)的发生率虽然在儿童急性白血病中仅占 5% 左右,但却具有起病时年龄较大、白细胞高、 预后极差等独特的临床特征,若仅依靠化疗,治 愈率仅为 20%~30%[1, 2]。但随着络氨酸激酶抑制剂 (tyrosine kinase inhibitors,TKIs)的出现,其疗效 发生分水岭样的巨大变化。国际多中心研究 COGAALL0031 方案采取强化疗联合第一代络氨酸激 酶抑制剂—伊马替尼治疗儿童 Ph+ ALL,完全缓解 率达 95%,诱导相关病死率为 0,5 年随访强化疗 联合伊马替尼组无病生存率(disease-free survival, DFS)达(70±12)%,相关供者造血干细胞移 植(hematopoietic stem cell transplantation,HSCT) 组 DFS 为(65±11)%,无 关 供 者 HSCT 组 为 (59±15)%。该研究同时提示强化疗联合 TKIs 可能替代移植,成为部分儿童 Ph+ ALL 的一线治疗 选择 [3, 4, 5];而二代络氨酸激酶抑制剂—达沙替尼因 其不同的作用机制以及良好的中枢神经系统渗透 性,在 COG-AALL0062 方案中已经应用于儿童 Ph+ ALL 的治疗。本研究对 3 例初治 Ph+ ALL 患儿选择 达沙替尼联合 CCLG2008 方案进行治疗,并对其 安全性及治疗疗效进行评价。 1 资料与方法 1.1 研究对象
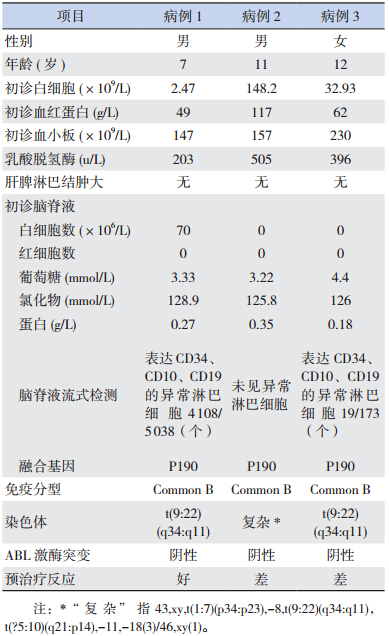
研究对象为 3 例初诊 Ph+ ALL 患儿,年龄分别为 7、11、12 岁,其中男孩 2 例,女孩 1 例。3 例患儿临床资料见表 1。
| 表 1 3 例患儿的临床生物学特征 |
诊断标准参照 2014 儿童急性淋巴细胞白血病 诊疗建议(第四次修订) [6],免疫分型采用多参数 流式细胞仪,最低诊断分型建议参考 EGIL 标准, 伴髓系表达的标准为肿瘤细胞除表达淋系抗原外 同时共同表达任何一种髓系抗原(CD13、CD33、 CD14、CD15 或 MPO)。Ph+ ALL 诊断至少有细胞 遗传学或分子生物学一项为阳性。采取 R 显带技 术确定染色体核型及应用 RT-PCR 检测技术确定 BCR-ABL 融合基因。将流式细胞术检测脑脊液内 白血病细胞纳入临床特征评价 [7]。 1.3 治疗方案
3 例患儿均接受达沙替尼联合 CCLG2008(高 危组)方案进行化疗。GGLG2008 方案诱导缓解治 疗方案为:长春新碱 1.5 mg/m2,第 8、15、22、 29 天使用;柔红霉素 25 mg/m2,第 8、15、22、29 天使用;左旋门冬酰胺酶 5000 u/m2,第 8、11、 14、17、20、23、26、29 天使用;地塞米松初始 剂量为 6 mg/m2,第 8~29 天使用,逐渐减量。
治疗流程如下:诊断明确后首先进行糖皮质 激素预治疗,评价治疗反应,之后选择四药联合(长 春新碱 + 柔红霉素 + 左旋门冬酰胺酶 + 地塞米松) 诱导缓解治疗,诱导治疗第 15 天联合应用达沙 替尼,第 15 天、第 33 天评价骨髓缓解状态并以 PCR 和 MFC 评 价 MRD 结 果,之 后 给 予 CAM×2 方案(环磷酰胺 + 阿糖胞苷 + 巯嘌呤)早期强化 治疗,之后序贯予 HR(包含有大剂量甲氨蝶呤、 阿糖胞苷等药物)方案,每 3 个月评价微小残留 病(MRD),根据 MRD 结果选择移植或单纯化疗 联合达沙替尼,期间建议连续应用达沙替尼(每 日 60 mg/m2)。达沙替尼的停药指征为:合并严 重感染;3~4 级不良反应严重不能耐受;中性粒细 胞减少伴发热。 1.4 安全性评价
根据美国国立癌症研所化疗毒性分级标准 (NCI-CTC4.0 版)评价药物毒性 [8]。根据下面的 一般准则对每个不良事件的严重程度作特定的临 床描述,分为 5 级。1 级为轻度:无症状或轻微; 仅为临床或诊断所见;无需治疗。2 级为中度:需 要较小、局部或非侵入性治疗;与年龄相当的工 具性日常生活活动受限。3 级为严重或者医学上有 重要意义但不会立即危及生命;导致住院或者延 长住院时间;致残;个人日常生活活动受限。4 级 危及生命;需要紧急治疗。5 级为与不良事件相关 的死亡。 2 结果 2.1 治疗转归
病例 1:糖皮质激素预治疗反应好,治疗过程 中 ABL 激酶检测未见突变,患儿持续口服达沙替 尼 8 个月,后因经济困难放弃化疗,院外口服伊 马替尼(260 mg/m2),随访 12 个月仍存活。
病例 2:糖皮质激素预治疗反应差,治疗过 程中 ABL 激酶检测未见突变,患儿化疗期间及间 歇期持续口服达沙替尼(每日 60 mg/m2),曾出 现中性粒细胞减少伴发热而停药,好转后继续治 疗,化疗 13 个月后选择移植,随访 18 个月仍存 活。病例 3:糖皮质激素预治疗反应差,治疗过程 中 ABL 激酶检测未见突变,化疗期间及间歇期持 续口服达沙替尼(每日 60 mg/m2),曾出现中性 粒细胞减少伴发热而停药,好转后继续治疗,化 疗 10 个月后选择移植,随访 15 个月仍存活。 2.2 毒性评价
应用达沙替尼联合化疗过程中,3 例患儿无论 在诱导缓解过程中,或巩固强化治疗过程中,化 疗毒性未见明显增加,不良反应主要表现为恶心、 呕吐、腹泻、脱发、胆红素升高等,以及 2~4 级 的血液学毒性。 2.3 临床疗效评价
病例 1、2、3 糖皮质激素预治疗反应评价时 外周血幼稚细胞数均 >1×109/L,序贯行四药联 合诱导缓解治疗,诱导治疗第 15 天骨髓 PCR 检 测 BCR-ABL 转 录 本 分 别 为 0.47%、138.88%、 337.87%。联合应用达沙替尼后,第 33 天再次评 价骨髓均达完全缓解(CR),流式细胞细胞术检 测 MRD 达到 0~0.15%,之后治疗 3 个月及 6 个月 均进行疗效评价,BCR-ABL 转录本为阴性或 BCRABL 转录本基线值下降≥ 3 log,疗效稳定,且持 续监测 ABL 激酶未见突变。随访 1 年,其中 2 例 选择单倍体造血干细胞移植,1 例放弃治疗,但均 为无病存活状态。 3 讨论
靶向药物的应用在儿童 Ph+ ALL 的治疗中已 不可或缺,而达沙替尼作为第二代络氨酸激酶抑 制剂,从治疗靶点、中枢神经系统渗透能力以及 原发或继发耐药等方面来讲,可能更具优越性 [9]。 首先,Ph+ ALL 的疾病发生不仅仅和 BCR-ABL 相关, SRC 激酶家族等亦参与白血病侵袭性临床进程的 形成,而达沙替尼的作用靶点包括 Src 和 Abl 激酶, 优于伊马替尼 [10];同时达沙替尼对 BCR-ABL 具有 更强的选择性和亲和力,比第一代络氨酸激酶抑 制剂伊马替尼高 20~30 倍,因此理论上达沙替尼 对于 Ph+ ALL 的抗白血病作用更加优于第一代络 氨酸激酶抑制剂;其次,从原发和继发耐药而言, 目前已报道的 ABL 激酶点突变超过 100 种,除 T315I 突变外,达沙替尼对其中许多突变都有临床 疗效,而且体外细胞模型显示 22 个伊马替尼耐药 的 BCR-ABL 突变中,达沙替尼对其中 21 个有活 性,唯一例外的是 T315I 突变 [11];同时达沙替尼 还具有良好的中枢神经系统的渗透性 [12],理论上 可以针对“庇护所白血病”,降低儿童急性淋巴 细胞白血病复发的风险,从而进一步提高生存率。 目前 COG-AALL0062 方案以达沙替尼联合化疗应 用于儿童 Ph+ ALL 患者 [13],正是基于达沙替尼的 上述优势,同时该方案降低了细胞毒药物的使用 剂量和中枢神经系统的预防治疗强度,目的是减 低治疗毒性,目前该研究的结果尚未报道。
我中心选取初诊时脑脊液流式检测异常和 (或)糖皮质激素预治疗反应差的 Ph+ ALL 3 例患 儿,应用达沙替尼联合 CCLG2008(高危组)方 案,达沙替尼的剂量参考 COG-AALL0062 方案(每 日 60 mg/m2),应用时间为诱导治疗第 15 天,之 后建议持续口服达沙替尼 [14]。3 例患儿中 1 例糖皮 质激素预治疗反应好,2 例预治疗反应差,2 例患 儿初诊时 MFC 脑脊液检测发现异常(白血病)细 胞,诱导治疗第 15 天 2 例预治疗反应差的患者骨 髓均为 M3 状态。3 例采取达沙替尼联合强化疗治 疗后,化疗相关的骨髓抑制时间并未较其他高危 组患儿延长,在诱导缓解治疗期间,严重感染发 生的几率反而下降,第 33 天 CR 率为 100%,融合 基因的拷贝数较前明显下降,MFC 检测 MRD 下降 至 0~0.15% 左右,治疗 3 个月及 6 个月复查 MRD逐渐下降或转阴,随访 1 年仍为无病生存状态, 脑脊液 MFC 复查始终显示未见异常(白血病)细胞。 作为我国儿童 Ph+ ALL 治疗的初步探索,第二代络 氨酸激酶抑制剂达沙替尼在 3 例患儿中获得了良 好的疗效。
Aplenc 等 [15] 曾在达沙替尼的儿童 I 期临床和 药代动力学研究中发现,在血液肿瘤中单药应用 不同剂量的达沙替尼,其不良事件的发生与成人 相似,主要表现为低蛋白血症、腹泻、胸腔积液、 胸痛、皮疹等。因此本研究对于联合治疗是否会 使不良事件的发生率增加也进行了观察,发现无 论是诱导缓解治疗,还是巩固强化治疗,患儿的 化疗不良反应未见增加;3 例患儿在病程中未出现 低钾血症、体液潴留、QT 间期延长、肺动脉高压 等药物相关不良反应,主要表现为恶心、呕吐、 腹泻、脱发、胆红素升高等,以及 2~4 级的血液 学毒性,不良事件发生后经对症治疗均可好转。
有研究提示 MRD 在治疗早期明显下降并且维 持于低水平可提高 Ph+ ALL 的生存率 [16],Lee 等 [17] 报道在伊马替尼治疗 1 个月后 BCR-ABL 转录本 若 下 降 3-log,复 发 率 会 明 显 降 低;2013 年 MD Anderson 癌症中心对成人 Ph+ ALL 的研究也证实, 在化疗联合伊马替尼或达沙替尼的患者中,完全 缓解时,获得主要分子学反应(MMR,BCR-ABL/ ABL<0.1%)和流式检测 MRD 阴性对生存无明显 影响,但是在 3、6、9、12 个月时 MMR 阴性以及 3、 12 个月流式检测 MRD 阴性,则对提高生存率有显 著意义 [18]。在此 3 例患儿中,达沙替尼联合治疗 使 MRD 水平迅速下降并在随访期间持续保持低水 平,成为获得移植机会或者长期生存的基础。
Porkka 等 [12] 在体外动物实验以及合并中枢神 经系统复发 Ph+ ALL 患者中均证实了达沙替尼治 疗中枢神经系统白血病的有效性;COG-AALL0062 方案也提出应用达沙替尼后可考虑降低中枢神经 系统白血病预防和治疗的强度,以降低远期化疗 毒性的发生,进一步提高患者的生存质量,但是 目前未有明确的临床数据支持这一设想。本研究 中 2 例患儿初诊时 MFC 检测脑脊液中具有异常(白 血病)细胞,应用达沙替尼后,并未减低原有方 案中预防中枢神经系统白血病的强度,病程中脑 脊液常规、生化及 MFC 检测持续未发现异常,具 有较好的稳定性和疗效。
由于儿童 Ph+ ALL 这一亚型所占比例较低, 以及卫生经济学等多种因素的限制,我们用该方 案治疗的病例数十分少,且具有随访时间短的缺 陷,但第二代络氨酸激酶抑制剂达沙替尼在儿童 Ph+ ALL 治疗上的初步探索,以及其良好的安全性 和疗效,是我们今后临床工作的基石,对今后儿童 Ph+ ALL 的治疗方案的制定具有一定的临床意义。
| [1] | Pui CH, Evans WE. Treatment of acute lymphoblastic leukemia[J]. N Engl J Med, 2006, 354(2):166-178. |
| [2] | Arico M, Valsecchi MG, Camitta B, et al. Outcome of treatment in children with Philadelphia chromosome-positive acute lymphoblastic leukemia[J]. N Engl J Med, 2000, 342(14):998-1006. |
| [3] | Schultz KR, Bowman WP, Aledo A, et al. Improved early eventfree survival with imatinib in Philadelphia chromosome-positive acute lymphoblastic leukemia:a children's oncology group study[J]. J Clin Oncol, 2009, 27(31):5175-5181. |
| [4] | Schultz KR, Bowman WP, Aledo A, et al. Continuous dosing Imatinib with intensive chemotherapy gives equivalent outcomes to allogeneic BMT for Philadelphia chromosomepositive (Ph+) acute lymphoblastic leukemia (ALL) with longer term follow up:Updated Results of Children's Oncology Group (COG)AALL0031[J]. Pediatr Blood Cancer, 2010, 54:788. |
| [5] | Schultz KR, Carroll A, Heerema NA, et al. Long-term follow-up of imatinib in pediatric Philadelphia chromosome-positive acute lymphoblastic leukemia:Children's Oncology Group Study AALL0031[J]. Leukemia, 2014, 28(7):1467-1471. |
| [6] | 中华医学会儿科学分会血液学组. 2014 儿童急性淋巴细胞 白血病诊疗建议(第四次修订)[J]. 中华儿科杂志, 2014, 52(9):641-644. |
| [7] | 杨文钰, 王慧君, 陈玉梅, 等. 脑脊液流式细胞学检测技术 在急性淋巴细胞白血病儿童并发中枢神经系统白血病中的 诊断价值[J]. 中国实验血液学杂志, 2012, 20(1):38-42. |
| [8] | Common Terminology Criteria for Adverse Events (CTCAE)[S].Version 4.0. Department of Health and Human Services, National Institutes of Health National Cancer Institute, US. 2009. |
| [9] | Ramirez P, DiPersio JF. Therapy options in imatinib failures[J]. Oncologist, 2008,13(4):424-434. |
| [10] | Li S. Src-family kinases in the development and therapy of Philadelphia chromosome-positive chronic myeloid leukemia and acute lymphoblastic leukemia[J]. Leuk Lymphoma, 2008, 49(1):19-26. |
| [11] | Baccarani M, Cortes J, Pane F, et al. Chronic myeloid leukemia:an update of concepts and management recommendations of European Leukemia[J]. Net. J Clin Oncol, 2009, 27(35):6041-6051. |
| [12] | Porkka K, Koskenvesa P, Lundán T, et al. Dasatinib crosses the blood-brain barrier and is an efficient therapy for central nervous system Philadelphia chromosome-positive leukemia[J]. Blood, 2008, 112(4):1005-1012. |
| [13] | Aplenc R, Blaney SM, Strauss LC, et al. Pediatric phase I trial and pharmacokinetic study of dasatinib:a report from the children's oncology group phase I consortium[J]. J Clin Oncol, 2011, 29(7):839-844. |
| [14] | Hunger SP. Tyrosine kinase inhibitor use in pediatric Philadelphia chromosome-positive acute lymphoblastic anemia[J]. Hematol Am Soc Hematol Educ Program, 2011, 2011:361-365. |
| [15] | Aplenc R, Blaney SM, Strauss LC, et al. Pediatric phase I trial and pharmacokinetic study of dasatinib:a report from the children's oncology group phase I consortium[J]. J Clin Oncol, 2011, 29(7):839-844. |
| [16] | Jeha S, Coustan-Smith E, Pei D, et al. Impact of tyrosine kinase inhibitors on minimal residual disease and outcome in childhood Philadelphia chromosome-positive acute lymphoblastic leukemia[J]. Cancer, 2014, 120(10):1514-1519. |
| [17] | Lee S, Kim DW, Cho B, et al. Risk factors for adults with Philadelphia-chromosome-positive acute lymphoblastic leukaemia in remission treated with allogeneic bone marrow transplantation:the potential of real-time quantitative reversetranscription polymerase chain reaction[J]. Br J Haematol, 2003, 120(1):145-153. |
| [18] | Ravandi F, Jorgensen JL, Thomas DA, et al. Detection of MRD may predict the outcome of patients with Philadelphia chromosome-positive ALL treated with tyrosine kinase inhibitors plus chemotherapy[J]. Blood, 2013, 122(7):1214-1221. |
 2015, Vol. 17
2015, Vol. 17