2. 武汉大学中南医院, 湖北 武汉 430071
川崎病(Kawasaki disease,KD)是一种以全身血管炎为主要病变的急性发热出疹性疾病,临床表现为发热、口腔黏膜病变、颈部淋巴结肿大等症状,其诊断主要依据患儿发热≥5 d,至少具有5项主要临床特征的4项[1]。但临床上可见到一部分患儿临床特征少于典型KD患儿,被称为不完全KD,其定义为:患儿具有不明原因发热≥5 d,但在其他5项临床特点中仅具有2项或3项,并存在超声心动图异常(冠状动脉扩增、冠状动脉瘤、左心室功能下降等),但在疾病的早期患者可能未见超声心动图异常,则需要根据临床生化指标(血沉、CRP等)初步诊断;并且要排除猩红热、药物过敏、Stevens-Johnson综合征等疾病[2, 3];其发生率约占所有KD的10%~36%[4, 5]。全基因组关联分析研究表明,CD40基因以及BLK基因可能与典型KD的易感性相关[6]。本研究以我国中部地区不完全KD患儿为研究对象,探讨CD40基因以及BLK基因的多态性与不完全KD及其临床特点的相关性。 1 资料与方法 1.1 研究对象
选取2008年1月至2014年6月来武汉大学中南医院就诊的184例不完全KD患儿为KD组;选取203名同时期在中南医院体检正常的儿童作为对照组,排除了各系统的疾病。KD组与对照组均是来自湖北武汉及周边地区的汉族儿童。患儿不完全KD的诊断符合美国心脏病学会2004年制定的不完全KD的诊断方法,并结合国内专家制定的评估方法[2, 3]。
KD组184例患儿中,男119例,女65例,年龄5个月至7岁10个月,中位年龄1.9岁(四分位间距:1.1~3.9岁);患儿热程均≥5 d(范围5~11 d);其中有皮疹症状的患者88例(47.8%),结膜充血患者128例(69.6%);淋巴结肿大的患儿60例(32.6%)。四肢末端改变的患儿119例(64.7%),口唇变化的患儿112例(60.8%),冠状动脉损伤的患儿49例(26.6%)。同时具有以上2种临床特点的患儿80例(43.5%),同时具有3种临床特点的104例(56.5%)。
对照组203例儿童中,男133例,女70例,年龄10个月至8岁,中位年龄2.1岁(四分位间距:1.2~3.7岁)。年龄和性别比例与KD组比较差异无统计学意义(P>0.05)。
本研究得到两组儿童家属知情同意以及中南医院医学伦理委员会的批准。 1.2 基因多态性分析
抽取KD患儿初诊时及正常对照儿童体检时的外周静脉血2 mL,利用酚氯仿抽提以及乙醇沉淀的方法提取基因组DNA。以DNA为模版分别扩增含有SNP位点的DNA片段。扩增CD40基因片段(rs1569723)的引物分别为F1:AGAACTCGCTTTACACCCAGAGCT,R1:CCATGAGGGACTTCCTTTGAATTTC。扩增BLK基因片段(rs2736340)的引物分别为F2:CCCATCGCATTGTATATGTACCG,R2:CAGGGATGCTGATTCTAAGGCATG。所有引物均由华大基因公司合成。PCR总反应体系为25 μL,含有10倍PCR反应缓冲液2.5 μL,10 mM dNTP混合液1 μL,10 μM引物各1 μL,TAKARA公司 Taq酶1 U。反应条件为:94℃ 3 min预变性;94℃ 30 s变性,54℃ 30 s退火,72℃ 30 s延伸,共34个循环。分别取5 μL扩增的产物利用限制性内切酶SacI以及DpnII进行酶切电泳分析。 1.3 统计学分析
利用SPSS 19.0统计软件对数据进行分析处理,利用Hardy-Weinberg遗传平衡定律检验KD组及对照组是否具有群体代表性。各组基因型频率和等位基因频率采用频数和百分比表示,组间比较采用χ2检验。年龄呈非正态分布,采用中位数(四分位间距)表示,两组间比较采用秩和检验。P<0.05为差异有统计学意义。 2 结果 2.1 两组SNP位点基因型分布及比较
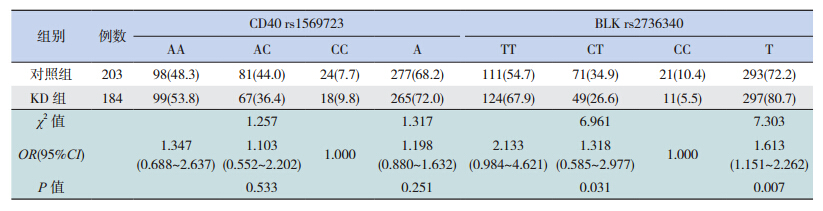
KD组和对照组儿童均符合Hardy-Weinberg遗传平衡定律,说明纳入的两组儿童具有群体代表性。两个SNP位点多态性确定如图 1所示,含有SNP位点rs1569723的3种基因型分别为AA、CC、AC;SNP位点rs2736340的3种基因型分别为TT、CT、CC。两组两个SNP位点3种基因型分布见表 1。统计结果显示KD组BLK基因SNP位点(rs2736340)的3种基因型(TT、CT、CC)分布与对照组相比差异具有统计学意义(P=0.031),且T等位基因与不完全KD易感性相关(P=0.007);而两组CD40基因SNP位点(rs1569723)3种基因型(AA、CC、AC)分布及等位基因分布差异无统计学意义(P>0.05),见表 1。
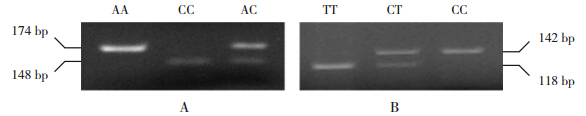 |
图 1 SNP位点基因型 A:SNP位点 rs1569723的 3种基因型为 AA、CC和 AC;B: SNP位点 rs2736340的 3种基因型为 TT、CT和 CC。 |
| 表 1两组两个 SNP位点的基因型分布 |
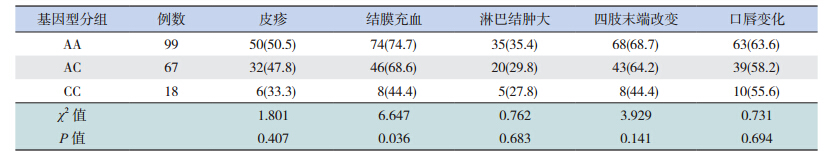
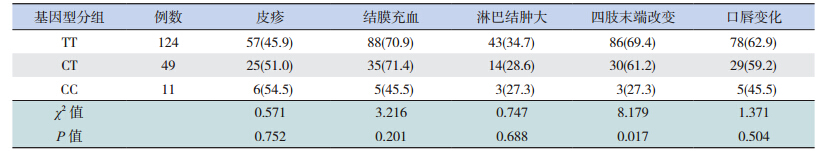
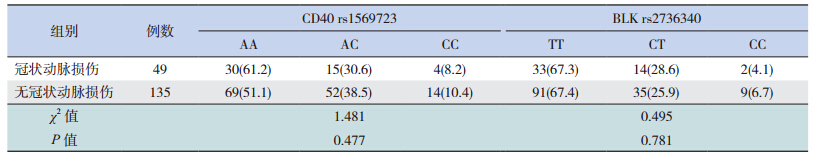
CD40基因SNP位点(rs1569723)3种不同基因型患儿结膜充血的比例差异有统计学意义(P=0.036),见表 2;而BLK基因SNP位点(rs2736340)的多态性与患儿四肢末端改变相关(P=0.017),见表 3。CD40基因的SNP位点(rs1569723)与BLK基因SNP位点(rs2736340)的多态性均不与冠状动脉损伤相关(P>0.05),见表 4。
| 表 2 CD40基因 SNP位点(rs1569723)基因多态性与不完全 KD临床特点的相关性 |
| 表 3 BLK基因 SNP位点(rs2736340)基因多态性与不完全 KD临床特点的相关性 |
| 表 4两个 SNP位点与冠状动脉损伤的相关性 |
KD是一种急性、免疫性、血管炎性的疾病,主要侵犯大中血管,冠状动脉损伤是其主要的并发症。不完全KD是一种不能完全满足KD的诊断标准,仅具有部分典型KD的临床特点,目前不完全KD没有诊断的金标准,日本与美国的诊断方法也存在差异[5, 7]。不完全KD与KD的病因与发病机制相同,但仍不完全清楚,遗传因素在该病的发病过程中起着重要作用[8]。
BLK基因为编码络氨酸激酶BLK蛋白,该蛋白是src络氨酸激酶家族成员之一,BLK的功能目前并不十分清楚,但有研究人员推断:BLK把信号转导至B细胞受体下游激活核转录因子,BLK基因表达水平可能影响B细胞的耐受机制,从而导致免疫性疾病的发生[9]。
本研究结果显示,不完全KD的BLK基因SNP位点(rs2736340)TT基因型的比例及T等位基因频率显著高于对照组,提示BLK基因SNP位点(rs2736340)与不完全KD的易感相关。该位点位于BLK基因的上游,可能调控该基因的表达,导致自身免疫紊乱;且有研究表明该位点与典型KD的易感性相关[6],说明典型KD与不完全KD的致病机制具有一致性。
CD40基因位于20q12-q13.2区域,编码TNF受体超家族成员5,参与炎症应答、免疫应答信号转导等过程;研究表明CD40-CD40L信号通路参与炎症反应过程[10];且CD40L基因与KD的易感性相关[11]。因此CD40基因的突变或者表达量的变化可能影响该通路的应答过程,从而导致KD或不完全KD的发生。本研究显示CD40基因的SNP位点(rs1569723)的多态性与不完全KD的易感性不相关,提示该多态性不影响不完全KD患者CD40基因的表达量,进而对该基因参与的信号通路不产生影响。而Lee等[6]全基因组关联分析发现CD40基因该位点与典型KD的易感性相关;国内亦有研究发现汉族人群中该位点多态性与KD易感性相关[12]。因此,推测典型KD与不典型KD的病因或病理过程可能存在一定的差异。
与典型KD患儿一样,部分不完全KD患儿也存在皮疹、结膜充血、口唇变化以及四肢末端改变等症状[13]。本研究发现CD40基因多态性(rs1569723)与结膜充血症状相关,推测可能的原因是:结膜充血常见于炎症反应;CD40为CD40-CD40L信号通路中的重要组成部分,而该信号通路在炎症反应中发挥着重要作用,CD40基因的多态性影响了该信号通路,虽然对信号通路的影响没有导致不完全KD的发生,但该多态性可能影响下游炎症因子的水平,从而导致结膜充血的发生。而BLK基因的多态性与不完全KD患儿四肢末端改变等症状相关,推测可能由于该基因参与炎症以及自身免疫应答过程所致。此外,本研究显示两个SNP位点的多态性均不与冠状动脉损伤的易感性相关,但本研究病例数较少,结论需要进一步验证。
综上所述,在汉族人群中BLK基因SNP位点(rs2736340)与不完全KD的易感相关,并且发现该多态性与患儿四肢末端改变相关;CD40基因多态性(rs1569723)与患儿结膜充血症状相关。本研究结果对临床医生更好地认识不完全KD的发病机制,减少并发症的发生提供帮助。但本研究仍存在一定的缺陷:样本量小,单中心研究,因此研究结果需要多中心合作、更大的样本量来验证。
| [1] | Ogihara Y, Ogata S, Nomoto K, et al. Transcriptional regulation by infliximab therapy in Kawasaki disease patients with immunoglobulin resistance[J]. Pediatr Res, 2014, 76(3): 287-293. |
| [2] | Newburger JW, Takahashi M, Gerber MA, et al. Diagnosis, treatment, and long-term management of Kawasaki disease: a statement for health professionals from the Committee on Rheumatic Fever, Endocarditis, and Kawasaki Disease, Council on Cardiovascular Disease in the Young, American Heart Association[J]. Circulation, 2004, 110(17): 2747-2771. |
| [3] | 黄敏,杨晓东.不完全川崎病的诊断与治疗[J].实用儿科临床杂志, 2008, 23(1): 76-78. |
| [4] | 张乾忠.不典型川崎病的临床表现和诊断[J].中国实用儿科杂志, 2006, 21(10): 728-730. |
| [5] | Sánchez-Manubens J, Bou R, Anton J. Diagnosis and classification of Kawasaki disease[J]. J Autoimmun, 2014, 48-49: 113-117. |
| [6] | Lee YC, Kuo HC, Chang JS, et al. Two new susceptibility loci for Kawasaki disease identified through gnome-wide association analysis[J]. Nat Genet, 2012, 44(5): 522-525. |
| [7] | Sudo D, Monobe Y, Yashiro M, et al. Coronary artery lesions of incomplete Kawasaki disease: a nationwide survey in Japan[J]. Eur J Pediatr, 2012, 171(4): 651-656. |
| [8] | Rowley AH. Kawasaki disease: novel insights into etiology and genetics susceptibility[J]. Annu Rev Med, 2011, 62(2): 69-77. |
| [9] | Peter KG, Chistopher I, Annette TL, et al. REL, encoding a member of the NF-B family of transcription factors, is a newly defined risk locus for rheumatoid arthritis[J]. Nat Genet, 2009, 41(7): 820-823. |
| [10] | Lezzi G, Sonderegger I, Ampenberger F, et al. CD40-CD40L cross talk integrates strong antigenic signals and microbial stimuli to induce development of IL-17-producing CD4+ T cells[J]. Proc Natl Acad Sci USA, 2009, 106(3): 876-881. |
| [11] | Onouchi Y, Onoue S, Tamari M, et al. CD40L gene and Kawasaki disease[J]. Eur J Hum Genet, 2004, 12(12): 1062-1068. |
| [12] | 董启忠,张超,李月茹. CD40基因多态性与川崎病及其临床特点的相关性分析[J].临床儿科杂志, 2014, 32(8): 760-762. |
| [13] | Miller MM, Miller AH. Incomplete Kawasaki disease[J]. Am J Emerg Med, 2013, 31(5): e5-37. |
 2015, Vol. 17
2015, Vol. 17