川崎病(Kawasaki disease,KD)又称为皮肤黏膜淋巴结综合征,是一种病因不明,以急性发热、皮肤黏膜病损和淋巴结肿大为临床表现的全身性血管炎综合征,好发于5岁以下的幼儿[1]。该疾病是一种病因复杂的多因素疾病,而家族聚集现象提示遗传因素在疾病的发生发展过程中起着重要作用[2]。TARC/CCL17是Th2(T helper 2)细胞的趋化因子,且研究认为TARC/CCL17是Th2相关的过敏性疾病易感性的候选基因[3]。Lee等[4]研究发现在我国台湾人群中该基因多态性可能与KD的易感性相关。本研究以我国中部地区汉族KD患儿为研究对象,探讨TARC/CCL17基因的标签SNP(Tag SNP)位点rs223895与rs223899的多态性与KD易感性及其临床特点的相关性。 1 资料与方法 1.1 研究对象
病例组选取2011年6月至2014年3月在我院感染免疫科住院的KD患儿218例,均是典型KD患儿;248名同时期体检正常儿童作为对照组。KD组的纳入标准:(1)符合日本川崎病研究委员会2002年修订的川崎病诊断标准[2],且均是典型KD患儿;(2)排除猩红热、葡萄球菌烫伤样皮肤综合征、药物过敏及幼年性类风湿性疾病等疾病。
病例组纳入的218例患儿中,男148例,女70例,平均年龄3.4±2.5岁(范围4个月~8岁7个月);其中经超声心动图检查,冠状动脉存在异常的患儿48例。对照组248例中,男161例,女87例,平均年龄3.3±2.7岁(范围6个月~9岁)。病例组和对照组之间年龄和性别比例的差异无统计学意义(P分别为0.218、0.458)。两组儿童均来自湖北及其周边地区。
本研究得到两组儿童家属知情同意以及我院医学伦理委员会的批准。 1.2 TARC/CCL17基因多态性分析
抽取KD患儿及正常对照儿童静脉血2 mL,利用酚氯仿抽提以及乙醇沉淀的方法提取基因组DNA。以DNA为模版分别扩增含有SNP位点的DNA片段。设计的引物分别为F1:GTAATGATTCCAGAGCCTCTGC,R1:CCTTTCATTCATGACCAAACTGC;F2:CCTATGGGATGGATGCCAAGGGA,R2:GAGGAAGTGGCAGTGAGGCAG。PCR总反应体系为20 μL,含有10倍PCR反应缓冲液2.0 μL,10 mM dNTP混合液1 μL,10 μM引物各1 μL,TAKARA公司 Taq酶1 U。反应条件:94℃ 3 min预变性;94℃ 30 s变性,56℃ 30 s退火,72℃ 30 s延伸,共34个循环。分别取6 μL扩增的产物利用内切酶Eco53kI以及AvaII进行酶切电泳分析。 1.3 统计学分析
采用SPSS 16.0统计软件进行数据分析。利用Hardy-Weinberg遗传平衡定律检验病例组及对照组是否具有群体代表性。基因型频率分布和等位基因频率分布用频数和百分率表示,组间比较采用χ2检验;计量资料用均值±标准差(x±s)表示,组间比较采用两独立样本t检验。P<0.05示差异有统计学意义。 2 结果 2.1 TARC/CCL17基因SNP位点基因型的确定及分布
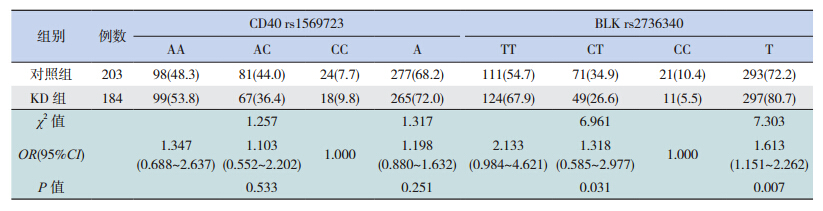
Hardy-Weinberg遗传平衡定律检验示两组均具有群体代表性。两个SNP位点多态性确定如图 1所示,其中SNP位点(rs223895)的3种基因型为CC、CT和TT;rs223899的3种基因型为CC、CA和AA。统计结果显示病例组中SNP位点(rs223895)的3种基因型分布与对照相比差异具有统计意义(P=0.031),且在隐性模式下(CC vs CT+TT)相关(P=0.019),显性模式(CC+CT vs TT)不相关(P=0.062),且C等位基因与KD易感性相关(P=0.012),说明该位点与KD的易感性相关;而两组间SNP位点(rs223899)基因型分布及等位基因频率差异均无统计学意义(表 1)。
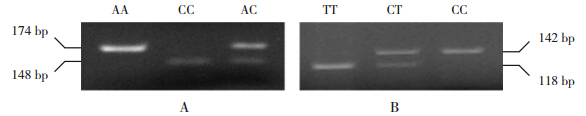 |
图 1 两个 SNP位点的基因型确定 A:SNP位点(rs223895)的 3种基因型为 CC、CT和 TT;B:SNP位点(rs223899)位点的 3种基因型为 CC、CA和 AA。 |
| 表 1病例组和对照组两个 SNP位点的基因型分布的比较 |
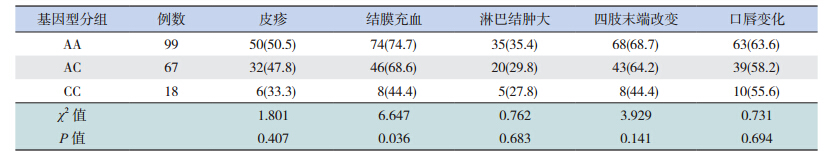
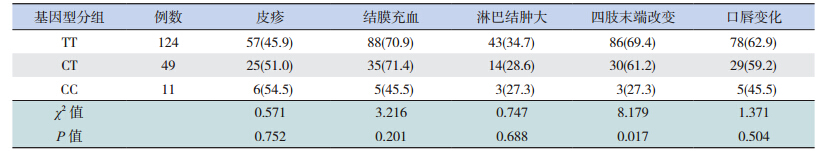
病例组纳入的KD患儿在初诊时多有结膜充血(188例,86.2%)、皮疹(138例,63.3%)、口腔黏膜病变(185例,84.9%)、淋巴结肿大(161例,73.9%)等症状,部分患儿有冠状动脉损伤的特征(48例,21.9%),且多数患儿存在白细胞计数异常 (156例,71.6%)、血小板升高(178例,81.6%)、血沉加快(195例,89.4%)、C反应蛋白水平升高(215例,98.6%)以及血红蛋白降低(123例,56.4%)和白蛋白水平降低(153例,70.2%)的现象。统计结果显示,TARC/CCL17基因的SNP位点(rs223895)CC基因型的KD患儿血红蛋白以及白蛋白水平低于其他基因型的KD患儿,差异有统计学意义(P<0.05);与其他基因型患儿相比,CC基因型的患儿血沉水平较高(P<0.05),见表 2;但该多态性与结膜充血、淋巴结肿大、口腔黏膜病变、冠状动脉损伤等指标不具有相关性(P>0.05)(表 3)。
| 表 2 TARC/CCL17基因 SNP rs223895位点多态性与 KD患儿实验室指标的相关性 |
| 表 3 TARC/CCL17基因 SNP rs223895位点多态性与 KD患儿临床表现的相关性 |
TARC/CCL17基因位于16号染色体q13区域,含有4个外显子,编码趋化因子蛋白,在T细胞的发育成熟过程中起着重要作用。TARC/CCL17是CC趋化因子组中的重要组成之一,是CC趋化因子4(CCR4)受体的一个配体基团[5],而CCR4选择性地在Th2细胞中表达;TARC/CCL17可在细胞中结合到CCR4和CCR8受体上行使功能[6]。TARC/CCL17基因被认为是Th2细胞相关的过敏性反应疾病的候选基因,与特应性皮炎以及支气管哮喘的病理过程密切相关,在特应性皮炎中TARC/CCL17的水平明显高于健康对照组[7]。研究表明在KD患者中存在Th1/Th2比例异常的现象[8];且有证据表明KD患者中发生特应性皮炎以及支气管哮喘的比例比正常对照组高9倍[9]。在动物实验中发现Th2细胞产生的IL-4可通过IL-4/STAT6通路调控TARC/CCL17的表达水平[10]。
在台湾人群中研究发现,两个SNP位点(rs223895和rs223899)均与KD的易感性相关,C和A等位基因分别为危险因子[4]。本研究发现SNP位点rs223895的基因多态性与KD的易感性相关,而rs223899与KD不相关。导致这种结果不同的可能原因是地域及人群的差异。本研究通过对KD患儿的生化指标分析发现,rs223895位点的多态性与一些生化指标相关,其中CC基因型患儿血沉明显高于CT和TT型的患儿;而CC基因型患儿血红蛋白以及白蛋白含量低于其他基因型患儿,并且有研究表明患儿血红蛋白及白蛋白低是KD以及KD并发冠状动脉损伤的危险因素[11],提示CC基因型为KD易感性的风险因子。但本研究结果显示该多态性与冠状动脉损伤不存在相关性,可能与病例数较少有关,需要进一步的验证。
总之,本研究发现SNP位点(rs223895)的多态性与KD的易感性相关,C等位基因为风险因子;且在临床检验中发现CC基因型的患儿的血红蛋白、白蛋白以及血沉水平与其他基因型患儿存在差异。该结果对更好地认识KD提供了一定的帮助,但由于本研究存在冠状动脉损伤病例数较少的缺陷,因此应在收集更大样本量以后再进一步统计分析该基因多态性与冠状动脉损伤的相关性;此外,今后应测定患儿血清中CCL17的水平,进一步探讨该基因不同的基因型与血清中CCL17因子的关系。
| [1] | Bayers S, Shulman ST, Paller AS. Kawasaki disease: part I. Diagnosis, clinical features, and pathogenesis[J]. J Am Acad Dermatol, 2013, 69(4): 1-11. |
| [2] | 彭茜, 陈昌辉, 吴青, 等. CAPS3基因单核苷酸多态性与中国儿童川崎病的相关性研究[J].中华医学遗传学杂志, 2013, 30(2): 180-184. |
| [3] | Ogawa K, Morito H, Hasegawa A, et al. Identification of thymus and activation-regulated chemokine (TARC/CCL17) as a potential marker for early indication of disease and prediction of disease activity in drug-induced hypersensitivity syndrome (DIHS)/drug rash with eosinophilia and systemic symptoms (DRESS)[J]. J Dermatal Sci, 2013, 69(1): 38-43. |
| [4] | Lee C, Huang YH, Hsu Y, et al. TARC/CCL17 gene polymorphisms and expression associated with susceptibility and coronary artery aneurysm formation in Kawasaki disease[J]. Pediatr Res, 2013, 74(5): 545-551. |
| [5] | Moriyama M, Hayashida JN, Yoyoshima T, et al. Cytokine/chemokine profiles contribute to understanding the pathogenesis and diagnosis of primary Sjögren's syndrome[J]. Clin Exp Immunol, 2012, 169(1): 17-26. |
| [6] | Imai T, Nagira M, Takagi S, et al. Selective recruitment of CCR4-bearing Th2 cells towardantigen-presenting cells by the CC chemokines thymus and activation-regulated chemokine and macrophage-derived chemokine[J]. Int Immunol, 1999, 11(1): 81-88. |
| [7] | Kataoka Y. Thymus and activation-regulated chemokine as a clinical biomarker in atopic dermatitis[J]. J Dermatol, 2014, 41(3): 221-229. |
| [8] | Kuo HC, Wang CL, Liang CD, et al. Association of lower eosinophil-related T helper (Th2) cytokines with coronary artery lesions in Kawasaki disease[J]. Pediatr Allergy Immunol, 2009, 20(3): 266-272. |
| [9] | Webster RJ, Carter KW, Warrington NM, et al. Hospitalisation with infection, asthma and allergy in Kawasaki disease patients and their families: genealogical analysis using linked population data[J]. PLoS One, 2011, 6(11): e28004. |
| [10] | Maier E, Duschi A, Horejs-Hoeck J, et al. STAT6-dependent and -independent mechanisms in Th2 polarization[J]. Eur J Immonol, 2012, 42(11): 2827-2833. |
| [11] | Kobayashi T, Inoue Y, Takeuchi K, et al. Prediction of intravenous immunoglobulin unresponsiveness in patients with Kawasaki disease[J]. Circulation, 2006, 113(22): 2606-2612. |
 2015, Vol. 17
2015, Vol. 17