黑色棘皮病(acanthosis nigricans,AN)是肥胖儿童常见的伴发疾病之一,是胰岛素抵抗的皮肤表现。AN多见于颈部、背部、腋窝和大腿内侧,主要表现为灰棕色、黑色色素沉着,不规则皮褶形成,表面粗糙,触之柔软如天鹅绒样[1]。肥胖儿童脂肪组织内分泌功能异常,促炎的脂肪因子如瘦素、肿瘤坏死因子α(TNF-α)、视黄醇结合蛋白(RBP4)等分泌增加;而抑炎的脂肪因子如脂联素分泌减少[2]。一方面脂肪因子异常可以导致胰岛素抵抗,高胰岛素血症引起皮肤黑色棘皮样变;另一方面体外研究表明脂肪因子可以激活脂肪因子受体直接刺激皮肤角质细胞增生[3]。尽管目前有在儿童中小规模的人群研究,但由于检测的脂肪因子单一,代谢相关指标不全,因此尚不能肯定脂肪因子与AN的关系[4]。
代谢综合征(metabolic syndrome,MS)是糖代谢异常、高血压、高血脂等多种2型糖尿病、心血管疾病危险因素在肥胖患者中聚集的现象。伴有MS的肥胖儿童成年后患相关代谢性疾病的发病风险明显增加[5-6]。MS和AN有共同的病理基础,都与肥胖后胰岛素抵抗有关。MS的诊断需要体格检查和生化结果回报后才能明确,实际工作中往往需要较长时间的等待。明确AN和MS的关系,可以帮助临床医生快速筛查高危肥胖儿童。
因此,本研究目的是对比肥胖伴AN患儿、肥胖无AN患儿及正常儿童的脂肪因子(脂联素、瘦素、RBP4、TNF-α)水平和代谢相关指标,探讨AN与MS的关系。 1 资料与方法 1.1 研究对象
选取2012年2月至2013年6月于西安交通大学第二附属医院儿科门诊就诊的109例肥胖患儿为研究对象,其中肥胖伴AN患儿44例,肥胖无AN患儿65例;并根据年龄、性别等基线情况选取同期进行健康体检的47例儿童作为健康对照。肥胖诊断标准为体重指数(BMI)≥P95[7];MS的诊断标准依据中国儿童青少年代谢综合征定义2012版(MS-CHN2012)[6];AN以患儿颈背部、腋下色素沉着伴柔软疣状增生为判定标准[8],排除由其他内分泌、遗传代谢性疾病及中枢神经系统疾病引起的继发性肥胖和肿瘤伴发的恶性AN,所有患者无近期感染,无心、肝、肾急慢性疾病史。 1.2 体格检查
所有儿童均进行身高、体重、血压、腰围、臀围测量,并计算BMI和腰臀比。男女分别以睾丸和乳房Tanner分期作为青春期发育阶段的划分标准[9]。 1.3 生化指标检测
取受试者(空腹10~12 h)肘静脉血,用全自动生化分析仪测定空腹血糖(FBG)、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白-胆固醇(HDL-C)和低密度脂蛋白-胆固醇(LDL-C);采用放射免疫法测定血清胰岛素(北京北方生物技术研究所),并计算稳态模型胰岛素抵抗指数(HOMA-IR)。用ELISA法测定血清脂联素、瘦素、TNF-α、RBP4水平(ELISA试剂盒均购自上海依科赛试剂公司),批内和批间变异系数均小于10%。 1.4 统计学分析
采用SPSS 19.0统计软件包对数据进行处理,计量资料均行Kolmogorov-Smirnov正态性检验,符合正态分布的计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验;偏态资料以中位数(四分位间距)[M(P25,P75)]表示,组间比较采用Kruskal-Wallis H检验。计数资料采用百分比(%)表示,组间比较采用χ2检验。对MS的危险因素分析采用逐步前进的多元logistic回归。P<0.05为差异有统计学意义。 2 结果 2.1 各组临床资料的比较
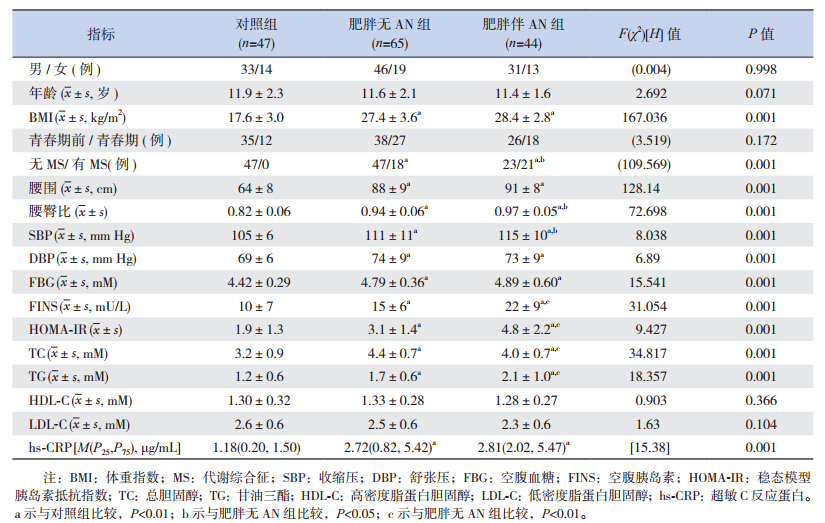
年龄、性别和青春发育分期情况在3组间比较差异无统计学意义(P>0.05)。从体格参数和生化指标的比较来看,与对照组相比,肥胖儿童的BMI、腰围、舒张压、FBG、hs-CRP均明显升高(P<0.05),但是在肥胖伴AN组与肥胖无AN组间比较差异无统计学意义(P>0.05);腰臀比、收缩压、TG、FINS、HOMA-IR在肥胖伴AN组明显升高,高于对照组和肥胖无AN组(P<0.05)。MS的患病率在对照组、肥胖无AN组和肥胖伴AN组中依次升高,组间两两比较差异有统计学意义(P>0.05)。见表 1。
| 表 1 各组临床资料的比较 |
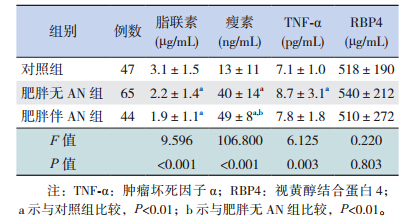
脂联素在肥胖无AN组和肥胖伴AN组均较对照组明显降低(P<0.01),尽管肥胖伴AN组较肥胖无AN组有所降低,但差异无统计学意义(P=0.374)。瘦素在肥胖伴AN患儿中明显升高,与肥胖无AN组、对照组比较差异均有统计学意义(P<0.01)。TNF-α在肥胖无AN患儿中略有升高,但与肥胖伴AN患儿比较差异无统计学意义(P>0.05)。RBP4在三组间比较差异无统计学意义(P>0.05)。见表 2。
| 表 2 三组脂肪因子的比较 |
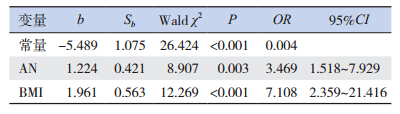
以MS为因变量,以年龄、性别、BMI、腰围、脂肪因子、AN为协变量进行逐步前进的多元logistic回归分析,各变量赋值如下:年龄>12岁=1,年龄≤12岁=0;男性 =1,女性 =0;BMI>25 kg/m2=1,BMI≤25 kg/m2=0;腰围>90 cm=1,腰围≤90 cm=0;脂联素≤2 μg/mL=1,脂联素>2 μg/mL=0;瘦素>40 ng/mL=1,瘦素≤40 ng/mL=0;TNF-α>8 pg/mL=1,TNF-α≤8 pg/mL=0;RBP4>500 μg/mL=1,RBP4≤500 μg/mL=0;伴AN=1,不伴AN=0。结果显示AN和BMI进入模型,说明AN和高BMI是MS的危险因素,见表 3。
| 表 3 MS 相关因素的 logistic 回归分析 |
根据最新的流行病学调查显示,在我国7~16岁城市中小学生中超重的患病率高达19.9%,而肥胖的患病率则高达8.9%,其中28.8%的肥胖儿童合并有MS[5]。随着儿童青少年肥胖发病率增加,所伴随的2型糖尿病、脂肪肝、动脉粥样硬化发病率相应增加,发病年龄提前,肥胖所造成的健康危害已不容忽视。早诊断、早干预能够预防这些严重并发症的发生发展[10-12]。
AN与胰岛素抵抗密切相关,是高胰岛素血症的一种可见体征[13-15]。在本研究中,肥胖合并AN的患儿相较于无AN的患儿胰岛素抵抗明显,血压、血糖、血脂均有升高倾向,同时MS的患病率增加。血脂联素水平在肥胖伴AN患儿中降低,瘦素在肥胖伴AN患儿中显著升高。通过logistic回归分析,显示AN和BMI是MS的独立危险因素。很多研究均证实AN患儿胰岛素分泌增多,多合并有糖脂代谢异常[16-18]。付晓辉等[4]发现肥胖伴AN患儿抵抗素的水平升高,而脂联素的水平下降,这些患儿胰岛素抵抗明显。Rafalson等[1]对12所中学1 438名学生筛查显示,AN组出现糖代谢异常的概率较对照组高出47%。与本研究的logistic回归结果相一致的是,Nsiah-Kumi等[19]发现同时筛查AN和超重,较单独筛查AN或BMI能提高诊断胰岛素抵抗的敏感性和特异性。本研究结果也证实AN是一种筛查儿童MS无创、易识别的体格检查。
AN的组织学特点主要是:(1)皮肤角质层过度角化,角质层厚度增加;(2)真皮-表皮连接处广泛的乳头形成;(3)黑色素细胞数目增多[20]。与临床表现一致,组织活检发现AN患者的皮肤成纤维细胞、血液中的红细胞、骨骼肌细胞胰岛素受体减少,胰岛素受体的自体磷酸化功能和酪氨酸激酶活性下降[21]。同时研究人员还发现葡萄糖转运体3(GLUT3)的蛋白水平较正常对照降低,尽管葡萄糖转运体4(GLUT4)的蛋白水平与对照组相比未见显著差异,但是GLUT4对胰岛素刺激后从胞浆至胞膜的转位则较对照下降了50%[22]。
脂肪因子失衡导致胰岛素抵抗,继而出现的高胰岛素血症是皮肤出现黑色棘皮样变的重要原因。在肥胖患者体内,抑炎的脂肪因子(如脂联素、SFRP5)与促炎的脂肪因子(如瘦素、TNF-α、抵抗素、RBP4)出现失衡:抑炎的脂肪因子减少,促炎的脂肪因子增加。这种异常将导致脂肪组织内炎性细胞增加,脂肪细胞脂解增强,游离脂肪酸释放入血,游离脂肪酸的脂毒性将导致胰岛素的靶器官对血糖的摄取减少,胰岛素敏感性下降,为维持血糖稳态,胰岛素分泌代偿性增多[2]。在高胰岛素血症时,胰岛素与胰岛素样生长因子受体相结合,后者所介导的信号通路将刺激表皮角质细胞、成纤维细胞增生,导致角质层角化过度[23]。有2型糖尿病患者因长期反复在下腹部同一部位注射胰岛素,造成下腹部的黑色棘皮样变,在更换胰岛素的注射部位后,该部位的皮损随之消失[24-25]。此外,亦有胰岛素瘤伴发AN的患者,在瘤体切除后,血胰岛素水平下降,AN随即减轻、消失[26]。这些证据均说明高胰岛素血症对皮肤黑色棘皮样变的关键作用。
脂肪因子一方面间接地通过胰岛素抵抗、高胰岛素血症参与AN的发病机制,另一方面也可能直接通过皮肤表皮细胞的脂肪因子受体引起AN。研究证实,瘦素可直接与瘦素受体作用,激活下游的JAK2,JAK2能够磷酸化STAT3,被激活的STAT3转位至细胞核,发挥生物学作用,促进角质细胞的增殖[27]。在本研究中观察到瘦素在AN患儿中显著升高,与其余两组比较差异显著。Atwa等[28]也观察到瘦素、抵抗素在肥胖伴AN的成人中升高,而脂联素则较对照组降低。这些临床研究和基础研究均支持异常升高的瘦素可能直接导致AN,而其他脂肪因子与AN的关系则需要进一步探讨。
综上,面对逐年增加的肥胖儿童,在临床工作中筛查AN,可协助识别高危患儿、诊断MS。AN的成因与高胰岛素血症、瘦素分泌异常密切相关,期待进一步的研究阐明AN与其他脂肪因子的关系。
| [1] | Rafalson L, Pham TH, Willi SM, et al. The association between acanthosis nigricans and dysglycemia in an ethnically diverse group of eighth grade students[J]. Obesity, 2013, 21(3): E328-E333. |
| [2] | Ouchi N, Parker JL, Lugus JJ, et al. Adipokines in inflammation and metabolic disease[J]. Nat Rev Immunol, 2011, 11(2): 85-97. |
| [3] | Rivera-Gonzalez G, Shook B, Horsley V. Adipocytes in skin health and disease[J]. Cold Spring Harb Perspect Med, 2014, 4(3): pii: a015271. |
| [4] | 付晓辉, 刘戈力, 姜丽红. 儿童单纯性肥胖伴黑色棘皮症与脂肪细胞活性因子的关系[J]. 实用儿科临床杂志, 2010, 25(20): 1559-1561. |
| [5] | 儿童代谢综合征中国工作组. 中国六城市学龄儿童代谢综合征流行现状研究[J]. 中华儿科杂志, 2013, 51(6): 409-413. |
| [6] | 中华医学会儿科学分会内分泌遗传代谢学组, 中华医学会儿科学分会心血管学组, 中华医学会儿科学分会儿童保健学组. 中国儿童青少年代谢综合征定义和防治建议[J]. 中华儿科杂志, 2012, 50(6): 420-422. |
| [7] | 中国肥胖问题工作组. 中国学龄儿童青少年超重、肥胖筛查体重指数值分类标准[J]. 中华流行病学杂志, 2004, 25(2): 97-102. |
| [8] | Stuart CA, Pate CJ, Peters EJ. Prevalence of acanthosis nigricans in an unselected population[J]. Am J Med, 1989, 87(3): 269-272. |
| [9] | Travers SH, Jeffers BW, Bloch CA, et al. Gender and Tanner stage differences in body composition and insulin sensitivity in early pubertal children[J]. J Clin Endocrinol Metab, 1995, 80(1): 172-178. |
| [10] | Farsani SF, Van der Aa MP, Van der Vorst MMJ, et al. Global trends in the incidence and prevalence of type 2 diabetes in children and adolescents: a systematic review and evaluation of methodological approaches[J]. Diabetologia, 2013, 56(7): 1471-1488. |
| [11] | Schober E, Waldhoer T, Rami B, et al. Incidence and time trend of type 1 and type 2 diabetes in Austrian children 1999-2007[J]. J Pediatr, 2009, 155(2): 190-193. |
| [12] | Weigensberg MJ, Goran MI. Type 2 diabetes in children and adolescents[J]. Lancet, 2009, 373(9677): 1743-1744. |
| [13] | Stuart CA, Gilkison CR, Smith MM, et al. Acanthosis nigricans as a risk factor for non-insulin dependent diabetes mellitus[J]. Clin Pediatr, 1998, 37(2): 73-79. |
| [14] | Drobac S, Brickman W, Smith T, et al. Evaluation of a type 2 diabetes screening protocol in an urban pediatric clinic[J]. Pediatrics, 2004, 114(1): 141-148. |
| [15] | Hearst MO, Laska MN, Himes JH, et al. The co-occurrence of obesity, elevated blood pressure, and acanthosis nigricans among American Indian school children: identifying individual heritage and environment-level correlates[J]. Am J Hum Biol, 2011, 23(3): 346-352. |
| [16] | 傅君芬, 梁黎, 董关萍, 等. 肥胖儿童伴良性黑棘皮病与胰岛素抵抗19例分析[J]. 中华儿科杂志, 2004, 42(12): 917-919. |
| [17] | 梁学军, 朱逞, 颜纯, 等. 肥胖伴黑色棘皮病儿童胰岛分泌功能的临床研究[J]. 中华儿科杂志, 2004, 42(6): 405-407. |
| [18] | 米热古丽·买买提, 徐永杰, 徐佩茹. 儿童良性黑棘皮病与代谢异常[J]. 中国当代儿科杂志, 2012, 14(8): 604-606. |
| [19] | Nsiah-Kumi PA, Beals J, Lasley S, et al. Body mass index percentile more sensitive than acanthosis nigricans for screening native American children for diabetes risk[J]. J Natl Med Assoc, 2010, 102(10): 944-949. |
| [20] | Matsuoka LY, Wortsman J, Goldman J. Acanthosis nigricans[J]. Clin Dermatol, 1993, 11(1): 21-25. |
| [21] | Stuart CA, Pietrzyk RA, Peters EJ, et al. Autophosphorylation of cultured skin fibroblast insulin-receptors from patients with severe insulin resistance and acanthosis nigricans[J]. Diabetes, 1989, 38(3): 328-332. |
| [22] | Stuart CA, Wen G, Williamson ME, et al. Altered GLUT1 and GLUT3 gene expression and subcellular redistribution of GLUT4: protein in muscle from patients with acanthosis nigricans and severe insulin resistance[J]. Metabolism, 2001, 50(7): 771-777. |
| [23] | Cruz PD, Hud JA. Excess insulin binding to insulin-like growth-factor receptors: proposed mechanism for acanthosis nigricans[J]. J Invest Dermatol, 1992, 98(6 Suppl): S82-S85. |
| [24] | Kudo-Watanuki S, Kurihara E, Yamamoto K, et al. Coexistence of insulin-derived amyloidosis and an overlying acanthosis nigricans-like lesion at the site of insulin injection[J]. Clin Exp Dermatol, 2013, 38(1): 25-29. |
| [25] | Buzasi K, Sapi Z, Jermendy G. Acanthosis nigricans as a local cutaneous side effect of repeated human insulin injections[J]. Diabetes Res Clin Pr, 2011, 94(2): E34-E36. |
| [26] | Ghosh S, Roychowdhury B, Mukhopadhyay S, et al. Clearance of acanthosis nigricans associated with insulinoma following surgical resection[J]. QJM-AN Int J Med, 2008, 101(11): 899-900. |
| [27] | Goren I, Pfeilschifter J, Frank S. Determination of leptin signaling pathways in human and murine keratinocytes[J]. Biochem Bioph Res Co, 2003, 303(4): 1080-1085. |
| [28] | Atwa M, Emara A, Balata M, et al. Serum leptin, adiponectin, and resistin among adult patients with acanthosis nigricans: correlations with insulin resistance and risk factors for cardiovascular disease[J]. Int J Dermatol, 2014, 53(10): e410-e420. |
 2015, Vol. 17
2015, Vol. 17