2. 湖北省新华医院神经科, 湖北 武汉 430000
吉兰-巴雷综合征(Guillain-Barré syndrome,GBS)是自身免疫性疾病,主要病理改变为周围神经系统的广泛性炎性脱髓鞘或轴索病变,可导致神经肌肉重度无力甚至死亡[1, 2]。儿童GBS初期的临床表现及病程的进展,与成人GBS的特征不太相同[3, 4],儿童GBS早期症状不明显容易被忽略,导致漏诊[5],神经电生理是诊断GBS的一项重要的辅助检查,但在疾病的早期诊断中仍有争议[6]。末端潜伏期延长,运动神经传递速度减慢,波形离散在GBS发病3周后常见[7, 8, 9]。
急性炎症性脱髓鞘性多发性神经根神经病(acute inflammatory demyelinating polyneuropathy,AIDP)是GBS中最常见类型,其早期病理改变以近端神经根轻度脱髓鞘损害为主,而F波和H反射潜伏期长,轻度的神经脱髓鞘有时并不能引起F波或H反射的改变。Erb点位于锁骨中点向上2~3 cm位置,它可以反映近段神经根功能,且操作简单无创。国内文献将Erb点刺激与F波进行对比,并认为在GBS初期阶段,其敏感性高于F波[10],但目前尚没有在儿童GBS中进行检测。本文将Erb点刺激在儿童AIDP检测中的作用与常规神经传导进行对比,并比较其敏感性。
1 资料与方法 1.1 研究对象选取2013年10月至2014年12月于武汉市儿童医院和湖北省新华医院门诊随诊或病房收治的GBS患儿32例为研究对象,其中男19例、女13例;年龄3~16岁,平均年龄6.8±2.7岁,平均身高123±22 cm。入组标准:(1)符合AIDP的诊断标准[11, 12];(2)起病1周以内行神经电生理检测。另选取同期同年龄段的30名健康儿童为对照组,男18例,女12例,平均年龄5.8±2.4岁,平均身高117±19 cm。两组性别、年龄、身高比较差异无统计学意义,具有可比性。该研究经过医院伦理委员会批准,并由所有入组儿童家长签署知情同意书。
1.2 AIDP诊断标准AIDP的诊断标准参考文献[11, 12]:(1)有前驱感染史,呈急性起病,进行性加重,多在2周左右达高峰;(2)对称性肢体和延髓支配肌肉、面部肌肉无力,重症者可有呼吸肌无力,四肢腱反射减低或消失;(3)可伴轻度感觉异常和自主神经功能障碍;(4)脑脊液可出现蛋白-细胞分离现象;(5)电生理检查提示远端运动神经传导潜伏期延长、传导速度减慢、F波异常、传导阻滞、异常波形离散等;(6)病程有自限性。
1.3 神经电生理检测应用丹麦 Dantec公司 keypoint 4道肌电图仪。操作由专业技术员按标准化方法完成。患儿放松卧位于安静、屏蔽的室内,室温20~22℃,肢体温度32~34℃。神经传导采用表面电极,所有患儿均行常规神经电生理检查,主要为上下肢运动和感觉神经传导测定:包括正中神经、尺神经、腓总神经和胫神经运动神经的传导速度(motor conduction velocity,MCV),末端运动传导潜伏期(distal motor latency,DML),复合肌肉动作电位(compound muscle action potential,CMAP)及正中神经、尺神经和腓肠神经感觉神经传导速度及波幅。特殊电生理检查:包括正中神经F波潜伏期,胫神经H反射,正中神经、尺神经Erb点刺激。主要记录正中神经F波潜伏期,胫神经H反射潜伏期,正中神经、尺神经运动神经传导。正中神经运动神经传递刺激点包括腕部、肘部、Erb点刺激,记录电极均为拇短展肌,尺神经运动神经传递刺激部位分别为腕部,肘部、Erb点刺激,记录电极均为小指展肌。H反射为刺激胫神经,在比目鱼肌记录。
1.4 结果判断根据30例对照组儿童结果,采用均数+2个标准差设定正中神经、尺神经Erb点刺激潜伏期上限,并结合美国约翰·霍普金斯医院实验室肌电图正常值作为结果判定标准,以文献[4, 13]为依据:3~16岁儿童神经传导参数以健康成人正常值进行比较。传导阻滞定义为周围神经近端与远端比较,CMAP负相波波幅下降30%以上,Erb点传导阻滞定义为近端较远端负相波波幅下降50%以上[10]。
1.5 统计学分析采用SPSS 11.0统计软件包对数据进行处理,计量资料以均数±标准差(x±s)表示,两组间比较采用独立样本t检验,P<0.05为差异有统计学意义。
2 结果 2.1 一般情况与临床特征32例患儿均符合AIDP诊断标准。9岁以下患儿24例,男15例,女9例,9~16岁患儿8例,男4例,女4例。肌无力为患儿主要首发症状,28例患儿均以此症状起病,10例患儿为四肢无力,8例患儿为双下肢无力,10例患儿为单侧无力。步态不稳患儿4例。23例患儿在发病前4周内有前驱感染病史,其中腹泻患儿5例,上呼吸道感染患儿18例。2周时行脑脊液检查,提示18例患儿蛋白细胞分离。5例患儿显示脊髓MRI异常,其中脊神经根强化3例,马尾强化2例。
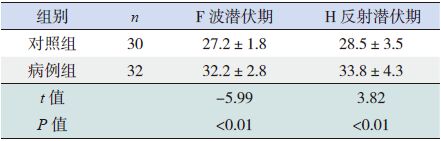
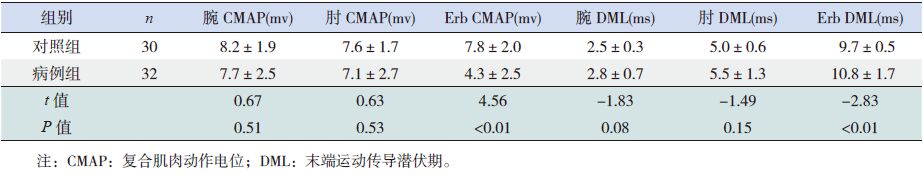
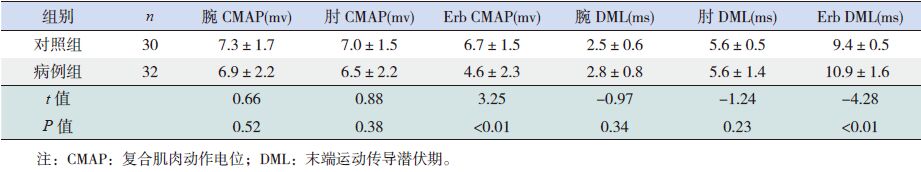
2.2 GBS患儿的神经电生理结果32例GBS患儿中,23例F波异常(72%),20例H反射异常(62%),病例组F波和H反射潜伏期均明显长于对照组(P<0.05)(表 1)。24例Erb点波幅异常(75%),22例Erb点潜伏期异常(69%),20例Erb点传导阻滞(62%),病例组尺神经、正中神经 Erb点CMAP均小于对照组,而DML均长于对照组(P<0.05);两组腕部和肘部的CMAP及DML差异无统计学意义(P>0.05)(表 2~3)。
| 表 1 两组正中神经F 波和H 反射潜伏期比较(x±s,ms) |
| 表 2 两组尺神经波幅和潜伏期比较(x±s) |
| 表 3 两组正中神经波幅和潜伏期比较(x±s) |
AIDP为儿童GBS中最常见类型,其病理改变为周围神经系统的广泛性炎性脱髓鞘,早期以近端神经根受累为重,神经电生理为其重要辅助检查,典型表现包括传导阻滞、DML延长,H反射和F波潜伏期延长,CMAP波幅下降,MCV减慢,可以合并感觉神经传导异常。F波是前角细胞逆向兴奋的回返放电,主要用于早期评价近段神经根的运动传导功能,由于它的传导是通过脊髓前角细胞和肌肉间整条神经进行,而在GBS的早期,神经脱髓鞘表现为斑片状,F波阳性率受影响。同时F波依赖于CMAP存在,当CMAP明显降低时,F波难以引出。H反射是电刺激诱发脊髓单突触反射,它是次强刺激胫后神经、诱发小腿三头肌反射性运动,其潜伏期与跟腱反射一样。它也可以反映近段神经根功能、但它记录方法需要特殊体位,一定刺激强度,特定神经选择,因而检测不易。
在本研究中,实验组F波和H反射均较对照组明显延长,符合AIDP最初病理改变以近段神经根为重。在病例组和对照组中,正中神经和尺神经Erb点波幅和潜伏期与对照组比较差异均有统计学意义,提示Erb点同样可以反映近段神经根功能。15例常规神经传导正常患儿中,3例仅可见到尺神经、正中神经Erb点刺激异常,提示疾病早期运用Erb点刺激可以提高诊断阳性率。
24例患儿 Erb点异常,而23例患儿F波潜伏期异常,Erb点异常例数稍高于F波,提示Erb点位于近段神经根,可以直接反映其功能状态,因而在此处刺激更容易获得近段神经根的信息[10],早期近段神经轻度脱髓鞘和潜伏期长均为影响F波阳性率因素。最近研究发现CIDP患者中行Erb点检测能够帮助诊断[14],在成人中应用Erb点检测GBS的早期检测作用也被证实[10]。
肥胖患儿中,Erb点刺激强度不仅达到最大(100 mA),刺激时限需要调节至0.5 ms。由于3岁以下GBS发病率小,患儿例数较少,因而3岁以下儿童还需要进一步扩大病例数证实实验结果,另外不足之处在于病例组和对照组仅进行正中神经F波检查,没有进行尺神经F波检查,可能会导致F波阳性率下降。另外不足之处在于AIDP仅为GBS中一种类型,Erb点刺激在其他类型GBS中是否有效需要扩大例数进一步研究分析。目前在GBS的早期诊断中,仍没有特异性强(100%)及敏感性高(100%)的检测方法,本研究中的Erb点检测结果并非在所有患儿中异常,因此寻找更有效的检测方法,提高早期GBS诊断的阳性率是我们以后工作研究的重点。总之,Erb点刺激在GBS早期诊断中有价值,且操作简单,可以作为一项常规检查应用于GBS早期诊断。
| [1] | 王晓慧, 邹丽萍, 吴沪生, 等. 儿童吉兰巴雷综合征电生理 检测及临床特征分析[J]. 中国实用儿科杂志, 2010, 25(6): 456-459. |
| [2] | 刘沉涛, 张国元, 王国丽, 等. 儿童急性运动轴索性多发性 神经病临床-电生理特征及预后[J]. 中国当代儿科学杂志, 2013, 15(3): 192-195. |
| [3] | Devos D, Maqot A, Perrier-Boeswillwald J, et al. Guillain-Barré syndrome during childhood: particular clinical and electrophysiological features[J]. MUSCLE & NERVE, 2013, 48(2): 247-251. |
| [4] | Lee JH, Sung IY, Rew IS. Clinical presentation and prognosis of child-hood Guillain-Barre syndrome[J]. J Paediatr Child Health, 2008, 44(7-8): 449-454. |
| [5] | Rosen BA. Guillain-Barre syndrome[J]. Pediatr Rev, 2012, 33(4): 164-170. |
| [6] | van Doorn PA, Ruts L, Jacobs BC. Clinical features, pathogenesis, and treatment of Guillain-Barre syndrome[J]. Lancet Neurol, 2008, 7(10): 939-950. |
| [7] | Temucin CM, Nurlu G. Measurement of motor root conduction time at the early stage of Guillain-Barre syndrome[J]. Eur J Neurol, 2011, 18(10): 1240-1245. |
| [8] | Mizuguchi K, Hoshino H, Abe Y, et al. Early and serial electrodiagnostic findings in childhood Guillain-Barre syndrome[J]. No To Hattatsu, 2008, 40(6): 460-464. |
| [9] | Alberti MA, Alentorn A, Martinez-Yelamos S, et al. Very early electrodiagnostic findings in Guillain-Barre syndrome[J]. J Peripher Nerv Syst, 2011, 16(2): 136-142. |
| [10] | Ye Y, Zhu D, Liu L, et al. Electrophysiological measurement at Erb's point during the early stage of Guillain-Barre syndrome[J]. J Clin Neurosci, 2014, 21(5): 786-789. |
| [11] | 崔丽英, 蒲传强, 胡学强. 中国吉兰-巴雷综合征诊治指南[J]. 中华神经科杂志, 2010, 43(8): 583-585. |
| [12] | Arcila-Londono X, Lewis RA. Guillain-barre syndrome[J]. Semin Neurol, 2012, 32(3): 179-186. |
| [13] | Pereon Y, Nguyen The Tich S, Fournier E, et al. Electrophysiological recording of deep tendon reflexes: normative data in children and in adults[J]. Neurophysiol Clin, 2004, 34(3-4): 131-139. |
| [14] | Rajabally YA, Jacob S. Proximal nerve conduction studies in chronic inflammatory demyelinating polyneuropathy[J]. Clin Neurophysiol, 2006, 117(9): 2079-2084. |
 2015, Vol. 17
2015, Vol. 17