2. 绍兴市中心医院 检验科, 浙江 绍兴 312030
刚地弓形虫(简称弓形虫,toxoplasma gondii)引起的弓形虫感染是人畜共患疾病。世界各地弓形虫感染率有很大差异,比如在西欧等有生吃小牛肉习惯的国家,人群发病率可达20%~40%,中国则多在10%以下[1]。国内有研究表明,有无接触宠物及吃羊肉串、火锅的人群,其感染弓形虫阳性率有差异[2]。虽然人感染弓形虫后通常为隐性感染,但是一旦患者免疫力低下,其可在人体内播散,主要侵犯脑、眼和淋巴结等[3]。孕妇和儿童罹患弓形虫感染,由于症状表现隐匿而不易察觉,易造成误诊,但是其对幼儿在各器官生长发育上危害深远,比如引起脑实质损害、智力发育障碍、脑膜炎、弓形虫眼病、精神神经症状如癫癎等。为了解因血清学诊断弓形虫抗体阳性的幼儿机体免疫功能情况,本文拟通过采用流式细胞技术对患儿外周血淋巴细胞相关亚群进行检测与分析,同时检测血清干扰素γ(interferon-γ,IFN-γ)水平,通过与正常健康幼儿对照组的检测值比较,来评估弓形虫感染患儿的机体细胞免疫功能状况,为儿科临床相关疾病的治疗提供参考。
1 资料与方法 1.1 一般资料选取2011年1月至2014年4月间在本院儿科就诊,因采用化学发光法定量检测TORCH出现弓形虫抗体TOX-IgM阳性而收住院的现症感染患儿34例为研究对象,其中男25例,女9例,平均年龄2.6±1.1岁。同时选取12例既往感染患儿为TOX-IgG阳性组,其中男8例,女4例,平均年龄2.9±1.2岁。另选取于本院儿科门诊行健康体检的健康儿童54例为对照组,其中男38例,女16例,平均年龄3.0±1.3岁。病例入选诊断依据为:(1)临床症状与体征:该病的症状和体征缺乏特异性,主要为轻至中度发热、皮疹(如斑丘疹)、淋巴结炎、呼吸系统症状(如肺炎、支气管炎)、神经症状(如头痛、头晕)和儿童多动症等。(2)实验室检测:为诊断弓形虫感染的主要诊断依据,主要是免疫学检查,从血清中检测出弓形虫抗体阳性。(3)所入选的患儿经临床检查及实验室诊断排除先天或继发性免疫缺陷病,以及排除结核、艾滋病等疾病。以上所有符合入选标准的研究对象均获得家长的知情同意。
1.2 化学发光微粒子免疫分析技术检测血清TOX-IgM和TOX-IgG水平各组受试对象均在清晨空腹状态下,采集2 mL静脉血于红色促凝剂管中,颠倒混匀并静置30 min,3 000 rpm离心5 min,分离血清用于检测。检测仪器为美国雅培ARCHITECT i2000SR全自动化学发光仪,仪器检测原理为化学发光微粒子免疫分析技术(CMIA)。TOX-IgM检测结果以Index值>0.60为阳性,TOX-IgG检测结果以>3.0 IU/mL为阳性。
1.3 流式细胞术检测全血淋巴细胞亚群各组受试对象均在清晨空腹状态下,采集2 mL静脉血于紫色EDTA-K2抗凝管中,充分颠倒混匀,在3 h内检测完成相关项目。全血标本处理严格按照淋巴细胞亚群流式细胞操作规程。仪器为美国BD FACS-Calibur全自动流式细胞仪,仪器及四色淋巴细胞亚群试剂均由美国BD公司生产,采用仪器自带淋巴细胞亚群自动软件做检测和分析,排除人为因素对细胞分析结果的影响。检测指标为CD3+、CD4+、CD8+、CD4+/CD8+比值、CD19+(B细胞)和CD16+CD56+(NK细胞)。
1.4 酶联免疫吸附试验检测血清IFN-γ 水平各组标本采集及处理方法同1.2小节。采用酶联免疫吸附试验(ELISA)检测人血清IFN-γ,试剂盒购自美国Endogen Inc公司,操作严格按照试剂盒说明书执行,用试剂盒自带标准品同步检测以制作标准曲线。使用美国伯乐BIO-RAD 680全自动酶标仪检测吸光度,根据吸光度结果在标准曲线上获取相应定量检测值。
1.5 统计学分析采用SPSS 18.0统计软件包对数据进行统计学处理。计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验;淋巴细胞各亚群相对值与INF-γ的相关性采用Pearson相关分析,P<0.05为差异有统计学意义。
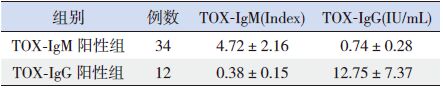
2 结果 2.1 两病例组患儿TOX-IgM和TOX-IgG阳性水平两病例组患儿TOX-IgM和TOX-IgG阳性水平情况见表 1,分别提示弓形虫感染和既往感染。
| 表 1 两病例组患儿TOX-IgM 和TOX-IgG 阳性水平情况(x±s) |
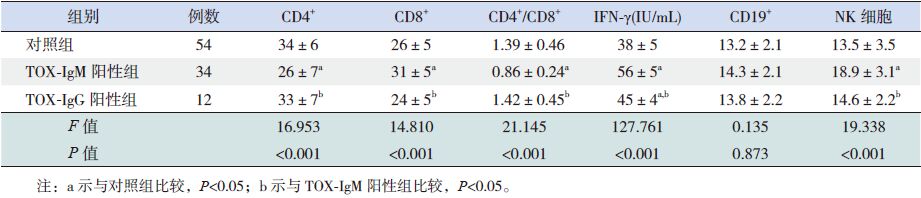
TOX-IgM阳性组CD4+、CD4+/CD8+比值均明显低于TOX-IgG阳性组和对照组(P<0.05);CD8+、NK细胞和IFN-γ水平均明显高于TOX-IgG阳性组和对照组(P<0.05);CD4+、CD8+、CD4+/CD8+比值、NK细胞水平在TOX-IgG阳性组和对照组之间差异无统计学意义(P>0.05),TOX-IgG阳性组IFN-γ水平高于对照组(P<0.05)。CD19+水平在各组间比较差异无统计学意义(P>0.05)。见表 2。
| 表 2 各组淋巴细胞亚群及血清IFN-γ 水平比较(x±s) |
TOX-IgM阳性组患儿CD4+、CD4+/CD8+比值、CD19+和NK细胞水平与IFN-γ均不存在相关性(均P>0.05),只有CD8+与IFN-γ呈正相关(r=0.756,P<0.05)。
3 讨论弓形虫是一种专性寄生于细胞内的机会性致病原虫,主要通过侵入宿主的单核-吞噬细胞系统在细胞内寄生。人体特别是孕妇和儿童感染弓形虫后,多表现为隐性感染,但是机体一旦免疫力低下,弓形虫在体内会随血液流动,到达全身各部位,主要侵犯眼、脑、心、肝和淋巴结等。由于幼儿器官、组织及机体免疫系统发育不完善,而且弓形虫感染后人体症状和体征都缺乏特异性,易造成误诊和漏诊。同时,弓形虫感染会导致机体免疫力下降,从而使患儿罹患各种相关疾病,影响患儿机体生长发育和成长。人体受弓形虫感染后,细胞免疫与病情的归转密切相关。参与细胞免疫的有T淋巴细胞、自然杀伤细胞和巨噬细胞等[4]。T淋巴细胞按其表面簇分化抗原(cluster of differentiation,CD)和功能不同主要分为CD4+ T细胞、CD8+ T细胞,它们均可通过免疫应答诱导炎症反应和分泌各种细胞因子而在抗弓形虫免疫中发挥着重要的作用。这两类细胞在体内抗感染中分泌的细胞因子有IL-2、IL-4、IL-5、IL-6、IL-10、IFN-γ等,其中主要分泌的细胞因子为IFN-γ[5]。此外作为机体固有免疫主要细胞的自然杀伤细胞(natural killer,NK)也是抗弓形虫感染的重要组成部分,NK细胞无需抗原预先致敏就可以直接杀伤靶细胞[6]。对病原体感染细胞具有自然细胞毒效应。
TOX-IgM阳性组CD4+相对值、CD4+/CD8+比值均明显低于其他两组,而CD8+相对值和IFN-γ均明显高于其他两组。辅助性T细胞是主要的CD4+ T细胞,其又分为Th1和Th2细胞,它们在人体免疫过程中互相调节和制约,正常情况下处于动态平衡。Th1/Th2的优势应答类型在多种疾病的发生、发展和归转中发挥着重要作用。在弓形虫感染后,动态平衡被打破,急性期以Th1细胞应答为主,可能因为弓形虫感染早期,Th1细胞诱导炎症反应的发生以便控制和清除弓形虫的感染,Th1细胞的主要作用是分泌细胞因子(如IL-2、IFN-γ等)活化巨噬细胞而在抗弓形虫感染中发挥重要作用;而急性期后以Th2细胞应答为主,因为免疫应答向Th2细胞偏移,Th2细胞对Th1细胞应答的抑制减轻了Th1应答介导的免疫病理损伤,有助于度过急性感染期[7],Th2细胞主要辅佐B细胞产生特异性抗体而杀灭弓形虫。病原体在感染过程中都会诱导机体产生免疫抑制状态,这是病原体逃避宿主免疫应答的适应性机制,也是机体为了避免因强烈的免疫应答损伤机体而产生的机制。有研究表明,弓形虫感染过程中,机体会产生免疫抑制,表现为脾淋巴细胞免疫应答的减弱,脾脏CD4+细胞暂时显著减少,从而对抗原刺激的增殖能力减弱[8]。Mandell等[9]的研究表明,弓形虫感染早期,CD4+ T细胞增多,CD4+/CD8+的比值增大,导致细胞因子生成增加,从而提高机体抗感染能力;也就是感染早期CD4+ T细胞增加,随着感染时间延长,CD4+ T细胞相对减少,而CD8+ T细胞逐渐上升。本研究中,TOX-IgM阳性组CD4+相对值低于其他两组,与国外相关研究一致[9]。因此弓形虫感染宿主CD4+ T细胞的降低说明在弓形虫病的机体免疫反应中可能是以细胞免疫为主的,人类作为天然易感宿主缺乏对弓形虫的天然免疫应答。CD8+ T细胞在接受抗原刺激后,分化、增殖形成效应CD8+ T细胞,还有一小部分成为记忆CD8+ T细胞,效应CD8+ T细胞寿命比较短,随着逐渐凋亡,最后只剩下记忆性T细胞[10],它们在抵抗包括弓形虫在内的病毒、细菌和原虫感染中发挥着重要的作用。急性期效应CD8+ T细胞通过分泌细胞因子如白介素、干扰素以及释放穿孔素作用于靶细胞表面介导杀伤作用,一旦急性感染被控制后,则进入由记忆性CD8+ T细胞起主要作用的慢性感染阶段[11]。当再次接触弓形虫相关抗原后,记忆性CD8+ T细胞便迅速分泌细胞因子IFN-γ、IL-2和穿孔素等,发挥效应功能。本研究中,TOX-IgM阳性组CD8+相对值明显高于其他两组,而CD4+/CD8+的比值明显低于对照组,与高冬梅等[12]的研究结果相关指标的趋势性一致,该研究提示,弓形虫感染组新生儿脐带血CD3+和CD4+比例均低于健康新生儿,而CD8+ T淋巴细胞比例高于健康新生儿。在以上相关指标的相对比例上,结果略有差异,可能是因为研究对象的年龄及检测标本不同,且使用仪器及标记抗体不尽相同,也可能与本研究的局限性如收集病例的时间跨度太长,未能按照感染时间分期检测相关指标有关,但是整体趋势一致。然而,如果患者机体免疫力低下,如受到病毒感染或免疫功能缺陷,会导致CD8+ T细胞失去其多功能性,表现为其增殖能力下降,分泌IL-2、IFN-γ能力减弱,从而引起CD8+ T细胞功能衰竭[13]。
NK细胞是机体重要的免疫细胞,其在机体内是执行固有免疫的主要细胞,是天然免疫的主要承担者。其在抗肿瘤、抗病毒感染和免疫调节中发挥着重要作用。NK细胞在某些细胞因子如IL-2的作用下被活化后可产生IFN-γ,而IFN-γ的分泌水平,与NK细胞的杀伤活性变化趋势完全一致。本实验中NK细胞值在TOX-IgM阳性组均明显高于TOX-IgG阳性组和对照组,这表明,弓形虫感染患儿机体内NK细胞水平的升高,积极的发挥着抗弓形虫感染的作用。对于NK细胞杀灭寄生虫的机制,李越等[14]的文献报道,NK细胞溶细胞颗粒中含有一种颗粒溶素(granulysin,GNLY),该物质是一种细胞毒颗粒蛋白,具有广谱的抗寄生虫效应,可协同穿孔蛋白一起杀伤细胞内病原菌。此外,NK细胞还通过Fas/FasL途径,TNF-α/TNF-R1途径等方式来执行其天然细胞免疫功能。
IFN-γ是由活化的Th1细胞、CD8+ T细胞和NK细胞等共同分泌的高活性、多功能细胞因子,被认为是抗弓形虫感染中主要细胞因子。IFN-γ抗弓形虫感染的机理主要是在感染急性期抑制弓形虫速殖子的增殖,在慢性期则是促进形成包囊,使其在体内长期存活。有研究表明,IFN-γ的升高,能使孕鼠子宫及胎盘内的虫体数明显减少,使活化巨噬细胞增多,明显增强其杀虫活性。IFN-γ还能增加CD8+ T细胞的细胞毒杀伤活性,表明IFN-γ对弓形虫感染有治疗作用[15]。本研究中,TOX-IgM阳性组血清IFN-γ水平要高于其他两组,这除了作为主要产生细胞的CD4+细胞诱导B细胞产生之外,还有CD8+ T细胞通过超抗原作用形式产生。但是人体免疫细胞及其功能相当复杂,所分泌的细胞因子种类繁多,不同的免疫细胞及细胞因子构成了复杂的微观网络系统。所以本文采用血清学水平检测IFN-γ来反映弓形虫感染状况,结果显示存在一定局限性,因为很多免疫细胞都可以直接或间接的分泌IFN-γ,所以后续研究我们准备基于流式细胞术标记荧光染色手段来检测相关淋巴细胞亚群细胞内IFN-γ分泌及释放情况。
本病的预后与虫株的毒力和被感染者感受性和免疫力有关。如果患儿机体免疫力低下,体现在细胞免疫上,CD4+、CD8+相对值降低,IFN-γ血清水平低下,则弓形虫感染会对患儿造成生长发育上巨大的损害。因此,通过检测相应指标来评估患儿免疫功能,及时调整治疗方案与用药,患儿获得及时治疗,预后多较好。淋巴细胞亚群及血清IFN-γ都是细胞免疫功能检测方面的指标,本文通过联合检测外周血淋巴细胞相关参数,如CD4+、CD8+、NK值,结合血清IFN-γ水平,可以作为简单、有效、快速辅助诊断弓形虫感染患儿机体免疫功能的客观指标,为临床治疗提供快速可靠的诊断依据。
| [1] | 姚天一, 张志坤. 弓形虫感染与围生儿预后[J]. 中国实用妇科和产科杂志, 2005, 2(6): 339-341. |
| [2] | 廖洪, 郭奕明, 徐龙, 等. 807 例住院儿童弓形虫感染调查分析[J]. 中国当代儿科杂志, 2002, 4(4): 291-293. |
| [3] | 彭鸿娟. 刚地弓形虫纳虫泡的形成机制及其作用[J]. 中国寄 生虫学及寄生虫病杂志, 2010, 28(5): 382-386. |
| [4] | Jankovic D, Kugler DG, Sher A, et al. IL-10 production by CD4+ effector T cell: a mechanism for self regulation[J]. Mucosal Immunol, 2010, 3(3): 239-246. |
| [5] | 杨生海, 殷宏, 刘永生, 等. 干扰素-γ 研究进展[J]. 生物技术通报, 2010, 8(1): 29-33. |
| [6] | 蒋灿华. NK 细胞抗肿瘤免疫效应机制研究进展[J]. 国外医 学肿瘤学分册, 2004, 31(7): 486-489. |
| [7] | 李永念, 包怀恩. BALB/c 小鼠感染弓形虫后Th1/Th2 免疫漂 移的实验研究[J]. 中国免疫学杂志, 2009, 3(25): 209-212. |
| [8] | Kim WH, Shin EH, Kim JL, et al. Suppression of CD4+ T-cells in the spleen of mice infection with toxoplasma gondii KI-I tachyzoites[J]. Korean J Parasitol, 2010, 48(4): 325-329. |
| [9] | Mandell GL, Bennett JE, Dolin R. Toxoplasma gondii[M]// Desmonts G. Principles and practice of infectious diseases. 5th ed. Beijing: Science Press, 2001: 2687. |
| [10] | Cui W, Kaech SM. Generation of effector CD8+ T cells and their conversion to memory T cells[J]. Immunol Rev, 2010, 236: 151-166. |
| [11] | Gigley JP, Bhadra R, Khan IA. CD8+ T cells and toxoplasma gondii: a new paradigm[J]. J Parasitol Res, 2011, 2011: 243796. |
| [12] | 高冬梅, 赵俊, 夏圆圆, 等. 弓形虫先天感染与妊娠结局及脐带血T 淋巴细胞亚群构成的关系[J]. 中华预防医学杂志, 2012, 46(1): 64-66. |
| [13] | Werry EJ. T cell exhaustion[J]. Nat Immunol, 2011, 12(6): 492-499. |
| [14] | 李越, 陈伟, 范雄林, 等. Granulysin 的研究进展[J]. 细胞与分子免疫学杂志, 2002, 18(5): 108-109. |
| [15] | Miller CM, Boulter NR, Ikin RJ, et al. The immunobiology of the innate response to toxoplasma gondii[J]. Int J Parasitol, 2009, 39(1): 23-39. |
 2015, Vol. 17
2015, Vol. 17