全球哮喘防治创议(GINA)[1]以及现行我国儿童哮喘防治指南[2]指出哮喘治疗目标为达到并维持哮喘控制,具体实施流程要求周期性监测控制水平,对长程阶梯式治疗方案进行升级或降级调整,最新的GINA更是强调了哮喘的异质性,对控制治疗疗效差异性也是哮喘异质性的表现之一,故个体化治疗是哮喘管理的发展趋势。但目前临床实践中对于儿童哮喘周期性监测和阶梯式治疗方案应用的总结资料较少,对长程规律治疗的患儿的哮喘控制水平实际波动性和影响因素的报道亦不足够。为了解哮喘患儿对长程阶梯治疗的总体反应性,本研究对相关临床随访资料进行总结,并对周期性监测的肺功能系列指标和气道炎症监测指标呼出气一氧化氮浓度(fractional nitric oxide concentration in exhaled breath,FeNO)进行分析,为合理实施哮喘长期个体化管理方案提供参考。
1 资料与方法 1.1 研究对象及分组采用病例登记研究方法,选取就诊于北京儿童医院的52例哮喘患儿(均合并过敏性鼻炎,不合并鼻窦炎)作为研究对象,其中男37例,女15例,年龄6.8~15.8岁,平均年龄10岁2个月。均符合儿童支气管哮喘诊断与防治指南中的诊断标准[2],接受并良好依从治疗及定期随诊共9个月。每隔3个月评估哮喘控制分级、进行肺功能测定和FeNO测定、记录控制类药物治疗剂量和疗程。至9个月随诊期时,根据患儿对哮喘控制治疗反应性分为稳定组和不稳定组。
如果在随诊中评估哮喘控制的系列结果显示持续维持控制,或逐渐达到并维持控制,只采用维持或降阶梯方案但未用升阶梯调整方案,该类型定义为治疗反应性稳定组;如果随诊中曾一度达到控制但是后期出现失控制(即未控制或部分控制)并需要采用升阶梯调整方案,该类型定义为治疗反应性不稳定组。
对哮喘阶梯式控制治疗反应表现为稳定者有30例(58%),平均年龄为10岁6个月,其中男20例,女10例;表现为不稳定者22例(42%),平均年龄为9岁10个月,其中男17例,女5例。
1.2 哮喘控制评估根据日间症状、夜间症状/憋醒、应急缓解药的使用、活动受限、肺功能和急性发作情况,对病例对象进行哮喘控制水平分级评估,每次随诊记录评估结果为控制、部分控制或未控制。
准确记录所有病例随诊期间阶梯式治疗方案的变化,根据儿童支气管哮喘诊断与防治指南[2]判定其治疗级别分属于长期治疗方案中1~4级的哪一级别。哮喘控制类药物类型包括孟鲁司特、布地奈德粉吸入剂、丙酸氟替卡松气雾剂、布地奈德福莫特罗粉吸入剂、沙美特罗替卡松吸入剂,对各病例9个月观察期内各控制类药物的单一化学成分(即孟鲁司特、布地奈德、氟替卡松、福莫特罗、沙美特罗)进行计算,获得其在9个月观察期内使用各哮喘控制类药物每日平均剂量。针对鼻炎的症状按需使用莫米松鼻喷剂1~3个月。
1.3 过敏原皮肤点刺试验采用德国Allergopharma变应原点刺液对患儿进行过敏原皮肤点刺试验(skin prick test,SPT),以组胺和生理盐水分别作为阳性和阴性对照[3, 4]。结果判定标准为:点刺部位的风团直径等于阴性对照风团反应的直径,定义为阴性反应;点刺部位皮肤出现粉红色风团,周围有红晕,定义为阳性反应。皮肤风团直径等于阳性对照风团反应直径的1/4 或1/2 倍,定为“+”或“2+”;风团反应直径与阳性对照组相等时定为“3+”;风团直径等于阳性对照风团反应直径的2 倍,定为“4+”。点刺液的变应原种类包括户尘螨、粉尘螨、干草尘埃、猫上皮、狗上皮、混合羽毛、交链孢霉、混合霉菌、混合树花粉I、混合树花粉Ⅱ、混和杂草花粉、艾蒿、豚草、藜科、禾本科/谷类等。
1.4 肺功能测定参照美国胸科协会(ATS)标准[5],采用德国JAEGER MasterScreen型肺功能仪,应用最大呼气流量-容积曲线方法测定的肺通气功能,参数包括第1秒用力呼气容积占预计值百分比(FEV1%)、第1秒用力呼气容积与用力肺活量比值(FEV1/FVC)、呼气峰流速占预计值百分比(PEF%)、最大呼气中期流速占预计值百分比(MMEF%)。
1.5 FeNO测定采用瑞典Aerocrine公司耐尔斯(NIOX)呼出一氧化氮测定系统提供的化学发光法进行检测。根据美国胸科学会/欧洲呼吸学会(ATS/ESR)的FeNO测定指南进行[6]。受试者保持安静状态10 min以上,检测前尽可能将肺内气体呼出至功能残气位后,用口含紧 NIOX滤器,快速吸气直至肺总量位置,然后以均匀气流将气体呼出,维持10 s左右,通过气流限速嘴使呼气流速恒定在50 mL/s,使呼出气达到一个稳定的平台期,保证流速的平台持续时间至少3 s,流速稳定在仪器限定的上下限范围内。系统自动完成测定和分析计算,测定结果以ppb(十亿分之一单位)表示。
1.6 统计学分析应用SPSS 17.0统计软件建立数据库,肺功能各项指标和FeNO平均变化率计算方法如下,以系列结果中肺功能各参数最高值和FeNO最低值作为基点,比较各时点相应参数与基点参数的变化率并计算平均变化率。非正态分布的计量资料用中位数(范围)表示,采用秩和检验比较组间差异;计数资料用例数和百分率表示,组间比较采用卡方检验。P<0.05表示差异有统计学意义。
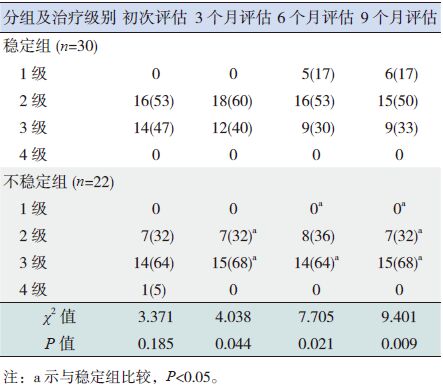
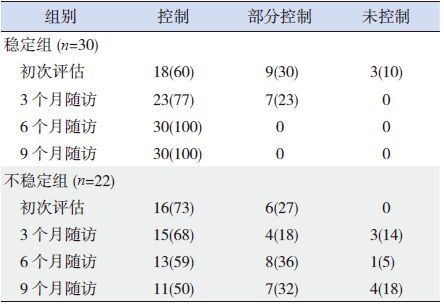
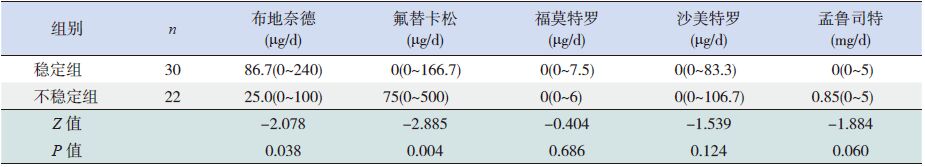
2 结果 2.1 两组间治疗级别、药物平均剂量和控制水平的比较初次评估时,稳定组与不稳定组之间治疗级别无差异;治疗3个月时稳定组采用2级治疗的比例显著高于不稳定组;治疗6个月时稳定组采用1级治疗的比例显著高于不稳定组;治疗9个月时稳定组采用1级、2级治疗的比例均显著高于不稳定组;治疗3、6、9个月时稳定组采用3级治疗的比例均显著低于不稳定组(P<0.05),见表 1。稳定组患儿随着随访时间的延长,维持控制的病例数不断增加,而不稳定组患儿哮喘控制水平分级中控制、部分控制和未控制病例数在各随访时点存在波动情况,见表 2。稳定组患儿平均每日使用布地奈德剂量显著高于不稳定组,而使用氟替卡松的剂量显著低于不稳定组(P<0.05),见表 3。
| 表 1 两组患儿在哮喘长期治疗方案中治疗级别的比较[n(%)] |
| 表 2 两组哮喘患儿的哮喘控制水平分级的分布[n(%)] |
| 表 3 两组患儿使用哮喘控制类药物每日平均加权剂量的比较[中位数(范围)] |
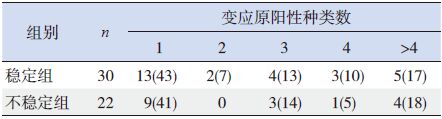
90%的稳定组哮喘患儿和77%的不稳定组哮喘患儿检出1种及以上变应原致敏。经统计学分析,两组病例在变应原阳性种类数差异无统计学意义(P>0.05),见表 4。
| 表 4 两组患儿变应原致敏种类数的分布比较[n(%)] |
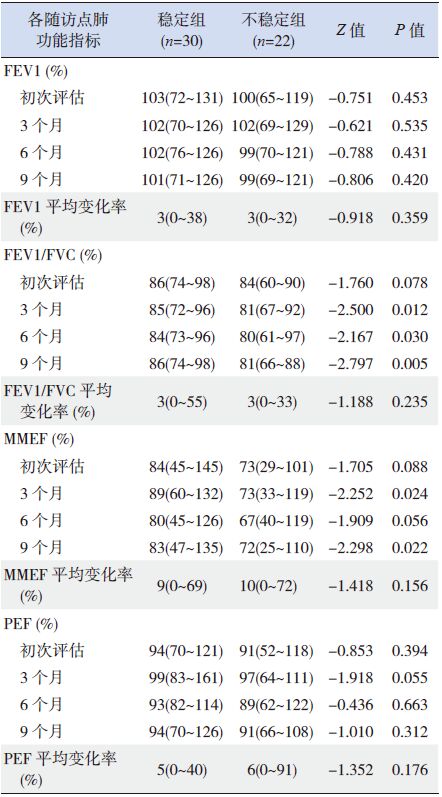
4次随访时点内肺功能指标FEV1%和PEF%在两组间的差异无统计学意义,但第3、6、9个月随访时点时稳定组FEV1/FVC显著高于不稳定组(P<0.05),在第3、9个月随访时点稳定组MMEF%显著高于不稳定组(P<0.05),两组患儿在各指标的平均变化率间均差异无统计学意义(P>0.05),见表 5。
| 表 5 两组患儿肺通气功能指标的比较[中位数(范围)] |
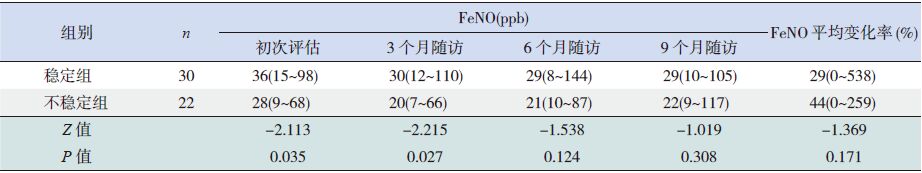
对稳定组和不稳定组患儿4次FeNO测定值进行分析,发现稳定组在初次评估和第3个月随访时点FeNO显著高于不稳定组(P<0.05),两组患儿在FeNO平均变化率间差异无统计学意义(P>0.05),见表 6。
| 表 6 两组患儿FeNO 的比较[中位数(范围)] |
哮喘长期治疗策略的目标是达到和维持哮喘控制,但因遵循指南程度低、治疗不足或依从性不佳原因所致的儿童哮喘不良控制率范围从11.1%~42%不等[7, 8]。本研究在严格遵循周期性控制评估、确保治疗依从性和定期调整阶梯治疗级别的原则基础上,发现本组病例中超过40%的哮喘儿童在为期9个月阶梯治疗疗程中控制水平易于波动,总体治疗级别和药物剂量偏高,相对于那些稳定维持控制的患儿,反映出不稳定性阶梯治疗反应的特点,提示为达到和维持更为长期的哮喘控制目标,还需要深入研究影响治疗反应性的个体差异因素,寻找更多有效治疗方案或管理策略。
影响哮喘治疗差异性的因素中需考虑患儿是否合并鼻炎或鼻窦炎。哮喘和鼻炎联系密切,合并过敏性鼻炎的哮喘患儿高达30%~70%[9, 10]。文献报道,合并过敏性鼻炎影响哮喘患儿的哮喘控制及缓解[11]。本研究中所纳入的哮喘患儿均合并过敏性鼻炎,因此应该考虑鼻炎对哮喘的影响,但最近有研究表明经莫米松等鼻喷激素治疗鼻炎后,鼻炎与哮喘的严重程度无明显相关[12]。本研究对患儿鼻炎症状均进行了按需鼻喷激素的治疗,可认为本研究中的鼻炎对哮喘的控制状态及治疗反应性影响不大。
本研究通过持续定期监测治疗进程中的肺功能变化,发现在4次随访时点中,第3、6、9个月随访时点时治疗反应性稳定组FEV1/FVC显著高于不稳定组,第3、9个月随访时点稳定组反映小气道通气功能的指标MMEF%显著高于不稳定组,提示FEV1/FVC和MMEF%与治疗反应性之间可能具有潜在相关性,对肺功能在哮喘评估中的应用价值值得进一步深入探讨。
肺功能是评估哮喘控制水平的重要指标,若仅根据病史及体格检查而没有肺功能评估,将会高估患者的哮喘控制情况[13]。但即便是以FEV1和PEF是否达到预计值80%以上作为正常判定标准时,也并非能在所有情况下敏感反映哮喘严重程度。无临床症状的哮喘患儿FEV1%多在正常范围[14],而Bacharier等[15]对219例哮喘患儿的研究结果表明,存在严重的持续哮喘症状时FEV1%仍可以大于80%。PEF%在哮喘患儿的长期管理中较为常用[16],但Mitra等[17]对64例哮喘患儿随访观察发现随访初期患儿存在哮喘症状但PEF%达90%以上,在随访过程中症状出现显著改善,而PEF%的变化却与症状变化率不一致。而在上述不同研究者的报道中,无症状哮喘患儿FEV1/FVC可能降低[14],FEV1/FVC随着哮喘严重程度的增加显著下降[15],可见FEV1/FVC在反映慢性气道炎症所致气流受限或气道阻塞方面的敏感性可能优于FEV1%。Simon等[16]对437例哮喘患儿各项肺功能指标与支气管扩张剂反应性等变量的相关性研究表明,MMEF%更易反映患儿对支气管扩张剂的反应性,在反映可逆性气流受限方面更为敏感。
本研究结果和其他研究者相关研究结果提示FEV1/FVC和MMEF%可能对于评估儿童气道阻塞性通气功能障碍更为敏感,定期监测FEV1/FVC和MMEF%可能对于早期发现对治疗反应不稳定性的患儿有益,对于此类患儿如何进行治疗方案和策略调整应深入研究。
近年来有研究者提出联合应用FeNO和肺功能指标来进行哮喘评估[18],这是基于FeNO作为哮喘气道慢性炎症标志物的基础而产生的。气道NO主要来自于上皮细胞[19],哮喘慢性气道炎症的存在造成诱导型一氧化氮合成酶(iNOS)增高[20, 21],从而引起FeNO增高[22],吸入糖皮质激素(ICS)可直接抑制iNOS的表达,使FeNO在短时间内迅速降低[23]。Szefler等[24]及Fritsch等[25] 均将FeNO测定作为评估哮喘控制的指标并指导调整治疗方案,与单纯应用传统评估控制调整治疗方案的对照组比较,发现两组患儿的哮喘症状、FEV1并无显著差异,但FeNO测定组患儿ICS用量显著高于对照组患儿。本研究结果表明,稳定组患儿在初次评估和第3个月随访时点FeNO显著高于不稳定组,这个现象似乎与稳定组的控制水平不符。但笔者认为治疗反应性稳定组的患儿的FeNO相对增高并非提示该组患儿气道炎症水平恶化,反而是由于治疗反应性不稳定的患儿使用更高级别抗炎治疗造成FeNO整体水平降低。由于FeNO的影响因素较为复杂,包括性别、年龄、身高、体重、致敏、药物治疗等[18, 26],因此如何更好地参考FeNO对气道炎症和哮喘控制水平进行综合评价,从而有效进行哮喘长期治疗管理,尚需深入的研究。
有研究显示,哮喘的病程亦影响哮喘控制治疗的反应性[27]。本研究样本量相对较少,某些数据未予充分采集,是本研究不足之处,故再做进一步研究时可分析哮喘病程对治疗疗效的影响。
既然对于现有的哮喘药物控制治疗方案的疗效仍存在不稳定性,可能需要切入新的治疗途径,比如过敏原特异性免疫治疗(specific immunotherapy,SIT)。变应原致敏是哮喘慢性气道炎症持续的重要因素之一,有研究者分析影响SIT疗效的因素时提出治疗前初始血清sIgE浓度高的患儿较浓度低的患儿可能更早达到临床控制[28]。但本研究治疗方案中未采用免疫治疗,结果中亦未发现治疗反应稳定组和不稳定组患儿之间在变应原致敏种类数方面的差异,77%的不稳定组患儿和90%的稳定组患儿均存在1种及以上变应原致敏,提示造成阶梯治疗反应性的差异尚不能完全归因于变应原致敏。
综上所述,在哮喘长期控制治疗及检测中,多于40%的患儿可出现哮喘失控制而需要重新采用升阶梯调整治疗方案,持续监测FEV1/FVC、MMEF%以及FeNO的变化有助于预测和评估哮喘患儿对控制治疗的反应性。
| [1] | Global Initiative for Asthma (GINA). Global strategy for asthma management and prevention. 2014(revision)[EB/OL]. URL: http://www.ginasthma.org. |
| [2] | 中华医学会儿科学分会呼吸学组. 儿童支气管哮喘诊断与防 治指南[J]. 中华儿科杂志, 2008, 46(10): 745-753. |
| [3] | Bozkurt B, Karakaya G, Kalyoncu AF. Seasonal rhinitis, clinical characteristics and risk factors for asthma[J]. Int Arch Allergy Immunol, 2005, 138(1): 73-79. |
| [4] | Homburger HA. Diagnosing allergic diseases in children. Practical recommendations for consulting pathologists[J]. Arch Pathol Lab Med, 2004, 128(9): 1028-1031. |
| [5] | Beydon N, Davis SD, Lombardi E, et al. An Official American Thoracic Society/European Respiratory Society Statement: Pulmonary Function Testing in Preschool Children [J]. Am J Respir Crit Care Med, 2007, 175(12): 1304-1345. |
| [6] | American Thoracic Society; European Respiratory Society. ATS/ERS recommendations for standardized procedures for the online and offline measurement of exhaled lower respiratory nitric oxide and nasal nitric oxide[J]. Am J Respir Crit Med, 2005, 171(8): 912-930. |
| [7] | 宋立强, 吴昌归, 孙秀珍, 等. 陕西省地区级城市哮喘患者 的控制现状及对疾病认知程度的调查[J]. 中国呼吸与危重监 护杂志, 2009, 8(4): 351-354. |
| [8] | Thompson PJ, Salvi S, Lin J, et al. Insights, attitudes and perceptions about asthma and its treatment: findings from a multinational survey of patients from 8 Asia-Pacific countries and Hong Kong[J]. Respirology, 2013, 18(6): 957-967. |
| [9] | 全国儿科哮喘协作组. 第三次中国城市儿童哮喘流行病学调 查[J]. 中华儿科杂志, 2013, 51(10): 729-735. |
| [10] | 赵京, 柏娟, 申昆玲, 等. 北京、重庆、广州三城市中心 城区0 -14 岁儿童过敏性疾病问卷调查[J]. 中华儿科杂志, 2011, 49(10): 740-744. |
| [11] | de Groot EP, Nijkamp A, Duiverman EJ, et al. Allergic rhinitis is associated with poor asthma control in children with asthma[J]. Thorax, 2012, 67(7): 582-587. |
| [12] | Deliu M, Belgrave D, Simpson A, et al. Impact of rhinitis on asthma severity in school-age children[J]. Allergy, 2014, 69(11): 1515-1521. |
| [13] | Nair SJ, Daigle KL, DeCuir P, et al. The influence of pulmonary function testing on the management of asthma in children[J]. J Pediatr, 2005, 147(6): 797-801 |
| [14] | Beydon N. Pulmonary function testing in young children [J]. Paediatr Respir Rev, 2009, 10(4): 208-213. |
| [15] | Bacharier LB, Strunk RC, Mauger D, et al. Classifying asthma severity in children: mismatch between symptoms, medication use, and lung function [J]. Am J Respir Crit Care Med, 2004, 170(4): 426-432. |
| [16] | Simon MR, Chinchilli VM, Phillips BR, et al. Forced expiratory flow between 25% and 75% of vital capacity and FEV1/forced vital capacity ratio in relation to clinical and physiological parameters in asthmatic children with normal FEV1 values [J]. J Allergy Clin Immunol, 2010, 126(3): 527-534. |
| [17] | Mitra AD, Ogston S, Crighton A, et al. Lung function and asthma symptoms in children: relationships and response to treatment[J]. Acta Paediatr, 2002, 91(7): 789-792. |
| [18] | Yao TC, Ou LS, Lee WI, et al. Exhaled nitric oxide discriminates children with and without allergic sensitization in a populationbased study[J]. Clin Exp Allergy, 2011, 41(4): 556-564. |
| [19] | Yamamoto M, Tochino Y, Chibana K, et al. Nitric oxide and related enzymes in asthma: relation to severity, enzyme function and inflammation[J]. Clin Exp Allergy, 2012, 42(5): 760-768. |
| [20] | Benson RC, Hardy KA, Morris CR. Arginase and arginine dysregulation in asthma[J]. J Allergy, 2011, 2011: 736319. |
| [21] | Kercsmar C. Exhaled nitric oxide in the diagnosis and management of childhood asthma[J]. Ther Adv Respir Dis, 2010, 4(2): 71-82. |
| [22] | Prado CM, Yano L, Rocha G, et al. Effects of inducible nitric oxide synthase inhibition in bronchial vascular remodelinginduced by chronic allergic pulmonary inflammation [J]. Exp Lung Res, 2011, 37(5): 259-268. |
| [23] | Franklin PJ, Stick SM. The value of FeNO measurement in asthma management the motion against FeNO to help manage childhood asthma-reality bites[J]. Paediatr Respir Rev, 2008, 9(2): 122-126. |
| [24] | Szefler SJ, Mitchell H, Sorkness CA, et al. Management of asthma based on exhaled nitric oxide in addition to guidelinebased treatment for inner-city adolescents and young adults: a randomised controlled trial[J]. Lancet, 2008, 372(9643): 1065-1072. |
| [25] | Fritsch M, Uxa S, Horak F Jr, et al. Exhaled nitric oxide in the management of childhood asthma: a prospective 6-months study[J]. Pediatr Pulmonol, 2006, 41(9): 855-862. |
| [26] | Spanier AJ, Hornung RW, Kahn RS, et al. Seasonal variation and environmental predictors of exhaled nitric oxide in children with asthma [J]. Pediatr Pulmonol, 2008, 43(6): 576-583. |
| [27] | Busse WW, Pedersen S, Pauwels RA, et al. START Investigators Group. The Inhaled Steroid Treatment As Regular Therapy in Early Asthma (START) study 5-year follow-up: effectiveness of early intervention with budesonide in mild persistent asthma[J]. J Allergy Clin Immunol, 2008,121(5): 1167-1174. |
| [28] | 刘靖, 张晓波, 冯海燕, 等. 影响儿童哮喘尘螨特异性免疫疗效的因素分析[J]. 中国当代儿科杂志, 2013, 15(10): 854-859. |
 2015, Vol. 17
2015, Vol. 17