肺炎链球菌(Streptococcus pneumoniae,SP)属人体上呼吸道正常菌群,可定植于正常人(尤其是儿童)的鼻咽部,可侵入中耳、鼻窦、气管支气管、肺部等诱发黏膜感染性疾病,也可侵入血液、胸腔、腹腔、骨髓、脑组织等无菌部位,从而导致侵袭性SP性疾病的发生,严重时可以引发儿童细菌性脑膜炎。根据2005 年WHO 的统计数据,全球每年约有160万人死于SP 感染,其中70~100万人为5 岁以下儿童。SP已成为导致婴幼儿脑膜炎、菌血症等严重疾病的首位病原菌[1]。非发达国家细菌性脑膜炎患儿的病死率为12%~15%,25%~50%的存活者留有后遗症[2, 3]。儿童的SP 感染已成为世界范围内严重的公共卫生问题,而近年由于抗菌药物的广泛以及可能存在的不合理使用,SP的耐药性问题也日益突出,耐药菌株的出现也给临床治疗带来挑战。本研究回顾性分析我院2008年9月至2014年3月儿科收治的SP脑膜炎患儿的临床特征及耐药情况,以期给临床医生的早期诊治提供依据。 1 资料与方法 1.1 研究对象
选取2008年6月至2014年3月间于四川大学华西第二医院收治的确诊为SP脑膜炎的患儿 14例为研究对象,其中男8例,女6例;<2岁8例,2~5岁3例,>5岁3例。所有患儿脑脊液培养均分离出SP单一菌株,SP脑膜炎诊断依据《诸福棠实用儿科学》第7版为诊断标准[4]。 1.2 菌株分离
纳入病例于入院后48 h 内、抗菌药物使用前取脑脊液标本立即送微生物室进行培养检测,无菌操作取标本1~3 mL注射于BD公司的儿童血培养瓶,血培养瓶放置于BD公司的FX全自动连续监测血培养仪中进行孵育,报阳后转种于5%哥伦比亚血平板,5%CO2、35℃恒温箱培养18~24 h,血平板购自广州迪景微生物科技有限公司。 1.3 菌株鉴定
24 h后哥伦比亚血平板上形成细小、圆形、表面光滑扁平、中心凹陷呈脐状、周围有明显草绿色溶血环的菌落,挑选血平板上的可疑菌落进一步分纯,采用革兰染色、奥普托欣(Optochin)及胆盐溶菌试验鉴定SP,进而采用VITEK 2全自动微生物分析仪GP鉴定卡进行菌种鉴定。 1.4 药敏试验
药敏试验使用ATB STREP 5药敏试剂盒(梅里埃,法国)测定其MIC值。严格按照说明书操作,药敏结果判断标准参照CLSI(2013版)标准。SP质控菌株ATCC 49619购自卫生部临检中心。 2 结果 2.1 临床表现
14例患儿就诊时间为发病后5 h~30 d,平均就诊时间为8 d。其中首次就诊在病程3 d 以内者5例(36%)。10例(71%)患儿有前驱感染,其中2例有颅脑外伤史,5例有呼吸系统症状,1例有耳外伤史,2例为外耳道炎。 14例患儿均有高热(T>38.5℃),其中13例(93%)患儿体温高于39℃;9例(64%)患儿出现全身性抽搐;10例(71%)患儿在病程中有意识障碍;8例(57%)患儿发生昏迷;5例(36%)患儿出现脑膜刺激征;12例(86%)患儿出现呕吐,其中4例为喷射性呕吐;7例(50%)患儿合并败血症。 14例患儿中有2例为再发性脑膜炎,其中1例既往查出病原菌为SP,1例既往脑脊液培养结果阴性。2例患儿均为男性,年龄分别为11岁8个月和1岁10个月,复发时间分别为2年和1个月。 2.2 辅助检查结果
患儿的白细胞均数为18×109/L,其中11例(79%,11/14)患儿白细胞增高,最高达53.9×109/L;所有患儿的白细胞分类均以中性粒细胞为主;71%(10/14)患儿CRP增高,其中80%(8/10)CRP>80 mg/L,最高达396 mg/L。脑脊液检查方面,64%(9/14)患儿脑脊液蛋白定量结果增高,均>1 000 mg/dL,最高者2733 mg/dL;71%(10/14)患儿脑脊液糖含量降低,最低者0.1 mmol/L;脑脊液氯化物多轻度降低,所有患儿脑脊液有核细胞计数增高,分类均以中性粒细胞为主,50%(7/14)患儿有核细胞计数>500×106/L,最高者为3200×106/L。 2.3 SP耐药性分析
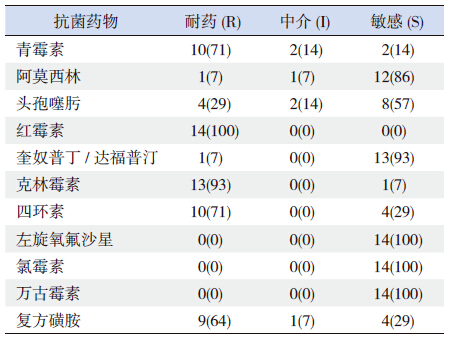
对分离出的14株SP菌株进行耐药性分析,结果显示SP对β-内酰胺类抗菌药物的耐药情况十分严重,对青霉素的不敏感率(耐药+中介)已达到86%,同时,对头孢噻肟的不敏感率也达到了43%。分离菌株对红霉素、克林霉素等大环内酯类抗菌药物的耐药率也非常高(>90%)。未分离出对左旋氧氟沙星、氯霉素及万古霉素耐药的菌株(表 1)。对3 类以上抗菌药物耐药的多重耐药SP菌株有11 株(79%)。
| 表1 14例患儿脑脊液培养的SP对11种抗菌药物的耐药性分析 |
14例患儿均于我院进行抗SP感染治疗,其中7例患儿使用三代头孢治疗,5例患儿使用三代头孢和万古霉素联合治疗,1例患儿先使用万古霉素和三代头孢联合治疗,后由于过敏,改为美罗培南继续治疗,1例患儿先使用万古霉素和三代头孢联合治疗,由于治疗效果不好,改为氯霉素和万古霉素联合治疗,最后治愈出院。患儿住院时间为2~44 d,平均住院时间为17.5 d。14例患儿自抗SP感染治疗起随访30 d,10例患儿治愈(临床症状消失,脑脊液培养阴性,不伴有神经系统后遗症),2例患儿好转伴神经系统后遗症(1例出现头痛,智力改变,1例出现脑瘫),2例患儿死亡(1例死于弥漫性血管内凝血,1例死于感染性休克)。 3 讨论
SP是常见的儿童鼻咽部定植细菌,SP在健康儿童鼻咽部的携带率约为20%~40%。定植于鼻咽部的SP可经血液播散等途径引起化脓性脑膜炎等侵袭性肺炎链球菌病[5]。SP是我国细菌性脑膜炎的常见病原菌之一,也是导致患者神经系统后遗症的主要病原菌。虽然目前细菌性脑膜炎患儿的整体预后有了明显改善,但SP引起的脑膜炎仍有着较高的发病率(20%~30%)和病死率(10%)[6]。
本研究纳入病例57%患儿为2岁以下儿童。有研究认为2岁以下婴幼儿为SP脑膜炎的好发年龄[7]。该年龄段儿童的易感性可能与其机体免疫状态、血脑屏障的发育以及生活环境等有关,在该年龄段使用SP疫苗可能可降低SP脑膜炎的发生率[8]。
儿童SP脑膜炎早期可表现为发热、呕吐、精神差,随病情进展可能出现抽搐、意识障碍甚至昏迷。本研究中93%的患儿有高热、抽搐,86%的患儿血象改变检查符合细菌性感染。所有患儿的脑脊液检查均符合细菌性脑膜炎的改变,故包括血常规、脑脊液常规在内的相关实验室检查结果,有助于化脓性脑膜炎的早期诊断,但对于区分SP脑膜炎和其他病原菌引起的脑膜炎,尚无特异性指标。本组病例中有2例死亡,病死率为14%,1例死亡患儿年龄为7岁,由外院转入,在外院经验性使用三代头孢治疗,但我院药敏结果显示三代头孢中介,在我院虽改为万古霉素和三代头孢联合治疗,但最后仍治疗无效死于弥漫性血管内凝血;另1例死亡患儿年龄为11岁8个月,为再发性的SP脑膜炎,上次脑脊液培养出SP菌株为两年前,入我院后先使用三代头孢经验性治疗,后药敏结果显示三代头孢耐药,改为万古霉素和三代头孢联合治疗,但由于病情进展迅速,死于感染性休克。2例(14%)患儿留有后遗症,符合相关文献报道的比例[6]。经积极、正确的治疗后多数患儿可痊愈。及时、正确的治疗对于改善SP脑膜炎患儿的预后至关重要。
本研究结果显示,我院住院患儿脑脊液分离的SP对青霉素的耐药情况十分严重,对青霉素的不敏感率已达到86%,明显高于国内外分离菌株对青霉素的耐药率 [9, 10]。同时,分离菌株对临床常用于治疗化脓性脑膜炎的β-内酰胺类抗菌药物头孢噻肟的不敏感率也达到了43%,明显高于国外报道结果[6],提示SP菌株对β-内酰胺类抗菌药物耐药情况已经很严重,可能与β-内酰胺类抗菌药物在临床广泛应用有关。
分离菌株对红霉素、克林霉素等大环内酯类抗菌药物的耐药率也非常高(>90%)。与国内上海(94.3% )、苏州(94.74% )、杭州(92.3% )、温州(94%)、沈阳(97.78%)、台湾(92.1%)相似[11, 12, 13, 14, 15],提示我国SP菌株对大环内酯类药物耐药已经很广泛,而导致大环内酯类药物广泛耐药的原因可能是大环内酯类药物的广泛使用和耐药克隆菌株广泛传播。
本研究未分离出对左旋氧氟沙星、氯霉素及万古霉素耐药菌株。但左旋氧氟沙星一般不用于儿童患者,而氯霉素由于其严重的副作用而很少用于儿科临床。万古霉素由于其在脑脊液中的药物浓度不高而被认为并非是治疗化脓性脑膜炎的最佳手段。
同时,本研究发现多重耐药(对3类以上抗菌药物耐药)的SP菌株有11株(79%),明显高于ANSORP 报道的亚洲地区平均水平(59.3%)[16],略低于国内多个城市如上海(94.3%)[13]、台湾(92.1%)[15],提示SP多重耐药在我国已经广泛存在,值得引起重视。
鉴于本研究中敏感的抗菌药物不适合用于儿童SP脑膜炎治疗,而大环内酯类和β-内酰胺类抗菌药物的耐药性已经很高,已不适合单用来治疗SP脑膜炎,而万古霉素虽然未发现耐药菌株,但脑脊液药物浓度较低,故本研究中对三代头孢不敏感的患儿治疗方案为万古霉素与三代头孢联合治疗,大部分患儿治疗效果良好。有学者建议将β-内酰胺类和大环内酯类抗菌药物合用治疗严重SP感染[17],该方案有待临床医生进一步探索验证。
综上,目前SP感染已成为全球一个重要的公共卫生问题,已经严重威胁我国儿童健康。所有对SP脑膜炎患儿进行早期积极、正确的治疗对其改善和预后非常重要。本研究中脑脊液分离的SP菌株对临床多种常用抗菌药物耐药相当严重,这些菌株引起的感染给临床治疗带来严峻挑战。目前在临床合理使用抗菌药物的基础上监测SP的耐药情况,并开展相关的耐药性研究,为儿科经验性选择抗菌药物提供可靠依据具有非常重要的意义。
| [1] | WHO. Pneumococoal conjugate vaccine for childhood immunization—WHO position paper[J]. Wkly Epidemiol Rec, 2007, 82(12): 93-104. |
| [2] | Mathers CD, Lopez AD, Murray CJL. The burden of disease and mortality by condition: Data, methods and results for 2001[M]//Lopez AD, Mathers CD, Ezzati M, et al. Global burden of disease and risk factors. United States: Oxford University Press, 2006: 45-270. |
| [3] | Molyneux E, Riordan FA, Walsh A. Acute bacterial meningitis in children presenting to the Royal Liverpool Children's Hospital, Liverpool, UK and the Queen Elizabeth Central Hospital in the Blantyre, Malawi: a world of difference[J]. Ann Trop Paediatr, 2006, 26(1): 29-37. |
| [4] | 胡亚美, 江载芳. 诸福棠实用儿科学[M]. 第7版. 北京: 人民卫生出版社, 2002: 921-922. |
| [5] | Lynch JP, Zhanel GG. Streptococcus pneumoniae: epidemiology and risk factors, evolution of antimicrobial resistance, and impact of vaccines[J]. Curr Opin Pulm Med, 2010, 16(3): 217-225. |
| [6] | Brautest LV, Heiby EA, Syvenrsen G, et al. Invasive pneumoccal disease in children in Oslo 1998-2004[J]. Tidsskr Nor Laegeforen, 2008, 128 (12): 1380-1383. |
| [7] | 苏小燕, 温顺航, 林立, 等. 儿童肺炎链球菌败血症的临床特点及药敏分析[J]. 中国当代儿科杂志, 2013, 15(11): 995-999. |
| [8] | Dagan R. Use of pneumococcal conjugate vaccine to decrease rates of bacterial meningitis[J]. Clin Infect Dis, 2008, 46(11): 1673-1676. |
| [9] | Abdinia B, Ahangarzadeh Rezaee M, Abdoli Oskouie S. Etiology and antimicrobial resistance patterns of acute bacterial meningitis in children: a 10-year referral hospital-based study in northwest iran[J]. Iran Red Crescent Med J, 2014, 16(7): e17616. |
| [10] | 廉荣镇, 肖能. 脑膜炎患儿脑脊液中肺炎链球菌的耐药性初步分析[J]. 当代医学, 2011, 17(3): 138-139. |
| [11] | 刘素云, 董琳, 杨锦红. 儿童侵袭性肺炎链球菌病的临床特征及耐药性分析[J]. 中华儿科杂志, 2010, 48(2): 95-99. |
| [12] | 王曼丽, 严永东, 黄莉, 等. 侵袭性肺炎链球菌感染38例临床特征与药敏分析[J]. 中国实用儿科杂志, 2012, 27(8): 604-607. |
| [13] | 徐丽慧, 王贤军, 方美玉, 等. 肺炎链球菌大环内酯药物耐药性及耐药基因erm、mef的检测[J]. 中华传染病杂志, 2010, 28(3): 174-177. |
| [14] | 熊小雨, 刘春峰, 孙继梅, 等. 5 岁以下儿童侵袭性肺炎链球菌病的临床特点与耐药性分析[J]. 中国小儿急救医学, 2012, 19(6): 599-602. |
| [15] | Tsai HY, Lauderdale TL, Wang JT, et al. Updated antibiotic resistance and clinical spectrum of infections caused by Streptococcus pneumoniae in Taiwan: emphasis on risk factors for penicillin nonsusceptibilities[J]. J Microbiol ImmunolInfect, 2013, 46(5): 345-351. |
| [16] | Kim SH, Song JH, Chung DR, et al. Changing trends in antimicrobial resistance and serotypes of Streptococcus pneumonia isolates in Asian countries: an Asian Network for Surveillance of Resistant Pathogens (ANSORP) study[J]. Antimicrob Agents Chemother, 2012, 56(3): 1418-1426. |
| [17] | Van Bambeke F1, Reinert RR, Appelbaum PC, et al. Multidrug-resistant Streptococcus pneumoniae infections: current and future therapeutic options[J]. Drugs, 2007, 67(16): 2355-2382. |
 2015, Vol. 17
2015, Vol. 17