2. 重庆医科大学附属儿童医院神经内科/儿童发育疾病研究教育部重点实验室/儿科学重庆市重点实验室/重庆市儿童发育重大疾病诊治与预防国际科技合作基地, 重庆 400016
化脓性脑膜炎(purulent meningitis,PM)是由细菌感染引起的大脑或(及)脊髓周围炎症,为一种严重且有生命危险的常见小儿中枢神经系统疾病,为婴儿及儿童死亡的重要死因之一[1],惊厥、颅内高压、脑膜刺激征为主要临床表现。在发达国家PM的发病率为0.2‰~1‰[2-3],发展中国家为0.8‰~6.1‰[3],病死率约10%[4],后遗症发生率达10%~30%[2,4,5],包括继发性癫癎、听力损害、瘫痪、学习或活动力丧失,严重影响患儿生活质量,且有研究显示即使治愈的PM患儿也可能存在延迟血管炎的发生,形成脑梗死或血栓[6,7。因此早期识别、及时诊断PM及其并发症,给予合适治疗,减少后遗症的发生,有效随访,对于降低PM病死率及提高患儿生活质量有重要意义。本研究总结了我院儿童PM的临床特点及随访结果,有利于指导其合理诊疗。现报道如下。 1 资料与方法 1.1 研究对象
2007~2012年间入住重庆医科大学附属儿童医院神经内科明确诊断为PM或不典型PM[8]的 317例患儿纳入本研究,包括男199例,女118例,年龄1个月至15岁,其中 < 3个月102例(32.3%),3个月~ 96例(30.3%),1岁~ 16例(4.7%),3岁~ 39例(12.4%),7~15岁64例(20.3%)。由脑膜炎奈瑟菌引起的PM因其具有传染性,入住我院感染科,因此未纳入本研究。 1.2 统计数据内容 病例统计数据内容包括患儿的流行病学、发病诱因、临床表现、并发症及后遗症、临床用药史及出院后随访结果。 1.3 统计学分析 使用SPSS 17.0统计软件对病例相关数据进行分析。计数资料用例数和百分比表示,组间比较采用卡方检验或Fisher精确检验;多因素影响分析采用非条件多因素logistic回归分析法。P < 0.05示差异有统计学意义。 2 结果 2.1 临床特征
(1)发病诱因:呼吸道感染171例(53.9%),消化道感染41例(12.9%),中耳炎或内耳畸形16例(5.1%),脑外伤或脑脊液漏10例(3.2%),皮肤或软组织破损或感染6例(1.9%),其余不详。
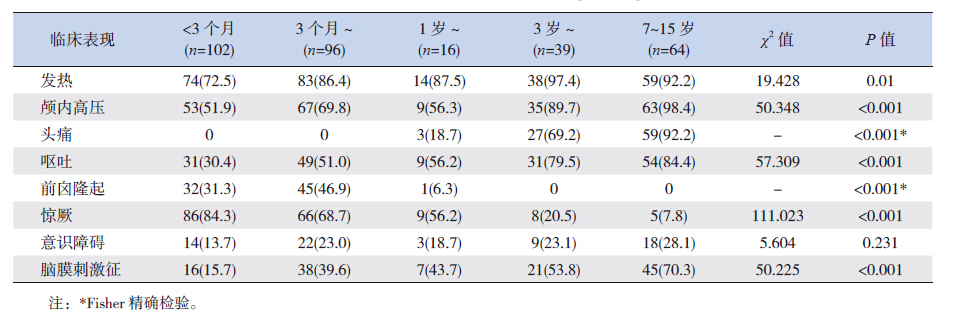
(2)临床表现:发热268例(84.5%),颅内高压,包括头痛、呕吐、前囟隆起共227例(71.6%),惊厥174例(54.9%),意识障碍 69例(21.8%),脑膜刺激征128例(40.4%)。对不同年龄组临床表现构成进行卡方检验,结果显示 < 3月龄病例易发生惊厥,3岁以上病例头痛、呕吐、颅内高压等发生率较3岁以下高。
| 表1 各年龄段患儿临床表现分布 |
107例(33.7%)出现并发症,包括硬膜下积液95例(29.9%),脑积水14例(4.4%),脑室管膜炎4例(1.6%),颅内出血5例,感染性休克1例,脑脓肿1例,关节炎1例。住院期间已出现的后遗症有61例(19.2%),包括继发性癫癎46例(14.5%),瘫痪22例(6.9%),听力损害16例(5.1%)。有49例合并两种及以上并发症和(或)后遗症。
对于硬膜下积液的诊断及治疗统计分析显示,95例硬膜下积液病例中,73例通过头颅影像学诊断,包括CT或MRI,22例头颅影像学未提示而直接通过硬膜下穿刺诊断。68例行硬膜下穿刺,其中42例(62%)于穿刺后3 d内体温恢复正常,20例(29%)于穿刺后5 d内体温恢复正常,6例(9%)穿刺后发热持续时间仍较长。 2.3 并发症及后遗症影响因素
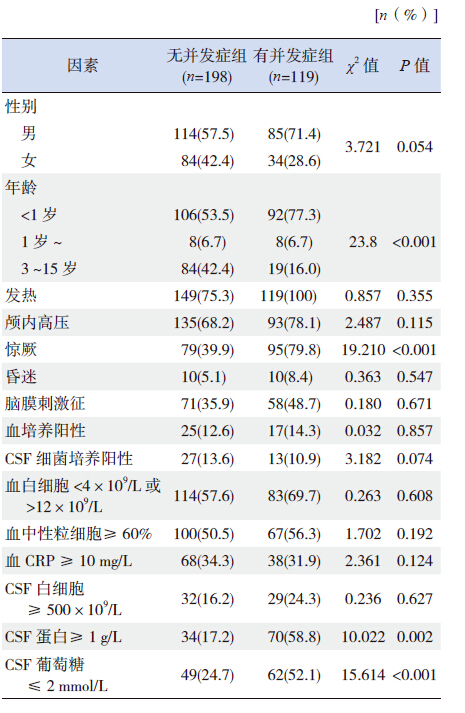
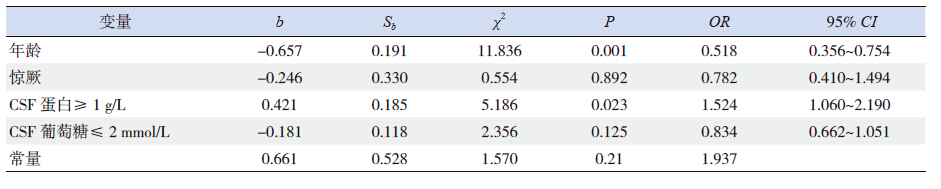
为探索并发症和早期后遗症(以下合称两者为并发症)发生的影响因素,对发生与未发生并发症两组进行年龄、性别、临床表现、实验室检查结果进行卡方检验,显示年龄、惊厥、CSF蛋白≥1 g/L、CSF糖≤2 mmol/L等4个因素影响并发症和后遗症的发生(表 2)。将这4个影响因素进行非条件多因素logistic回归分析,结果显示年龄和CSF蛋白≥1 g/L为独立影响因素(表 3),即 CSF蛋白越高、年龄越小,并发症和后遗症发生率越高。
| 表2 PM 患儿并发症和后遗症影响因素的单因素分析 |
| 表3 PM 并发症和后遗症影响因素的logistic 多因素回归分析 |
血培养阳性44例(13.8%),其中葡萄球菌属14例,肺炎链球菌10例,大肠杆菌11例,以及肠球菌6例,溶血性链球菌2例,产单核李斯特菌2例,藤黄微球菌1例,其中2例合并两种细菌感染。脑脊液细菌培养42例(13.7%)阳性,包括肺炎链球菌 20例,葡萄球菌属12例,大肠杆菌4例,以及肺炎克雷伯亚种2例,屎肠球菌1例,不明3例。所有病例中仅有5例血培养和脑脊液同时阳性,其中2例培养为肺炎链球菌。
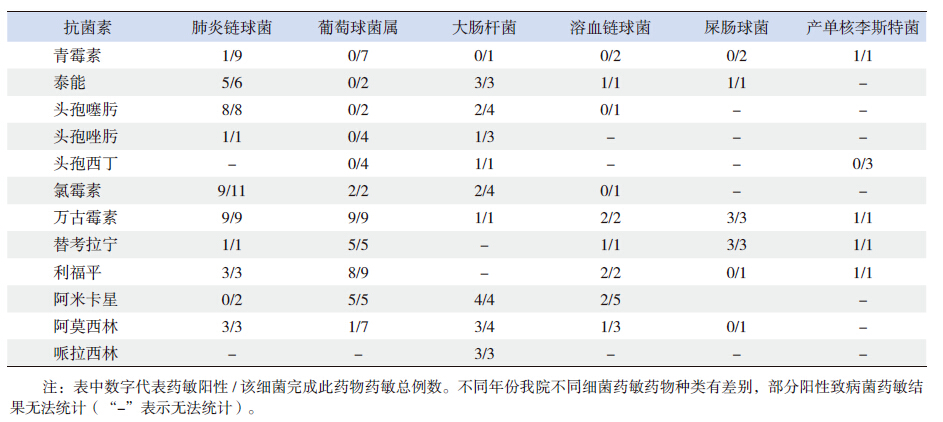
统计本研究中较常见致病菌的药敏资料(表 4),显示致病菌对第三代头孢、泰能、氯霉素、利福平敏感性高,对青霉素敏感性低,各种致病菌对万古霉素完全敏感。
| 表4 血培养及脑脊液培养阳性致病菌药敏试验结果 (例) |
253例已于院外抗感染治疗。入院后第1天均使用抗生素治疗,其中265例仅使用第三代头孢或加青霉素类,36例选用第三代头孢联合万古霉素,7例联合头孢及万古霉素或碳青霉烯类,9例选用其他。其中28例因不同原因选用(或换用)万古霉素和(或)氯霉素,7例换用碳青霉烯类。更换抗生素原因中,因规范抗感染治疗3 d后仍发热换用的病例最多,其次为根据药敏试验结果换用抗生素。换用万古霉素和(或)氯霉素、碳青霉烯类后治疗有效,未再换用其他抗生素,仅1例药敏试验结果示对万古霉素敏感,换用万古霉素和泰能治疗仍有发热,后加用利福平治疗病情好转。 2.6 随访
对本研究中129例(2011及2012年的病例)进行了电话随访,其中90例获得成功随访。90例中有79例出院时肢体活动正常,且其MRI表现正常,而其中13例在出院后1~3个月内出现肢体运动障碍,或者其头颅MRI提示异常信号,如脑软化、萎缩或脑水肿,13例中在出院时有4例合并轻微异常脑脊液,3例并发硬膜下积液。 3 讨论
本研究表明PM多发于婴儿,可能与婴儿免疫系统未发育成熟,血脑屏障功能较差有关,此外可能与疫苗接种不完善有关。本研究显示发热、颅内高压、惊厥、脑膜刺激征、意识障碍等为主要临床表现,与国内外报道一致[2,9-10]。惊厥易发生在婴儿中,可能与婴儿大脑发育不成熟,皮层异常放电易泛化相关,但婴儿颅内高压及脑膜刺激征表现不如年长儿典型,可能与婴儿前囟未闭可缓冲颅内压力有关。
硬膜下积液是指脑脊液进入硬脑膜及蛛网膜之间的硬膜下腔隙,研究显示其为PM的主要并发症[3, 9, 11],在本研究中发生率高达29.9%,可引起反复发热、颅内高压,甚至导致意识障碍,大量积液压迫脑组织,致脑萎缩[8],严重影响儿童生活质量。硬膜下积液诊断方式最常见的为头颅B超和CT扫描[11,12],但有统计显示,如果通过硬膜下穿刺,硬膜下积液发现率可达到50%[11],本研究中部分硬膜下积液需经过硬膜下穿刺发现,提示硬膜下穿刺对于硬膜下积液的诊断有一定价值。硬膜下积液的治疗目前尚无统一方案,对于积液较多或症状明显者,硬膜下穿刺可作为主要治疗方法之一[12]。有研究报道,在经硬膜下穿刺后成活病例中,积液在6个月内全部被吸收;另有研究显示经硬膜下穿刺后,患儿病情明显好转[12]。本研究中大部分并发硬膜下积液患儿经硬膜下穿刺后,其体温逐渐下降,显示硬膜下穿刺在治疗硬膜下积液中的价值。Yang等[14]在硬膜下积液病例分析中也肯定了硬膜下穿刺的价值。
本研究单因素分析显示,年龄、惊厥、CSF蛋白≥1 g/L、CSF糖≤2 mmol/L为影响并发症及后遗症发生的因素;多因素logistic回归分析显示,年龄越小、CSF蛋白越高,并发症和后遗症发生率越高,与文献报道一致[2, 11, 15]。建议临床上小婴儿、惊厥频繁、CSF蛋白≥1 g/L、CSF糖≤2 mmol/L时应高度警惕PM并发症和后遗症的发生。
对于PM合适的抗生素选择原则,包括对抗致病菌的杀菌力,以及透过血脑屏障能力及在脑脊液中保持高浓度。已证实第三代头孢,如头孢曲松可作为经验治疗首选[16]。本研究中细菌培养阳性菌对第三代头孢敏感性高,且部分病例选用头孢唑肟,提示头孢唑肟也具有头孢曲松类似作用。本研究中1例患儿根据药敏试验结果应用万古霉素和泰能治疗后发热不退,后加用利福平治疗病情好转。Spreer等[17]对PM动物模型给予短时间利福平治疗,发现利福平可减轻炎症反应,减少脑细胞死亡。以上提示利福平可能为PM常规有效抗生素治疗效果不佳时的另一选择。
在随访中主要针对于出院后1~3个月内病情,本研究显示治愈出院或CSF未恢复而终止治疗或合并硬膜下积液的PM患儿存在延迟脑血管炎反应。近年来越来越多的报道显示PM即使治愈后通过头颅影像学提示存在脑动脉血栓形成或脑梗塞等脑血管病变发生[6-7,18],或在病程中颅脑影像学显示正常,但在出院随访中发现脑血栓[19]。其发生机制尚不明确,一些研究提示可能为炎症渗透导致血管痉挛所致[7]。研究者分析发生脑血管病变危险因素包括高脑脊液中白细胞、糖及糖/血糖比值[7],另有研究示由肺炎链球菌、副流感嗜血杆菌所致的PM更易发生脑卒中,且多在病程最严重的数日内或更长时间出现[18, 20],因此建议对于脑脊液检查中白细胞高,或糖/血糖比值低及肺炎链球菌、副流感嗜血杆菌感染的PM患儿应注意有无血管炎相应症状体征,对于PM治愈患儿特别是CSF未恢复者及有以上危险因素者,出院后应告知在1~3个月内或更长时间内进行随访,完善头颅影像学检查,警惕血管炎及其他后遗症的发生。
| [1] | Cantey JB, Lopez-Medina E, Nguyen S, et al. Empiric antibiotics for serious bacterial infection in young infants: opportunities for stewardship[J]. Pediatr Emerg Care, 2015. [Epub ahead of print]. |
| [2] | Vasilopoulou VA, Kara M, Theodoridou K, et al. Prognostic factors related to sequelae in childhood bacterial meningitis: data from a Greek meningitis registry[J]. BMC Infect Dis, 2011, 11: 214. |
| [3] | Thaver D, Zaidi AK. Burden of neonatal infections in developing countries: a review of evidence from community-based studies[J]. Pediatr Infect Dis J, 2009, 28(1 Suppl): S3-S9. |
| [4] | Juganariu G, Miftode E, Teodor D, et al. Clinical features and course of bacterial meningitis in children[J]. Rev Med Chir Soc Med Nat Iasi, 2011, 116(3): 722-726. |
| [5] | Edmond K, Clark A, Korczak VS, et al. Global and regional risk of disabling sequelae from bacterial meningitis: a systematic review and meta-analysis[J]. Lancet Infect Dis, 2010, 10(5): 317-328. |
| [6] | Schut ES, Brouwer MC, De Gans J, et al. Delayed cerebral thrombosis after initial good recovery from pneumococcal meningitis[J]. Neurology, 2009, 73(23): 1988-1995. |
| [7] | Klein M, Koedel U, Pfefferkorn T, el at. Arterial cerebrovascular complications in 94 adults with acute bacterial meningitis[J]. Crit Care, 2011, 15(6): R281. |
| [8] | 胡亚美. 诸福棠实用儿科学[M]. 第7 版. 北京人民卫生出版 社, 2002: 915. |
| [9] | 李宁. 144 例儿童化脓性脑膜炎临床分析[J]. 实用临床医药 杂志, 2011, 15(19): 174-175. |
| [10] | Brouwer MC, Allan R, Diederik VD. Epidemiology, diagnosis, and antimicrobial treatment of acute bacterial meningitis[J]. Clin Microbiol Rev, 2010, 23(3): 467-492. |
| [11] | Namani SA, Koci BM, Milenković Z, et al. Early neurologic complications and long-term sequelae of childhood bacterial meningitis in a limited-resource country (Kosovo)[J]. Childs Nerv Syst, 2013, 29(2): 275-280. |
| [12] | 吕祖芳,张立明,段全纪,等. 穿刺引流治疗小儿化脓性脑膜炎并发难治性硬膜下积液8 例临床分析[J]. 潍坊医学院学报, 2009, 31(4): 305-306. |
| [13] | 汪奇伟. 化脓性脑膜炎合并硬膜下积液80 例分析[J]. 中国全科医学, 2004, 7(6): 419-420. |
| [14] | Yang Q, Li M. Subdural puncture in diagnosis and treatment of subdural fluid collection in infants or toddlers with purulent meningitis: report of 207 cases[J]. J Third Mil Med Univ, 2009, 31(7): 623-625. |
| [15] | Antoniuk SA, Hamdar F, Ducci RD, et al. Childhood acute bacterial meningitis: risk factors for acute neurological complications and neurological sequelae[J]. J Pediatr (Rio J), 2012, 87(6): 184-185. |
| [16] | Agrawal S, Nadel S. Acute bacterial meningitis in infants and children: epidemiology and management[J]. Pediatr Drugs, 2011, 13(6): 385-400. |
| [17] | Spreer A, Lugert R, Stoltefaut V, el al. Short-term rifampicin pretreatment reduces inflammation and neuronal cell death in a rabbit model of bacterial meningitis[J]. Crit Care Med, 2009, 37 (7): 2253-2258. |
| [18] | Kato Y, Takeda H, Dembo T, et al. Delayed recurrent ischemic stroke after initial good recovery from pneumococcal meningitis[J]. Intern Med, 2012, 51(6): 647-650. |
| [19] | Bozzola E, Bozzola M, Colafati GS, et al. Multiple cerebral sinus thromboses complicating meningococcal meningitis: a pediatric case report[J]. BMC Pediatr, 2014, 14: 147. |
| [20] | Palacio S, Hart RG, Vollmer DG, et al. Late developing cerebral arterophy after pyogenic meningitis[J]. Arch Neurol, 2003, 60(3): 431-433. |
 2015, Vol. 17
2015, Vol. 17