2. 四川大学华西第二医院 西部妇女儿童医学研究院肺血管重构研究室, 四川 成都 610041;
3. 新加坡陈笃生医院普通内科, 新加坡 308433;
4. 四川大学华西临床医学院, 四川 成都 610041
肺动脉高压(pulmonary hypertension,PH)是一组以肺血管阻力进行性增高为主要特征的临床病理表现[1],治疗手段有限,各种对症药物疗效不理想,预后差。雷帕霉素(rapamycin,RAP)是由链球菌属产生的一种大环内酯内抗免疫抗生素,对多种类型细胞有免疫抑制作用和抗增殖作用,是哺乳动物RAP靶体(mammalian target of rapamycin,mTOR)的特异性抑制剂,而mTOR信号通路广泛参与细胞的生长、分化、增殖和衰老等生命活动[2]。RAP在临床上常被应用于抑制移植术后T淋巴细胞的增殖[3]、肿瘤[4]及冠状动脉支架植入后平滑肌细胞增殖所致的局部狭窄[5],研究证实RAP有抑制细胞增殖的作用。现有的研究表明重度PH所致的肺血管病变与肿瘤有相似的病理学表现,即细胞失控性增殖[6,7],而RAP有抑制肿瘤细胞增殖的作用,由此推测RAP可能有抑制肺血管平滑肌细胞增殖的作用,该药物有应用于临床治疗PH的潜在可能性,因此本文对RAP是否能影响大鼠PH及对肺动脉平滑肌细胞(pulmonary artery smooth muscular cell,PASMC)的作用进行探讨,为临床药物治疗PH的可能性提供科学依据。 1 材料与方法 1.1 大鼠PH动物模型建立 50只体重为250~350 g的健康雄性Sprague-Dawley(SD)大鼠购于四川大学实验动物中心,随机分为空白对照组(不做任何处理)、模型组、溶剂对照组、RAP干预1组和RAP干预2组,每组10只。参照刘斌等[8]报道建立左肺动脉切除术(pneumonectomy,PE)联合野百合碱(monocrotaline,MCT)诱导的PH大鼠模型。SD大鼠在腹腔注射水合氯醛麻醉下行左肺PE术,模型组于PE术后7 d在项背部皮下注射MCT 1次(60 mg/kg);溶剂对照组和RAP干预1组均于PE术后5 d(MCT皮下注射前2 d)开始,分别给予RAP空白溶媒(二甲基亚砜)肌肉注射(每日1次,每次1 mL/kg)和RAP肌肉注射(每日1次,每次5 mg/kg),连续注射30 d;RAP干预2组于PE术后35 d(MCT皮下注射后28 d)开始,给予RAP肌肉注射(每日1次,每次5 mg/kg),连续注射14 d。 1.2 平均肺动脉压力的测定
除RAP干预2组于PE术后49 d测定平均肺动脉压(mean pulmonary artery pressure,mPAP),其余组均于PE术后35 d测定mPAP。给予大鼠腹腔注射10%水合氯醛(400 mg/kg)麻醉后,经颈外静脉插管,连接测压装置至BIOPAC MP-150十六导生理记录仪测定并记录mPAP。 1.3 右心室肥厚程度指标
脱颈椎处死实验动物,游离右心室(right ventricular,RV)、左心室加室间隔(left ventricular and septal,LV+S),称重,计算RV/(LV+S)比值,反映右心室肥厚程度。 1.4 肺动脉组织病理学观察
处死动物后取出右肺组织,冲洗,10%中性甲醛固定48 h,常规石蜡包埋、切片,行苏木精-伊红(HE)染色。在200倍光镜下观察切片。 1.5 实时荧光定量聚合酶链反应
取右肺组织,制成组织匀浆,提取RNA并逆转录为cDNA。参照GenBank基因数据库,运用Beacon designer2软件分别设计平滑肌α肌动蛋白(alpha smooth muscle actin,α-SMA)、平滑肌22α蛋白(smooht muscle 22 Alpha,SM22α)和内参GAPDH的PCR扩增引物序列,分别为SM22α上游:5'-AGACTGACATGTTCCAGACT-3',SM22α下游:5'-GCTTTCTTCATAAACCAGTTG-3',片段长度145 bp;α-SMA上游:5'-AGAACCACAGGCATTG- TTCT-3',α-SMA下游:5'-CGCTCAGTGAGGTCTT- CAT-3',片段长度149 bp;GAPDH上游:5'-AAGCTCATTTCCTGGTATGACA-3',GAPDH下游:5'-TCTTACTCCTTGGAGGCCATGT-3',片段长度114 bp。反应体系(10 μL):Mix 5 μL,cDNA 1 μL,上下游引物各0.1 μL,ddH2O 3.8 μL。反应条件:95℃变性3 min;95℃变性10 s,59℃退火30 s,72℃延伸30 s,共40个循环。PCR反应在FTC2000型荧光定量PCR仪上进行,实时测定PCR荧光强度并确定扩增循环数(Ct值),并换算为基因相对表达量(2-△△Ct)。 1.6 统计学分析
应用SPSS 17.0统计软件对数据进行统计学分析,计量资料用均数±标准差(x±s)表示,多组样本均数比较采用单因素方差分析,组间两两比较采用LSD-t检验,P < 0.05为差异有统计学意义。 2 结果 2.1 各组大鼠血流动力学改变
5组大鼠mPAP比较差异有统计学意义(F=46.191,P < 0.01)。模型组(49.2±6.1 mm Hg)及溶剂对照组mPAP(48.6±7.0 mm Hg)明显高于空白对照组(31.1±2.4 mm Hg)(P < 0.01),RAP干预1组(25.1±2.1 mm Hg)及RAP干预2组(27.8±4.2 mm Hg)mPAP明显低于溶剂对照组(P < 0.01)。见图 1。
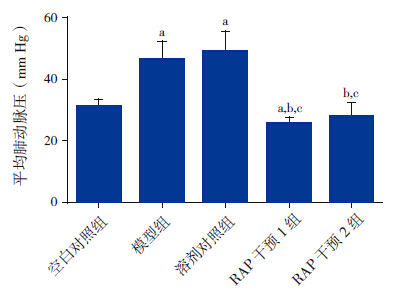 |
图 1 各组大鼠mPAP比较结果 a示与空白对照组比较,P < 0.05;b示与模型组比较,P < 0.05;c示与溶剂对照组比较,P < 0.05。 |
5组大鼠RV/(LV+S)比较差异有统计学意义(F=678.845,P < 0.01)。模型组及溶剂对照组RV/(LV+S)明显高于空白对照组(P < 0.01),RAP干预1组RV/(LV+S)低于溶剂对照组(P < 0.01),而RAP干预2组RV/(LV+S)与溶剂对照组比较差异无统计学意义(P=0.899)。见图 2。
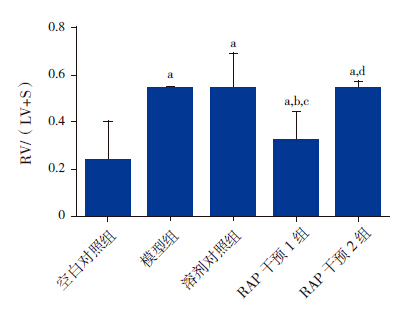 |
图 2 各组大鼠RV/(LV+S)比较结果 a示与空白对照组比较,P < 0.05;b示与模型组比较,P < 0.05;c示与溶剂对照组比较,P < 0.05;d示与RAP干预1组比较,P < 0.05。 |
右肺病理组织HE染色可见,模型组及溶剂对照组的肺动脉壁较空白对照组明显增厚,管腔狭窄,RAP干预后可见增厚的肺动脉壁有不同程度逆转。见图 3。
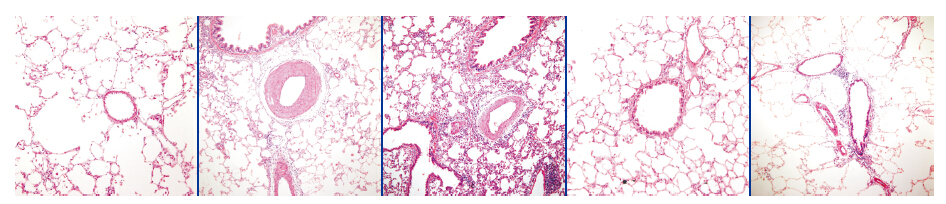 |
图 3 右肺组织病理学HE染色结果(×200) 空白对照组显示正常肺动脉。模型组可见肺动脉壁明显增厚,细胞增多,管腔狭窄。溶剂对照组肺组织病理改变与模型组相似。RAP干预1组及RAP干预2组与模型组和溶剂对照组比较,肺动脉壁变薄,管腔扩大,RAP干预2组变化程度小于RAP干预1组。 |
5组大鼠SM22α mRNA相对表达差异有统计学意义(F=22.195,P < 0.01)。模型组及溶剂对照组的SM22α mRNA相对表达量低于空白对照组(均P < 0.01),RAP干预1组的SM22α mRNA相对表达量高于溶剂对照组(P < 0.01),RAP干预2组的SM22α mRNA相对表达量与溶剂对照组比较差异无统计学意义(P=0.059)。5组大鼠α-SMA mRNA相对表达差异有统计学意义(F=8.717,P < 0.01)。模型组及溶剂对照组的α-SMA mRNA相对表达量低于空白对照组(均P < 0.01),RAP干预1组的α-SMA mRNA相对表达量高于溶剂对照组(P=0.005),RAP干预2组的α-SMA mRNA相对表达量与溶剂对照组比较,差异无统计学意义(P=0.172)。见图 4。
 |
图 4 各组间α-SMA及SM22α mRNA相对表达量比较结果 a示与空白对照组比较,P < 0.05;b示与模型组比较,P < 0.05;c示与溶剂对照组比较,P < 0.05。 |
PH是一组由肺血管平滑肌细胞增殖、新生内膜形成、细胞外基质增多而导致进行性增高的肺动脉压力及阻力为主要临床特点的综合征,其发病机制复杂,迄今为止仍不十分清楚,故临床治疗多以对症为主,目的是扩张肺血管,防止血栓形成,减轻右心后负荷,改善症状及生活质量,但效果均不理想[9,10,11]。因而对PH发病机制的研究及相应针对性药物的甄选一直是心血管领域研究的重点。
本研究应用左肺切除术联合野百合碱注射成功建立大鼠PH模型,模型组术后35 d mPAP明显高于空白对照组,同时伴有右心室肥厚,RV/(LV+S)比值明显增高,且病理组织学结果显示肺动脉壁细胞及基质成分增加,管壁增厚,管腔狭窄,符合PH的病理改变[12]。本研究采用了两种RAP干预方式,即早期干预(PH形成前)和晚期干预(PH形成后),两种方式均能不同程度地减轻肺动脉压力及肺血管壁的厚度。但早期RAP干预能使右心室肥厚程度减轻,而晚期干预则不能,推测其原因为早期干预可以减缓肺动脉压力和右心室后负荷的增加速度,故心肌细胞肥厚程度较轻,而晚期干预时肺动脉压力已经明显升高,右心室肥厚已形成,予RAP后虽能在一定程度上降低肺动脉压力,但并不能逆转已经肥厚的心肌细胞。
RAP能特异性抑制哺乳动物mTOR[13],mTOR是一类非典型丝氨酸/苏氨酸激酶,属于磷脂酰肌醇3激酶(phosphoinositide 3-kinase,PI3K)家 族[14],它通过细胞内两种mTORC复合物(mTORC1和mTORC2)而调控mTOR信号通路。研究表明,生长因子可以通过上调PI3K-Akt及Ras/ERK(extracelluar singnal-reglated kinase)信号通路途径激活mTORC1,促进蛋白质合成及细胞增殖[15]。mTORC2也能通过PI3K依赖的方式被生长因子激活[16],通过PKCa及RhoGTPases信号途径调控细胞的代谢、增殖及细胞骨架等生命活动[17-18]。雷帕霉素可能通过抑制mTOR信号通路,下调PI3K信号途径,从而抑制细胞的增殖。
平滑肌α肌动蛋白(α-SMA)和平滑肌22α蛋白(SM 22α)是特异性平滑肌表达蛋白,在收缩表型中呈高表达,在合成表型中则呈低表达[19-20],合成表型的PASMC表现出增殖活性。本课题组前期研究证实PI3K信号可通过微丝解聚机制诱导PASMC由收缩表型向合成表型转换,促进PASMC的增殖和PH形成[21]。本研究发现,模型组中α-SMA及SM 22α两种基因表达量明显下降,与这两种蛋白在PAH病理状态下的合成表型PASMC中的表达一致[22]。RAP干预后以上两个基因表达量有不同程度恢复,提示RAP在减轻PH的过程中伴有PASMC表型的转化,具有调节PASMC表型转化的作用,推测RAP可能通过调节PI3K家族的mTOR信号通路而调控PASMC的增殖。
本研究使用了两种RAP干预方案,发现两种方案均能使mPAP明显下降,肺动脉壁厚度减轻。早期RAP干预可使α-SMA及SM22α两种基因表达量上调,PASMC向收缩表型转化,而晚期干预的结果显示不能促使细胞发生表型转化,推测原因可能为:(1)晚期干预时间较短(14 d),尚未能观察到细胞蛋白合成的变化。(2)当肺血管重构进展至较晚阶段后,RAP对PH的抑制作用并不仅仅依赖于调节细胞表型的转化,可能存在其他作用机制。
综上所述,本研究结果提示雷帕霉素能减缓或逆转由左肺切除术联合野百合碱诱导的大鼠PH,其作用机制可能是通过调节PASMC的表型转化,抑制PASMC的增殖实现的,对于较晚期PH的改善可能还存在其他调节机制。雷帕霉素可作为临床治疗PH的候选药物之一,其具体作用机制有待更深入的研究。
| [1] | Simonneau G, Gatzoulis MA, Adatial I, et al. Updated clinical classification of pulmonary hypertension[J]. J Am Coll Cardiol, 2013, 62(25 Suppl): D34-D41. |
| [2] | Li J, Kim SG, Blenis J. Rapamycin: One drug, many effects[J]. Cell Metabolism, 2014, 19(3): 373-379. |
| [3] | Rao RD, Buckner JC, Sarkaria JN. Mammalian target of rapamycin (mTOR) inhibitors as anti-cancer agents[J]. Curr Cancer Drug Targets, 2004, 4(8): 621-635. |
| [4] | Petroulakis E, Mamane Y, Le Bacquer O, et al. mTOR signaling: implications for cancer and anticancer therapy[J]. Br J Cancer, 2006, 94(2): 195-199. |
| [5] | Morice MC, Serruys PW, Sousa JE, et al. A randomized comparison of a sirolimus-eluting stent with a standard stent for coronary revascularization[J]. N Engl J Med, 2002, 346(23): 1773-1780. |
| [6] | Bonnet S, Archer SL, Allalunis-Tu r n e r J, e t a l. A mitochondria-K+ channel axis is suppressed in cancer and its normalization promotes apoptosis and inhibits cancer growth[J]. Cancer Cell, 2007, 11(1): 37-51. |
| [7] | McMurtry MS, Archer SL, Altieri DC, et al. Gene therapy targeting survivin selectively induces pulmonary vascular apoptosis and reverses pulmonary arterial hypertension[J]. J Clin Invest, 2005, 115(6): 1479-1491. |
| [8] | 刘斌, 王献民, 魏丽, 等. 4 种肺动脉高压动物模型肺血管重 构模式的差异研究[J]. 中国病理生理杂志, 2008, 24(2): 289-293. |
| [9] | Rosenblum WD. Pulmonary arterial hypertension: pathobiology, diagnosis, treatment, and emerging therapies[J]. Cardiol Rev, 2010, 18(2): 58-63. |
| [10] | 虞燕萍, 黄先玫. 儿童肺动脉高压的药物治疗进展[J]. 中国 当代儿科杂志, 2012, 14(3): 236-240. |
| [11] | Rao RD, Buckner JC, Sarkaria JN. Mammalian target of rapamycin (mTOR) inhibitors as anti-cancer agents[J]. Curr Cancer Drug Targets, 2004, 4(8): 621-635. |
| [12] | Jeffery TK, Morrell NW. Melecular and cellular basis of pulmonary vascular remodeling in pulmonary hypertension[J]. Prog Cardiovasc Dis, 2002, 45(3): 173-302. |
| [13] | Laplante M, Sabatini DM. mTOR signaling in growth control and disease[J]. Cell, 2012, 149(2): 274-293. |
| [14] | Dennis PB, Fumagalli S, Thomas G. Target of rapamycin (TOR): balancing the opposing forces of protein synthesis and degradation[J]. Curr Opin Genet Dev, 1999, 9(1): 49-54. |
| [15] | Ma XM, Blenis J. Molecular mechanisms of mtor-mediated translational control[J]. Nat Rev Mol Cell Biol, 2009, 10(5): 307-318. |
| [16] | Laplante M, Sabatini DM. Mtor singnaling at a glance[J]. J Cell Sci, 2009, 122(pt 20): 3589-3594. |
| [17] | Sarbassov DD, Guertin DA, Ali SM, et al. Phosphorylation and regulation of akt/pkb by the rictor-mtor complex[J]. Science, 2005, 307(5712): 1098-1101. |
| [18] | Guertin DA, Stevens DM, Thoreen CC, et al. Ablation in mice of the mtorc components reptor, rictor, or mlst8 reveals that mtorc2 is required for signaling to akt-foxo and pkcalpha, but not s6k1[J]. Dev Cell, 2006, 11(6): 859-871. |
| [19] | Han M, Dong LH, Zheng B, et al. Smooth muscle 22 alpha maintains the differentiated phenotype of vascular smooth muscle cells by inducing filamentous actin bundling[J]. Life Sci, 2009, 84(13-14): 394-401. |
| [20] | Fan Z, Li C, Qin C, et al. Role of the PI3K/AKT pathway in modulating cytoskeleton rearrangements and phenotype switching in rat pulmonary arterial vascular smooth muscles cells [J]. DNA Cell Biol, 2014, 33(1): 12-19. |
| [21] | Rensen SS, Doevendans PA, Van Eys GJ. Regulation and characteristics of vascular smooth muscle cell phenotype diversity[J]. Neth Heart J, 2007, 315(3): 100-108. |
| [22] | Schermuly RT, Ghofrani HA, Wilkins MR, et al. Mechanisms of disease: pulmonary arterial hypertension[J]. Nat Rev Cardiol, 2011, 8(8): 443-455. |
 2015, Vol. 17
2015, Vol. 17


