2. 潍坊医学院 临床医学专业2011级, 山东 潍坊 261053;
3. 潍坊医学院 临床学院眼科, 山东 潍坊 261053
新生儿缺氧缺血性脑病(hypoxic-ischemic encephalopathy,HIE)是新生儿科严重的疾病,威胁着新生儿的生命[1],寻找其有效的治疗方案具有重要意义。细胞移植与高压氧(HBO)治疗是目前HIE比较有希望的两种治疗方案。近年来,脐血库的兴起为细胞治疗提供了新的来源,研究发现脐血单个核细胞(umbilical cord mononuclear cells,UCBMC)脑内移植可存活,并减轻新生大鼠缺氧缺血性脑损伤(hypoxic-ischemic brain damage,HIBD)[2],但不能完全抑制脑组织损伤。研究还发现HBO不仅可减轻HIBD[3],且可改善损伤神经组织的微环境,抑制免疫炎症反应,促进细胞移植[4, 5],本课题组在前期工作也中发现UCBMC移植可减轻新生大鼠HIBD程度,其疗效显著优于单纯介质组[6]。那么UCBMC联合HBO治疗是否可改善UCBMC移植的疗效呢?目前该方面的研究报道甚少。故本研究采用UCBMC联合HBO治疗新生大鼠HIBD,并观察其对远期行为学、组织学的影响并探讨其对炎症因子白介素1β(interleukin-1β,IL-1β)、肿瘤坏死因子(tumor necrosis factor-alpha,TNF-α)蛋白的影响及机制,以期为HIBD的治疗选择最佳的治疗方案。 1 材料与方法 1.1 实验动物及分组
健康 7日龄 Sprague-Dawley(SD)新生大鼠 (清洁级,由山东省中医药大学提供并批准使用),雌雄不限,体重12.1~15.6 g,平均13.9±1.6 g,随机分为4组:(1)正常对照组,不做任何处理;(2)缺氧缺血性脑损伤组(HIBD组);(3)UCBMC组(HIBD后24 h单纯移植UCBMC);(4)UCBMC+HBO组(HIBD后3 h,行HBO治疗,HIBD后24 h移植UCBMC);各组分别于移植后24 h、28 d处死大鼠。 1.2 主要试剂与设备
人全血单个核细胞分离液购自天津TBD公司;IL-1β、TNF-α抗体购自美国Santa Cruz公司;常压氧舱(武汉七0一研究所);婴儿高压氧舱(武汉七0一研究所);大鼠脑立体定位仪(深圳瑞奥德公司);5 μL微量注射器(上海生物工程有限公司);正置荧光显微镜(日本OLYMPUS公司);石蜡切片机(英国Shanton公司);电子分析天平(美国梅特勒公司);放射性迷宫(DL-REB,中国东乐公司)、T迷宫(DL-RTM,中国东乐公司)。 1.3 HIBD模型的制作
采用经典Rice-Vannucci方法[7]制成 HIBD模型,乙醚吸入麻醉,颈部正中切口,分离左侧颈总动脉双线结扎,并在结扎中间剪断,后置于 8.00%±0.01%低氧舱内缺氧 2 h,舱内温度控制在 36.0±1.0℃,湿度为 70%±5%。实验结束后,将大鼠放回鼠笼,由母鼠喂养。正常对照组不做任何处理。 1.4 HBO治疗
HIBD后3 h内,UCBMC+HBO组大鼠行 HBO治疗,每日治疗1次,连续治疗 7 d,方法如下:(1)洗舱:纯氧洗舱15 min,流量10 L/min;(2)升压:纯氧升压15~20 min,流量为5~8 L/min;(3)稳压:2个绝对大气压稳压治疗60 min,监测氧气浓度不低于 85%;(4)减压:匀速减压,20~30 min内减压完毕[8]。 1.5 UCBMC的采集、分离与移植
经足月孕妇知情并同意,采集脐血约50 mL,0.01 mol/L灭菌磷酸盐缓冲液等体积稀释,灭菌试管中先加入人单个核细胞分离液,缓慢加入稀释血(稀释血与单个核细胞分离液的体积比约为2 : 1),2 000 r/min离心20 min,吸取中间白膜层的单个核细胞。生理盐水洗涤并制成单个核细胞悬液,置冰上备用。造模后24 h,UCBMC组与UCBMC+HBO组大鼠分别置于大鼠立体定位仪上,左侧侧脑室(AP:-0.5 mm,ML:-2 mm,DV:-2 mm)注入UCBMC悬液,每只大鼠注入 3×106个/2 μL活细胞,缓慢注入,留针5 min,拔针缝合头皮,复温苏醒后回笼饲养。 1.6 Western blot法检测 IL-1β与TNF-α蛋白的表达
移植 24 h[9],断头取脑处死各组大鼠(n=8),每只大鼠取左脑前囟前1.0 ~ -4.5 mm脑组织,立即放入液氮研磨,加入全细胞裂解液提取总蛋白,采用考马斯亮蓝法测定蛋白浓度,取60 μg蛋白,10%的聚丙烯酰胺分离胶分离,电压300 V,湿转膜1 h,50 g/L的脱脂奶粉室温封闭1~2 h,分别加入IL-1β(1 : 1 000)、TNF-α(1 : 2 000)、GAPDH(1 : 1 000)一抗,4℃孵育过夜。洗膜后,加入相应的二抗室温孵育2 h,采用ECL化学发光试剂盒显影,曝光,扫描,凝胶成像系统分析目的蛋白的光密度值,计算其与相应GAPDH光密度值的比值并行统计学分析。 1.7 T迷宫试验
自22日龄起进行T迷宫测试(n=8),左右两臂的末端放置约40 mg的食物。测试分为预备和测试两个阶段。预备阶段时,训练大鼠在T迷宫的一臂觅食后,15 s后需进入另一臂觅食,觅食适应2 d后,进入正式测试。每只动物每日测试5次,每次间隔15 min,连续4 d,并记录每日测试的正确率。 1.8 空间学习记忆能力放射性迷宫测试
自30日龄起,进行放射性迷宫测试(n=8)。测试前禁水48 h,仅傍晚饮水30 min。开始2 d在每个臂的孔内都放50 μL水,让动物在迷宫内自由觅水。空间测试时在3个相邻角度分别为135°、90°和135°的臂内加水,每天测试5次,每次间隔1 min,连续测试3 d,每次测试时,大鼠放在迷宫中央面朝固定的第3臂,3个臂的水都被找到时实验结束,记录找到3个臂的水所花的时间以及记忆错误的次数(即进入没有水的臂的次数)[10]。 1.9 Nissl染色
移植后4周,各组大鼠常规灌注后取脑(n=8),常规包埋并制成脑组织石蜡切片,脱腊至水。0.1%甲苯胺蓝 60℃孵育 1 min,水洗,70%、80%乙醇脱水各1 min,95%酒精镜下分化,直至细胞核及其背景均为淡蓝或无色,无水乙醇脱水,二甲苯透明,中性树胶封片。采用 Cellsens 16.0分析软件,计数损伤侧海马CA1区单位面积锥体细胞数。 1.10 统计学分析
采用 SPSS 18.0统计软件进行统计学分析,所有计量资料用均数±标准差(x±s)表示,方差齐性资料采用单因素方差分析,组间比较采用SNK-q检验,P<0.05为差异有统计学意义。 2 结果 2.1 IL-1β与TNF-α蛋白的Western blot结果
移植后 24 h,各组 IL-1β和TNF-α蛋白表达差异均有统计学意义(F值分别为31.0和70.99,均P<0.01)。其中HIBD组IL-1β和TNF-α蛋白表达水平明显高于对照组,差异有统计学意义(均P<0.01);UCBMC组IL-1β和TNF-α蛋白表达水平明显低于 HIBD组(均P<0.01),但仍高于对照组(均P<0.01);UCBMC+HBO组IL-1β和TNF-α蛋白表达水平明显低于 HIBD组及 UCBMC组(P<0.01,P<0.05),但仍明显高于对照组(P<0.05)。见图 1。
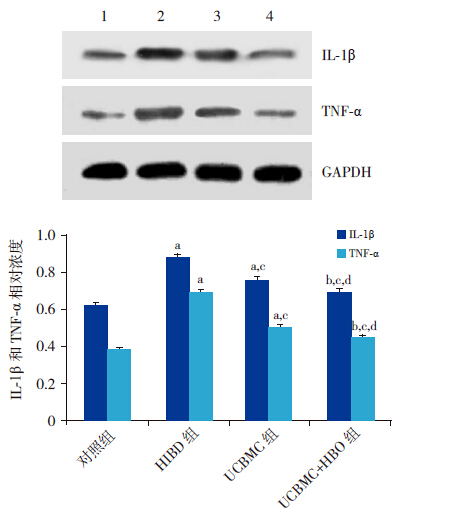 |
图 1UCBMC联合HBO治疗对HIBD大鼠脑IL-1β与TNF-α蛋白的影响上图为电泳条带结果:1为对照组,2为HIBD组,3为UCBMC组,4为UCBMC+HBO组。下图为统计结果:a示与对照组比较,P<0.01;b示与对照组比较, P<0.05;c示与HIBD组比较,P<0.01;d示与UCBMC组比较,P<0.05。 |
在连续 4 d测试中,对照组、UCBMC组、UCBMC+HBO组的正确率逐渐增高,而HIBD组正确率上升不明显;测试第4 d时UCBMC组正确率较HIBD组明显提高(P<0.01),但仍低于对照组(P<0.01),UCBMC+HBO组正确率明显高于HIBD组及UCBMC组(P<0.01,P<0.05),但仍低于对照组(P<0.05)。见图 2。
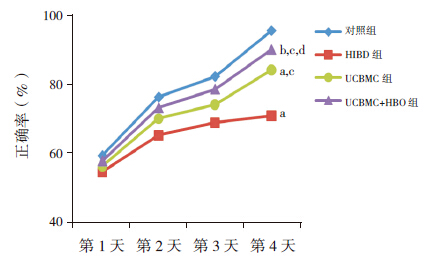 |
图 2各组T迷宫实验结果a示与对照组比较,P<0.01;b示与对照组比较,P<0.05;c示与HIBD组比较,P<0.01;d示与UCBMC组比较,P<0.05。 |
HIBD组大鼠觅水时间(147±13 s)显著长于对照组(102±9 s),而错误次数(14.0±1.2)显著高于对照组(9.7±1.0)(均P<0.01)。UCBMC组觅水时间(122±10 s)较 HIBD组显著减少(P<0.01),仍高于对照组 (P<0.01),其错误次数(12.0±1.2)显著高于对照组(P<0.01),但仍低于HIBD组(P<0.01)。UCBMC+HBO组觅水时间(111±10 s)较HIBD组及UCBMC组均明显减少(均P<0.01),但仍明显高于对照组(P<0.05);其错误次数(10.8±1.1)较HIBD组及UCBMC组均减少(均P<0.01),但仍明显高于对照组(P<0.05)。见图 3。
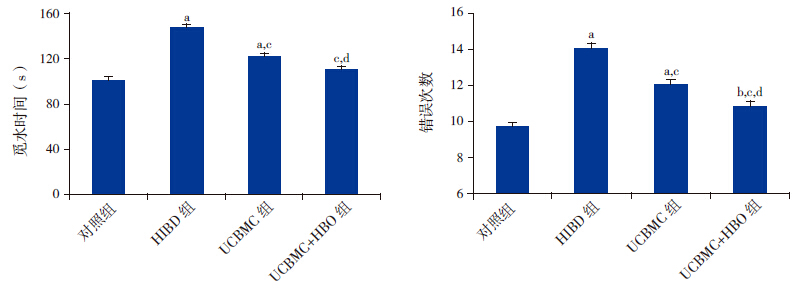 |
图 3各组放射性迷宫实验觅水时间(左)及错误次数(右)比较a示与对照组比较,P<0.01;b示与CON组比较,P<0.05;c示与HIBD组比较,P<0.01;d示与UCBMC组比较,P<0.01。 |
对照组海马CA1区锥体细胞排列整齐,形态规则,尼氏体呈大颗粒,且数量较多;而 HIBD组损伤侧海马CA1区锥体细胞排列不整齐,形态不规则,神经元数目明显低于对照组(P<0.01);UCBMC组损伤侧海马CA1区锥体细胞排列较整齐,神经元数目高于 HIBD组(P<0.01),但仍低于对照组(P<0.01);UCBMC+HBO组损伤侧海马CA1区锥体细胞胞浆中尼氏体清晰可见,神经元数目显著多于UCBMC组(P<0.05)及HIBD组(P<0.01),但仍低于对照组(P<0.05)。见图 4。
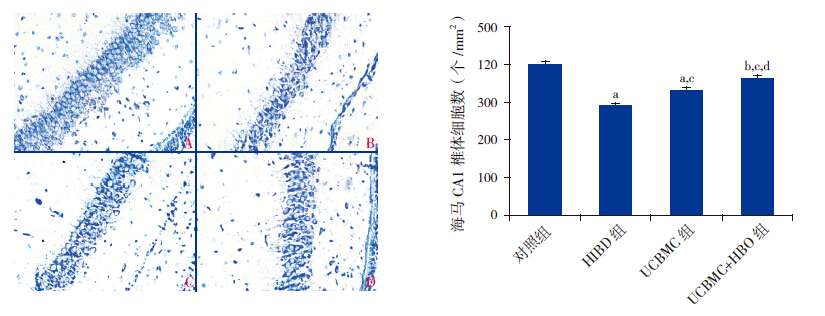 |
图 4各组损伤侧海马CA1 区锥体细胞数比较左图为尼氏染色图(×400):A:对照组;B:HIBD组;C:VCBMC组;D:VCBMC+HBD组。右图为统计图:a示与对照组比较,P<0.01;b示与对照组比较,P<0.05;c示与HIBD组比较,P<0.01;d示与UCBMC组比较,P<0.05。 |
近年来多数研究表明新生儿缺氧缺血后急性炎症反应是导致HIBD的重要原因,减轻炎症反应是HIBD治疗的关键所在。UCBMC含有许多未成熟的干细胞,不仅具有自我更新与向神经细胞分化的潜能,而且可以减轻炎症反应[11]。IL-1β、TNF-α与新生儿缺氧缺血后炎症反应的发生密切相关,本研究发现HIBD新生大鼠IL-1β、TNF-α蛋白表达明显增加,这与文献报道一致[12],而 UCBMC移植后 IL-1β、TNF-α蛋白表达降低,但仍高于对照组,提示UCBMC可减轻炎症反应,但不能完全抑制HIBD新生大鼠的炎症反应。另外本研究发现UCBMC可以改善HIBD大鼠的远期行为学及组织学损伤,但不能完全治愈HIBD,因此,寻求一种新的治疗方案改善UCBMC的治疗效果是本研究的重点。
HBO用于治疗新生儿HIBD已有多年的历史,研究发现 HBO治疗可减轻损伤脑组织的免疫炎症反应[13, 14],改善脑内微环境促进细胞移植,本研究采用UCBMC联合HBO治疗HIBD,发现UCBMC+HBO组大鼠脑内IL-1β、TNF-α蛋白的表达明显低于HIBD组与UCBMC组,说明UCBMC联合HBO治疗显著优于单纯UCBMC治疗。同时本研究还发现UCBMC与UCBMC联合HBO组均可显著改善HIBD大鼠的远期行为学,且HBO联合UCBM治疗的疗效显著高于单纯UCBMC组;尼氏染色结果也提示UCBMC联合HBO治疗可减轻海马CA1区锥体细胞损伤,促进组织修复,其疗效优于单纯UCBMC治疗。
综上,UCBMC联合HBO治疗可抑制HIBD新生大鼠IL-1β、TNF-α蛋白的表达,促进HIBD大鼠损伤侧海马锥体细胞的修复并改善其远期行为学,优于单纯UCBMC移植,有望成为HIBD治疗的新方案。但是由于经费所限,本研究未设计单纯HBO治疗组,亦未进行单纯HBO治疗组与UCBMC+HBO组的比较,因此,关于是否UCBMC联合HBO治疗优于单纯HBO治疗有待于进一步研究。
| [1] | Gill MB, Bockhorst K, Narayana P, et al. Bax shuttling after neonatal hypoxia-ischemia: hyperoxia effects[J]. J Neurosci Res, 2008, 86(16): 3584-3604. |
| [2] | Wang XL, Zhao YS, Hu MY, et al. Umbilical cord blood cells regulate endogenous neural stem cell proliferation via hedgehog signaling in hypoxic ischemic neonatal rats[J]. Brain Res, 2013, 1518: 26-35. |
| [3] | Yang YJ, Wang XL, Yu XH, et al. Hyperbaric oxygen induces endogenous neural stem cells to proliferate and differentiate in hypoxic-ischemic brain damage in neonatal rats[J]. Undersea Hyperb Med, 2008, 35(2): 113-129. |
| [4] | Wang Y, Zhang S, Luo M, et al. Hyperbaric oxygen therapy improves local microenvironment after spinal cord injury[J]. Neural Regen Res, 2014, 9(24): 2182-2188. |
| [5] | Qian L, Shen J, Zhao D, et al. Successful treatment of hemorrhagic cystitis after HLA-mismatched allogeneic hematopoietic stem cell transplantation by hyperbaric oxygen[J]. Transplantation, 2014, 97(7): e41-e42. |
| [6] | 王晓莉, 赵岩松, 徐敏, 等. 脐血单个核细胞移植对HIBD新生大鼠内源性神经干细胞的影响[J]. 中华小儿外科杂志, 2010, 31(1): 63-65. |
| [7] | Rice JE, Vannucci RC, Brierley JB. The influence of immaturity on hypoxic-ischemic brain damage in the rat[J]. Ann Neurol, 1981, 9(2): 131-141. |
| [8] | 王晓莉, 杨于嘉, 谢岷, 等. 高压氧治疗促进HIBD新生大鼠内源性神经干细胞的迁移与分化[J]. 中国当代儿科杂志, 2009, 11(9): 749-752. |
| [9] | Wang X, Zhang J, Si D, et al. Progesterone inhibits the expression of cycloxygenase-2 and interleukin-1β in neonatal rats with hypoxic ischemic brain damage[J]. Int J Neurosci, 2014, 124(1): 42-48. |
| [10] | Wang XL, Zhao YS, Yang YJ, et al. Therapeutic window of hyperbaric oxygen therapy for hypoxic-ischemic brain damage in newborn rats[J]. Brain Res, 2008, 1222: 87-94. |
| [11] | Zhu Y, Guan YM, Huang HL, et al. Human umbilical cord blood mesenchymal stem cell transplantation suppresses inflammatory responses and neuronal apoptosis during early stage of focal cerebral ischemia in rabbits[J]. Acta Pharmacol Sin, 2014, 35(5): 585-591. |
| [12] | Stigger F, Lovatel G, Marques M, et al. Inflammatory response and oxidative stress in developing rat brain and its consequences on motor behavior following maternal administration of LPS and perinatal anoxia[J]. Int J Dev Neurosci, 2013, 31(8): 820-827. |
| [13] | Chen LF, Tian YF, Lin CH, et al. Repetitive hyperbaric oxygen therapy provides better effects on brain inflammation and oxidative damage in rats with focal cerebral ischemia[J]. J Formos Med Assoc, 2014, 113(9): 620-628. |
| [14] | Lee YS, Chio CC, Chang CP, et al. Long course hyperbaric oxygen stimulates neurogenesis and attenuates inflammation after ischemic stroke[J]. Mediators Inflamm, 2013, 2013: 512978. |
 2015, Vol. 17
2015, Vol. 17


