2. 复旦大学分子医学教育部重点实验室, 上海 200032
活产婴儿中先心病的发病率为4‰~10‰,其中瓣膜发育缺损约占20%~30%[1]。瓣膜发育缺损常见于一些特定的染色体或基因缺陷导致的综合征类疾病,如:21三体综合征、Noonan综合征、Marfan综合征、Williams综合征以及Holt-Oram综合征等,也可与其他类型的先天性心脏缺损并存,如:法洛四联症,先天性左心发育不良,三尖瓣下移畸形等[2]。胚胎期心脏瓣膜的发育过程是一个受多种信号通路、转录因子及环境因素共同调控的协奏曲,其中经典Wnt信号通路作为调控细胞增殖、分化和迁移的普遍途径,对于瓣膜正常结构的发育及功能的维持起着至关重要的作用[3, 4]。
Wnt信号通路主要包括经典的Wnt/β-连环蛋白(β-catenin)信号通路,细胞骨架相关的Wnt/PCP通路和钙离子相关的Wnt/Ca2++通路。其中经典Wnt信号通路在进化中高度保守,被认为广泛调控器官发育,组织发生及多种干/前体细胞的行为和功能,是心脏发育中的关键调控因子[5]。经典Wnt信号通路是Wnt蛋白通过与Frizzled(FzD)家族特异受体和LRP5/LRP6辅助受体结合,触发细胞内的信号转导,使β-catenin聚集的级联反应过程。当Wnt蛋白缺乏时,β-catenin与糖原合酶激酶3β(glycogen synthase kinase-3β,GSK-3β)、肿瘤抑制基因(adenomatous polyposis coli,APC)、Axin蛋白组成的降解复合体结合,结合后β-catenin发生磷酸化,与E3泛素连接酶结合并发生泛素化进而被蛋白酶体降解。Wnt蛋白存在时,与细胞膜上的FzD受体结合后激活Dvl(Dishevelled),Axin蛋白被结合到细胞膜表面,β-catenin降解复合体解聚,胞浆中游离β-catenin大量转入细胞核内与转录因子TCF/LEF1结合,激活下游基因的表达[6]。已有的综述已系统概述了Wnt信号通路在心肌细胞发育过程中的时效性作用:在胚胎发育早期,激活的Wnt/β-catenin通路诱导生心中胚层的分化以及心脏前体细胞的增殖;而在心脏发育后期,为维持心脏正常形态,Wnt/β-catenin通路出现下调;此外Wnt信号通路在维持终末分化细胞(如心肌细胞)的数目、形态和功能稳定方面也有调节功能[7, 8, 9]。然而近年来的一些报道显示,经典Wnt信号通路在脊椎动物心脏瓣膜发育过程中同样具有多面性和时效性。对此本文将分两个方面对相关的文献进行综述:(1)Wnt信号通路在瓣膜发育各阶段中的功能作用及其与其他通路之间的相互关系;(2)Wnt信号通路对发育后期/成体瓣膜间充质干细胞的调控和意义。 1 心脏瓣膜发育过程及Wnt信号通路在各个阶段中的作用
瓣膜发育可分为三个阶段:(1)内皮-间充质转化过程以及心内膜垫形成;(2)心内膜垫及瓣膜原基的生长;(3)瓣膜细胞的分化成熟[10]。在心脏发育早期,原始心管仅由外部的心肌层与内部的心内膜层组成,其间充斥着细胞外基质及心胶质。胚胎期心脏瓣膜发育始于心脏房室管(atrioventricular canal,AVC)中心内膜垫的形成以及原始环化心管流出道(outflow tract,OFT)的形成。原始心管形成后不久,AVC和OFT区域的部分内皮细胞可转化为间充质细胞,称为内皮-间充质转化(endothelial-to-mesenchymal transition,EndMT),该过程包括心内膜细胞从房室管的心内膜脱离、侵入细胞外基质,以及获得间充质细胞的表型,与上皮细胞向间充质细胞转化(epithelial-mesenchymal transition,EMT)的过程类似,可以被认为是特殊类型的EMT[11]。一些信号通路如VEGF、Notch、BMP、Wnt以及某些转录因子如TGF-β等都参与了该过程的调控(第一阶段)(图 1)[12]。随后,心内膜垫及瓣膜原基细胞不断增殖,瓣膜不断延伸生长(第二阶段)。最后,瓣膜细胞分化成熟,心内膜垫经重塑发生形态改变,在房室管中将发育成二尖瓣和三尖瓣,在心室流出道处发育成主动脉瓣和肺动脉瓣(第三阶段)。
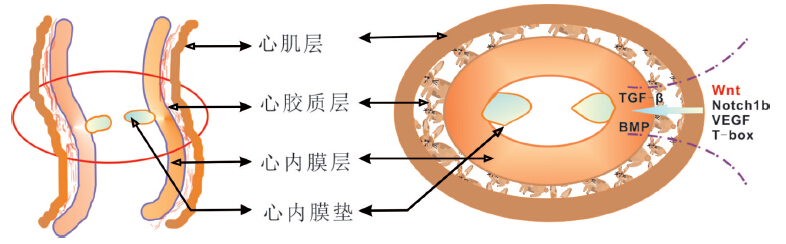 |
图 1 房室管区心内膜垫的结构示意图 心肌细胞分泌TGF-β、BMP 等分子诱导房室管及流出道处的心内膜细胞发生内皮-间充质转化过程,心内膜细胞转化为间充质细胞并侵入到心胶质,这些移行的细胞随后增殖形成心内膜垫。在随后的发育过程中,心内膜垫经重塑发生形态改变,在房室管将发育成二尖瓣和三尖瓣,在心室流出道处发育成主动脉瓣和肺动脉瓣。 |
Wnt可以直接激活并诱导EndMT转化过程,也可以协同TGF-β、BMP、VEGF、Notch等信号通路共同促进心内膜垫的形成和发育。
Liebner等[13]在体外培养小鼠胚胎或房室管移植物的过程中发现,心内膜中若缺乏活化的β-catenin,TGF-β对EndMT过程的诱导作用就会受到抑制,最终导致心脏环化异常,瓣膜发育不良并出现血液反流。相反当β-catenin降解复合体的重要组分APC或分泌型Wnt通路抑制因子Dickkopf1(Dkk1)活性降低时,由于β-catenin的积累则可增强EndMT过程,并且核中定位的β-catenin以及Wnt活性均随瓣膜基因表达水平的提高而明显增加[14]。证实了EndMT的启动需要β-catenin或TCF/Lef转录因子的参与。
此前的研究证实,心脏环化时期Wnt信号通路可通过诱导房室管区域的心肌细胞表达BMP和Tbx2来进一步诱导EMT的发生[15]。Bmp4是第二生心区Wnt/β-Catenin通路下游的靶基因,在β-Catenin缺失突变的小鼠心脏中Bmp4的表达也会相应下调[16]。近来Wang等[17]则提出,心内膜层和心肌层之间存在Notch-Wnt-BMP调控轴,对于EndMT的启动起到非常关键的作用。其中Notch1-Jagged1通路在心脏瓣膜发育中的作用也早已明确,该通路的功能缺失会引起许多先天性心脏病的产生,包括Alagille 综合征、二叶氏主动脉瓣、心脏瓣膜的钙化以及室间隔缺损等[18]。Wang等[17]指出心内膜中Notch1-Jagged1通路水平下降会抑制Wnt4的表达,进而抑制心肌层中Bmp2 的表达水平;若在体外培养失去Notch活性的小鼠胚胎房室管移植物中添加外源性Wnt4 或Bmp2,就可以挽救因缺失Notch活性而导致的EndMT障碍,而Wnt4的挽救功能也需要Bmp2辅助完成。
某些转录因子也参与了Wnt信号通路对心内膜垫EMT过程的启动作用,其中主要有TGF-β、Snail超家族[11]。TGF-β属于肽类生长因子超家族,可以调控多种发育过程,如细胞生长、增殖、分化、迁移、粘着、胞外基质构成等等[19]。TGF-β属于最早启动心内膜垫EndMT过程的因子之一,Liebner等[13]也证实,小鼠房室管心内膜垫的EMT过程中,TGF-β的活性与β-catenin的活性息息相关。Snail超家族是一类具有锌指结构的转录因子,包括Snail(Snail1)和Slug(Snail2),可以触发胚胎发育以及肿瘤发生中的EMT过程[11, 20, 21]。von Gise等[22]通过Wnt1基因敲除的小鼠降低Wnt/β-catenin信号通路中Lef1和β-catenin的表达,发现Wnt下游信号分子Axin2、Cyclin D1和Cyclin D2的含量也相应减少,从而减少SNAIL及SLUG的表达量,抑制EndMT。
近来发现一些组蛋白修饰过程也通过Wnt信号通路参与心脏发育过程中的细胞迁移、增殖和分化等。之前Just等[23]证实,蛋白激酶D(protein kinase D,PKD)可以通过使组蛋白去乙酰化酶(histone deacetylase 5,HDAC5)磷酸化,靶向调控斑马鱼下游与瓣膜发育相关的KLF2a 及KLF4a,来调控房室管瓣膜的形成。而近来Kim等[24]还发现斑马鱼中HDACs可以通过激活Wnt信号通路,进而诱导房室管心肌细胞表达Bmp4、心内皮细胞表达notch1b来促进心内膜垫的形成。 1.2 心内膜垫及瓣膜原基的细胞增殖
在心内膜垫和瓣膜原基的生长延伸过程中,Wnt起诱导间充质细胞增殖的作用。
EndMT过程完成之后,初步形成的心内膜垫和瓣膜原基内部分内皮细胞和间充质干细胞继续增殖,细胞外基质合成增多,在这一过程中经典Wnt信号通路处于活化状态,对于间充质干细胞的增殖具有促进作用[12]。已有研究发现小鼠心内膜垫和瓣膜原基中的内皮细胞会表达Wnt4和Wnt9b,而相应的瓣膜间质细胞中则表达Wnt2、Lef1以及Wnt受体Fzd2[25]。在鸡胚实验中,若外源性给予过多相应的Wnt蛋白如Wnt9a,瓣膜原基中会出现细胞过度增殖的现象;若采用Wnt通路的抑制剂Frzb处理,瓣膜的细胞增殖现象就会受到抑制[26]。同样的,若斑马鱼β-catenin降解复合体的重要组分APC发生基因突变,瓣膜间充质细胞也会出现过度增殖[14]。此外,Tbx20也是影响心内膜垫的形成以及瓣叶的生长延伸的重要因子,它可以直接结合并激活经典Wnt信号通路下游的Lef1转录因子,从而发挥Wnt信号通路的调节功能[27]。 1.3 瓣膜细胞分化和成熟
在内皮细胞包裹瓣膜间质细胞形成瓣叶的过程中,Wnt信号通路主要影响背侧面瓣膜间质细胞的分化,与纤维膜层的形成有关[28]。
受血流动力学影响,瓣叶血流面和背侧面间质细胞的基因表达存在差异,形成房室腔层、海绵体层和纤维层等分层结缔组织[10, 29]。目前的研究表明,纤维层是瓣膜发育重塑过程中Wnt信号通路发挥作用的主要部位[29]。Alfieri等[25]证实,胎鼠E17.5 d房室管瓣膜或主肺动脉瓣膜重塑时会表达Wnt蛋白,包括与骨发育过程相关的Wnt3a及Wnt7b;同时用Wnt3a处理体外培养的鸡胚主动脉瓣膜间质细胞可以表达纤维膜的标志性蛋白—骨膜蛋白和骨粘连蛋白。
由于心脏瓣膜的纤维层中含有较多与骨形成相关的胶原蛋白、骨粘连蛋白、骨膜蛋白等易矿化的结缔组织成分,这些结缔组织成分利于瓣膜在发育过程中顺应血流方向延展,同时也使得纤维层成为瓣膜发育成熟后发生病理性钙化的常见部位[10, 29, 30]。研究表明,一些分泌型Wnt通路的成员如dickkopf-1(DKK-1)的异常调控与主动脉瓣的钙化和狭窄有关[31, 32]。而Tbx20则可通过与Wnt信号通路的转录因子lef1相互作用在瓣膜重塑中发挥作用[27]。因此可以看出,Wnt信号通路对心脏瓣膜纤维结缔层的分化成熟具有一定的调控作用,这对我们探讨和研究某些瓣膜病的发病机制也有一定帮助。
综上所述,Wnt信号通路在心脏瓣膜发育的不同时期均有参与,并与多种信号通路、转录因子以及组蛋白修饰途径之间存在密切联系,是心脏瓣膜发育调控网络中的重要一员。 2 经典Wnt信号通路在发育后期及成体心脏瓣膜间充质干细胞中的活性和功能
转基因技术的发展使得我们可以在脊椎动物模式生物的心脏中直接观察Wnt信号通路的活性变化。Wnt下游的β-catenin/TCF转录因子复合体会特异性结合到含有保守碱基序列的位点上,所以运用含有多个特异性结合位点的启动子片段诱导绿色荧光蛋白EGFP或β半乳糖苷酶LacZ的表达,可以构建出Wnt-reporter报告转基因动物,用于具有Wnt信号活性细胞的标记和追踪。我们在72hpf的Tg(7xTCF-Xla.Siam:GFP)ia4[33]转基因斑马鱼心脏中观察到,绿色荧光蛋白标记的具有Wnt活性的细胞几乎完全集中在房室管瓣膜以及流出道瓣膜区(图 2),这些细胞在成年斑马鱼心脏中也聚集在同样区域,说明发育后期和成体的斑马鱼心脏瓣膜处仍存在具有高度增殖和分化潜能的瓣膜间充质干细胞。有趣的是,我们在E12.5 d的Tg(BAT-LacZ)小鼠[34]心脏中也观察到心脏流出道及其瓣膜间质处也存在具有强Wnt活性的细胞存在(图 3)。近些年来,在斑马鱼及小鼠心脏损伤模型的研究中发现,Wnt信号通路与成年心脏的再生有关,Wnt信号的活性会出现在具有增殖活性或分化潜能的成体细胞中[35, 36]。此外通过对成年猪的心脏瓣膜间质细胞进行培养,发现Wnt3a/β-catenin也可以促进成年猪的心脏中已分化成熟的细胞群—瓣膜间质细胞的增殖[37]。因此Wnt信号通路与瓣膜中细胞的增殖活性有关,但这些细胞的具体分型,以及Wnt信号通路发挥调控作用的生物学意义却不清楚。
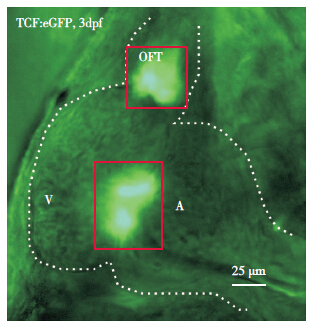 |
图 2 Tg(7xTCF-Xla.Siam GFP)ia4斑马鱼心脏 绿色荧光蛋白标记的具有Wnt活性的细胞几乎全部集中在心脏瓣膜区域(红框分别表示流出道口瓣膜及房室管瓣膜),OFT:流出道,V:心室,A:心房。 |
 |
图 3 Tg(BAT-LacZ)小鼠(E12.5 d)右心室流出道口(X-Gal染色) 蓝色标记具有Wnt活性的细胞(红框表示流出道及流出道口瓣膜)RA:右心房,LA:左心房,RV:右心室,LV:左心室;OFT:流出道。 |
间充质干细胞(mesenchymal stem cells,MSCs)是具有多分化潜能的干细胞或前体细胞,可终分化为不同的中胚层或非中胚层细胞系,包括:骨细胞、脂肪细胞、软骨细胞、肌细胞、心肌细胞、纤维母细胞、肌纤维细胞、上皮细胞以及神经细胞等[38]。瓣膜间质细胞是由心内膜垫中的间充质干细胞分化而来,是心脏瓣膜中的主要细胞类型[39]。通过将人类间充质干细胞(mesenchymal stem cells,MSCs)与瓣膜间质细胞(valve interstitial cell,VICs)的分子表达水平进行对比,发现MSCs中Wnt通路相关基因的表达量远大于VICs,提示Wnt信号通路与MSCs细胞的稳态维持和分化调控密切相关[40]。虽然我们并不确切知道,在发育后期和成体的脊椎动物中,心脏瓣膜区为什么会保留分化程度较低的间充质干细胞,但是可以推测其与心脏瓣膜以及心肌、心内皮的正常更新和稳态维护密切相关,而经典Wnt信号通路则是负责调控这个间充质干细胞库的重要因子之一(图 4)。至于Wnt信号通路的这种作用是否与其在瓣膜早期发育中的功能一致,还需要进一步的研究和比较。
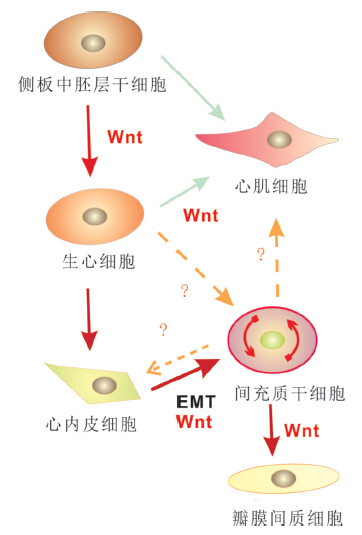 |
图 4 Wnt信号通路在心脏发育各阶段的作用示意图 Wnt介导侧板中胚层生心干细胞的诱导、增殖和分化,并参与瓣膜发育过程中的内皮间充质转化和瓣膜间质细胞的分化成熟,其中Wnt在心脏瓣膜内间充质干细胞的稳态和分化潜能中的作用有待进一步研究。实线箭头表示已有相关研究或文献证明两者存在转化关系;虚线箭头表示两者间可能存在转化关系,需进一步验证。 |
| [1] | Pierpont ME, Basson CT, Benson DJ, et al. Genetic basis for congenital heart defects: current knowledge: a scientific statement from the American Heart Association Congenital Cardiac Defects Committee, Council on Cardiovascular Disease in the Young: endorsed by the American Academy of Pediatrics[J]. Circulation, 2007, 115(23): 3015-3038. |
| [2] | Lincoln J, Yutzey KE. Molecular and developmental mechanisms of congenital heart valve disease[J]. Birth Defects Res A Clin Mol Teratol, 2011, 91(6): 526-534. |
| [3] | Lin CJ, Lin CY, Chen CH, et al. Partitioning the heart: mechanisms of cardiac septation and valve development[J]. Development, 2012, 139(18): 3277-3299. |
| [4] | Tanaka SS, Kojima Y, Yamaguchi YL, et al. Impact of WNT signaling on tissue lineage differentiation in the early mouse embryo[J]. Dev Growth Differ, 2011, 53(7): 843-856. |
| [5] | Piven' OO, Pal'Chevs'ka OL, Lukash LL, et al. The Wnt/beta-catenin signaling in embryonic cardiogenesis, postnatal development and myocardium reconstruction[J]. Tsitol Genet, 2014, 48(5): 72-83. |
| [6] | von Maltzahn J, Chang NC, Bentzinger CF, et al. Wnt signaling in myogenesis[J]. Trends Cell Biol, 2012, 22(11): 602-609. |
| [7] | Gessert S, Kuhl M. The multiple phases and faces of Wnt signaling during cardiac differentiation and development[J]. Circ Res, 2010, 107(2): 186-199. |
| [8] | Dohn TE, Waxman JS. Distinct phases of Wnt/beta-catenin signaling direct cardiomyocyte formation in zebrafish[J]. Dev Biol, 2012, 361(2): 364-376. |
| [9] | Lian X, Hsiao C, Wilson G, et al. Robust cardiomyocyte differentiation from human pluripotent stem cells via temporal modulation of canonical Wnt signaling[J]. Proc Natl Acad Sci U S A, 2012, 109(27): E1848-E1857. |
| [10] | Combs MD, Yutzey KE. Heart valve development: regulatory networks in development and disease[J]. Circ Res, 2009, 105(5): 408-421. |
| [11] | von Gise A, Pu WT. Endocardial and epicardial epithelial to mesenchymal transitions in heart development and disease[J]. Circ Res, 2012, 110(12): 1628-1645. |
| [12] | de Vlaming A, Sauls K, Hajdu Z, et al. Atrioventricular valve development: new perspectives on an old theme[J]. Differentiation, 2012, 84(1): 103-116. |
| [13] | Liebner S, Cattelino A, Gallini R, et al. Beta-catenin is required for endothelial-mesenchymal transformation during heart cushion development in the mouse[J]. J Cell Biol, 2004, 166(3): 359-367. |
| [14] | Hurlstone AF, Haramis AP, Wienholds E, et al. The Wnt/beta-catenin pathway regulates cardiac valve formation[J]. Nature, 2003, 425(6958): 633-637. |
| [15] | Verhoeven MC, Haase C, Christoffels VM, et al. Wnt signaling regulates atrioventricular canal formation upstream of BMP and Tbx2[J]. Birth Defects Res A Clin Mol Teratol, 2011, 91(6): 435-440. |
| [16] | Klaus A, Saga Y, Taketo MM, et al. Distinct roles of Wnt/beta-catenin and Bmp signaling during early cardiogenesis[J]. Proc Natl Acad Sci U S A, 2007, 104(47): 18531-18536. |
| [17] | Wang Y, Wu B, Chamberlain AA, et al. Endocardial to myocardial notch-wnt-bmp axis regulates early heart valve development[J]. PLoS One, 2013, 8(4): e60244. |
| [18] | Chang AC, Fu Y, Garside VC, et al. Notch initiates the endothelial-to-mesenchymal transition in the atrioventricular canal through autocrine activation of soluble guanylyl cyclase[J]. Dev Cell, 2011, 21(2): 288-300. |
| [19] | 徐娜, 李朝军. 心脏瓣膜发育早期EMT过程的信号调控[J]. 细胞生物学杂志, 2009, 31(3): 297-306. |
| [20] | Casanova JC, Travisano S, de la Pompa JL. Epithelial-to-mesenchymal transition in epicardium is independent of Snail1[J]. Genesis, 2013, 51(1): 32-40. |
| [21] | Lin Y, Li XY, Willis AL, et al. Snail1-dependent control of embryonic stem cell pluripotency and lineage commitment[J]. Nat Commun, 2014, 5: 3070. |
| [22] | von Gise A, Zhou B, Honor LB, et al. WT1 regulates epicardial epithelial to mesenchymal transition through beta-catenin and retinoic acid signaling pathways[J]. Dev Biol, 2011, 356(2): 421-431. |
| [23] | Just S, Berger IM, Meder B, et al. Protein kinase D2 controls cardiac valve formation in zebrafish by regulating histone deacetylase 5 activity[J]. Circulation, 2011, 124(3): 324-334. |
| [24] | Kim YS, Kim MJ, Koo TH, et al. Histone deacetylase is required for the activation of Wnt/beta-catenin signaling crucial for heart valve formation in zebrafish embryos[J]. Biochem Biophys Res Commun, 2012, 423(1): 140-146. |
| [25] | Alfieri CM, Cheek J, Chakraborty S, et al. Wnt signaling in heart valve development and osteogenic gene induction[J]. Dev Biol, 2010, 338(2): 127-135. |
| [26] | Person AD, Garriock RJ, Krieg PA, et al. Frzb modulates Wnt-9a-mediated beta-catenin signaling during avian atrioventricular cardiac cushion development[J]. Dev Biol, 2005, 278(1): 35-48. |
| [27] | Cai X, Zhang W, Hu J, et al. Tbx20 acts upstream of Wnt signaling to regulate endocardial cushion formation and valve remodeling during mouse cardiogenesis[J]. Development, 2013, 140(15): 3176-3187. |
| [28] | Kruithof BP, Krawitz SA, Gaussin V. Atrioventricular valve development during late embryonic and postnatal stages involves condensation and extracellular matrix remodeling[J]. Dev Biol, 2007, 302(1): 208-217. |
| [29] | Freeman RV, Otto CM. Spectrum of calcific aortic valve disease: pathogenesis, disease progression, and treatment strategies[J]. Circulation, 2005, 111(24): 3316-3326. |
| [30] | Miller JD, Weiss RM, Serrano KM, et al. Evidence for active regulation of pro-osteogenic signaling in advanced aortic valve disease[J]. Arterioscler Thromb Vasc Biol, 2010, 30(12): 2482-2486. |
| [31] | Gu GJ, Chen T, Zhou HM, et al. Role of Wnt/beta-catenin signaling pathway in the mechanism of calcification of aortic valve[J]. J Huazhong Univ Sci Technolog Med Sci, 2014, 34(1): 33-36. |
| [32] | Askevold ET, Gullestad L, Aakhus S, et al. Secreted Wnt modulators in symptomatic aortic stenosis[J]. J Am Heart Assoc, 2012, 1(6): e2261. |
| [33] | Moro E, Ozhan-Kizil G, Mongera A, et al. In vivo Wnt signaling tracing through a transgenic biosensor fish reveals novel activity domains[J]. Dev Biol, 2012, 366(2): 327-340. |
| [34] | Maretto S, Cordenonsi M, Dupont S, et al. Mapping Wnt/beta-catenin signaling during mouse development and in colorectal tumors[J]. Proc Natl Acad Sci U S A, 2003, 100(6): 3299-3304. |
| [35] | Hoage T, Sun X, Xu X. Functions of the Wnt/beta-catenin pathway in an anemia-induced zebrafish model of cardiomyopathy are location dependent[J]. Biochem Biophys Res Commun, 2011, 415(3): 490-496. |
| [36] | Duan J, Gherghe C, Liu D, et al. Wnt1/betacatenin injury response activates the epicardium and cardiac fibroblasts to promote cardiac repair[J]. EMBO J, 2012, 31(2): 429-442. |
| [37] | Xu S, Gotlieb AI. Wnt3a/beta-catenin increases proliferation in heart valve interstitial cells[J]. Cardiovasc Pathol, 2013, 22(2): 156-166. |
| [38] | Galli D, Vitale M, Vaccarezza M. Bone marrow-derived mesenchymal cell differentiation toward myogenic lineages: facts and perspectives[J]. Biomed Res Int, 2014, 2014: 762695. |
| [39] | Shin SH, Lee S, Bae JS, et al. Thymosin beta4 regulates cardiac valve formation via endothelial-mesenchymal transformation in zebrafish embryos[J]. Mol Cells, 2014, 37(4): 330-336. |
| [40] | Latif N, Sarathchandra P, Thomas PS, et al. Characterization of structural and signaling molecules by human valve interstitial cells and comparison to human mesenchymal stem cells[J]. J Heart Valve Dis, 2007, 16(1): 56-66. |
 2015, Vol. 17
2015, Vol. 17

