2. 泰安市中心医院儿科, 山东 泰安 271000
过敏性紫癜(Henoch-Schönlein purpura,HSP)是一种以小血管为主要病变的变态反应性疾病,2012年6月欧洲风湿病年会将HSP更名为IgA血管炎,分类上隶属于小血管炎下的免疫复合物性血管炎。HSP为儿童常见病,近年来发病率逐年增加,但其确切的发病机制迄今尚未完全清楚[1]。目前认为HSP的发病非单一因素所致,在环境因素、个体遗传等作用下,机体出现细胞和体液免疫功能紊乱,产生多种细胞因子、炎症介质、抗体等,抗体、补体和纤维蛋白原等沉积于肾小球系膜、皮肤和肠道小血管,导致小血管结构异常和损伤,进而可引起血液高凝状态及局部微血栓形成等。其中细胞因子是HSP发病中重要的因素之一[2]。高迁移率族蛋白1(high mobilitygroup protein box1,HMGB1)是一种新型的炎性细胞因子,具有强大的致炎作用,介导免疫炎症反应的发生和发展。研究发现HMGB1参与了类风湿性关节炎、系统性红斑狼疮等多种自身免疫性疾病的发生和发展[3]。目前国内甘世伟等[4]报道了HSP患儿HMGB1表达较对照儿童增高,且伴有肾损害、消化道症状、关节症状等的患儿与无上述症状患儿相比表达有明显差异;Chen等[5]研究提示HMGB1可能通过诱导肿瘤坏死因子α和白细胞介素(interleukin,IL)-6参与HSP的发病机制。超敏C反应蛋白(high-sensitivity C-reactive protein,hs-CRP)是使用高敏感的检测方法检测到的低浓度的CRP,在过敏性紫癜急性期CRP等反映炎症的指标可增高。D-二聚体(D-dimer,D-D )是反映机体高凝状态和继发性纤溶的分子标志物之一。本研究通过检测HSP患儿血HMGB1、hs-CRP、D-D的表达水平,分析HMGB1 与hs-CRP、D-D的相关性,旨在进一步探讨HMGB1在儿童HSP发病过程中的作用。 1 资料与方法 1.1 研究对象
采用病例对照研究,选择HSP患儿以及健康对照儿童作为研究对象。HSP组入选标准:(1)符合儿童HSP诊断标准[6];(2)初次发病的患儿,病程在3 d内;(3)近4周内未使用任何糖皮质激素或细胞毒性药物,采血前24 h未使用任何药物;(4)除外伴有其他儿内科疾病者或HSP暂不能确诊者。以同期健康体检儿童为对照组,对照组入选标准:(1)年龄、性别与HSP 患儿相匹配;(2)既往无过敏性疾病病史;(3)近4周内未使用任何糖皮质激素或细胞毒性药物,采血前24 h未使用任何药物。本研究经我院医学伦理委员会批准,所有受试对象家长均知情同意。40例HSP患儿纳入本研究,其中男23例,女17例,平均年龄7.4±2.1岁(范围3~12岁)。对照组纳入30例,其中男17例,女13例,平均年龄7.2±2.0岁(范围4~11岁)。两组儿童的年龄、性别差异无统计学意义(分别t=0.461,P=0.646;χ2=0.005,P=0.944)。40例HSP 患儿中,12例合并肾损害,28例随访半年未发现肾损害。 1.2 标本采集
HSP患儿入院当日或次日清晨采集空腹外周静脉血2 mL,对照组于体检日采集空腹外周静脉血2 mL,离心取血清,-20℃冰箱保存待测HMGB1含量。同时分别用临床免疫管和血凝管采集外周血测定hs-CRP和D-D含量。 1.3 血清HMGB1的检测
采用酶联免疫吸附法检测血清HMGB1的水平,试剂盒购自上海百沃科技有限公司,按照仪器操作规程和试剂盒说明书要求进行,严格质量控制,减少误差。以标准品浓度作为横坐标,OD值作为纵坐标,绘制标准曲线,得出标准方程,根据标准方程计算出每个样本的浓度。 1.4 血hs-CRP和D-D含量的检测
应用全自动生化分析仪检测血清hs-CRP,采用全自动血凝分析仪检测血浆D-D,严格按照操作程序完成定标和检测,同时进行室内质量控制。血清hs-CRP正常参考值0~8.83 mg/L,血浆D-D为0~500 mg/L。 1.5 统计学分析
采用SPSS 17.0统计软件进行统计学分析。计量资料以均数±标准差(x±s)表示,两组间均数的比较采用成组t检验。计数资料以例数和百分率表示,组间比较采用卡方检验。采用Pearson进行参数间的相关性分析。P<0.05 为差异有统计学意义。 2 结果 2.1 两组儿童血HMGB1、hs-CRP及D-D含量的比较
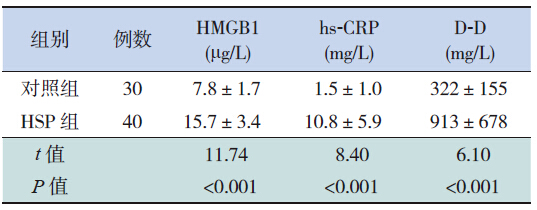
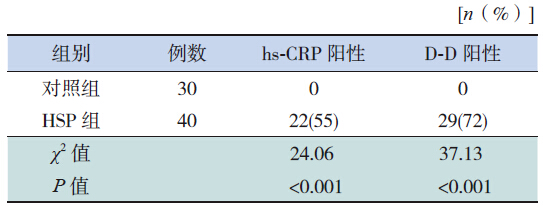
HSP组急性期血HMGB1、hs-CRP、D-D含量均较对照组增高,差异有统计学意义,见表 1。以血hs-CRP>8.83 mg/L和D-D>500 mg/L作为阳性判断结果,则HSP 组血hs-CRP和D-D阳性率明显高于对照组(均P<0.05),见表 2。
| 表 1 HSP组和对照组血HMGB1、hs-CRP及D-D含量的比较(x±s) |
| 表 2 HSP组和对照组血hs-CRP和D-D阳性率的比较 |
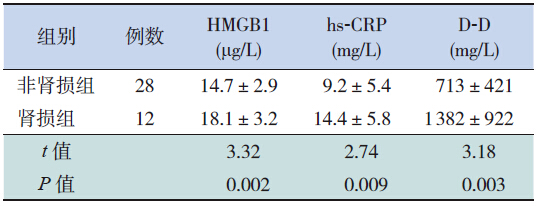
伴肾损害组HSP患儿血HMGB1、hs-CRP、D-D含量较无肾损害组患儿增高,差异均有统计学意义(均P<0.05),见表 3。
| 表 3 伴或不伴肾损害HSP儿童HMGB1、hs-CRP、D-D含量的比较(x±s) |
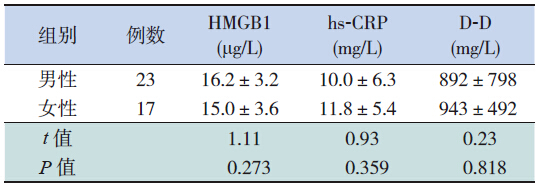
男性HSP患儿血HMGB1平均含量较女性患儿稍高,hs-CRP、D-D平均含量较女性患儿稍低,但差异均无统计学意义(均P>0.05),见表 4。
| 表 4 不同性别HSP患儿HMGB1、hs-CRP及D-D检测结果的比较(x±s) |
HSP患儿血HMGB1与hs-CRP、D-D均呈正相关( 分别r=0.878、0.625,均P<0.001);hs-CRP与D-D呈正相关(r=0.622,P<0.001)。 3 讨论
HMGB1作为一种核内非组蛋白被发现,在细胞内参与DNA的复制、转录、翻译和修复等过程,在细胞外,具有细胞因子的功能,具有强大的致炎作用。同时也可作为内源性损伤相关的分子模式激活抗原提呈细胞,参与T、B淋巴细胞的分化、成熟和活化,从而参与多种疾病发生和发展[7, 8]。研究证实HMGB1能活化单核巨噬细胞、中性粒细胞等多种炎症细胞,促进一系列细胞因子和炎性因子如IL-1、IL-6、IL-8、基质金属蛋白酶等大量释放[8, 9];反之,许多炎症介质,如肿瘤坏死因子(TNF)α、脂多糖、IL-1等,能促使单核巨噬细胞、中性粒细胞等加速表达和分泌HMGB1,如此恶性循环,触发瀑布式的炎症反应[10, 11, 12]。近年研究认为HMGB1可通过调节凝血酶-血栓调节蛋白复合物、结合组织型纤溶蛋白酶原和纤溶酶原等影响凝血和纤溶系统,具有促进血栓形成和激活纤溶防治血栓形成的双重作用[13]。HMGB1在癌症、感染性疾病、免疫性疾病、动静脉血栓、动脉粥样硬化等发生和发展中都起了重要作用[13, 14]。
hs-CRP敏感性和特异性均较CRP高,已成为临床检测的炎症标志物[15]。本研究结果显示HSP组hs-CRP水平显著高于对照组,以阳性率来统计,对照组无一例阳性,hs-CRP阳性率达55%,与有关文献报道一致[16]。新近研究表明CRP本身也是促炎症介质,可直接参与炎症过程,其水平高低与炎症反应的程度有关[17, 18]。以上研究结果提示,HSP患儿体内高浓度的hs-CRP可损伤血管内皮细胞,直接参与患儿的小血管炎症反应。D-D升高或阳性反映了凝血和纤溶系统的双重激活,临床上广泛用于机体高凝状态的检测。Yilmaz等[19]研究认为D-D可作为HSP高凝状态标志物。本研究结果表明HSP组D-D阳性率明显高于对照组,测定的浓度也明显高于对照组,提示HSP患儿存在高凝状态,与已有的文献报道一致[20, 21]。可能原因为HSP病理变化是以毛细血管炎为主的广泛的小血管炎、血管内皮细胞损伤、肿胀,病变累及部位均可有微血栓形成和继发性纤溶。本研究发现有肾损害组血hs-CRP和D-D含量均明显高于非肾损害组,提示hs-CRP和D-D增高明显者更易出现肾损害。
本研究通过检测HMGB1在HSP儿童中的表达,研究其与hs-CRP、D-D的相关性来研究HSP在儿童HSP中的作用。本研究结果显示,HSP组HMGB1血清水平较对照组明显增高,同时研究发现肾损害组HMGB1血清水平较非肾损害组明显增高。既往发现在HSP发病中,有多种细胞因子的参与,TNF-α、IL-2、IL-4、IL-6、IL-10、IL-26、IL-28、血管内皮生长因子、转化生长因子-β等均可能是HSP及HSP肾炎发病的重要原因[2, 22]。本研究结果提示HMGB1 可能参与了儿童HSP及HSP肾损害的发病,HMGB1增高程度高者更易发生肾损害。相关分析表明HSP患儿血清HMGB1与hs-CRP、D-D均呈正相关;hs-CRP 与D-D呈正相关,因此推测HMGB1参与了HSP的血管炎症反应。HMGB1高者可间接反映HSP患儿存在血液的高凝状态,主要机制可能是HMGB1通过活化多种免疫炎症细胞,与多种细胞因子交互作用,破坏免疫平衡引起免疫紊乱、触发和加重炎症反应,引起全身小血管的损伤和炎症,而血管炎症和损害加之HMGB1本身对凝血功能的影响等可致微血栓形成,进而活化纤溶系统。近年研究认为HMGB1可作为治疗的靶点来干预多种免疫相关疾病[23],我们拟进一步研究HMGB1参与HSP发病的分子机制,研究不同病程及药物干预下的表达等,为HMGB1治疗免疫性疾病的临床应用提供理论基础。
| [1] | Rigante D, Castellazzi L, Bosco A, et al. Is there a crossroad between infections, genetics, and Henoch-Schönlein purpura?[J]. Autoimmun Rev, 2013, 12(10): 1016-1021. |
| [2] | 余艳红, 潘凯丽. 细胞因子在过敏性紫癜性肾炎发病机制中的作用[J].中国当代儿科杂志, 2009, 11 (10): 869-872. |
| [3] | 潘舒月, 青玉凤,周京国.高迁移率族蛋白B1: 自身免疫性疾病重要炎性分子[J/CD].中华临床免疫和变态反应杂志(电子版),2013, 7(2): 198-202. |
| [4] | 甘世伟, 赵林胜, 王燕. HMGB1在过敏性紫癜患儿血清中的表达及临床意义[J]. 重庆医科大学学报, 2014, 39(12): 1767-1770. |
| [5] | Chen T, Guo ZP, Wang WJ, et al. Increased serum HMGB1 levels in patients with Henoch-Schönlein purpura[J]. Exp Dermatol, 2014, 23(6): 419-423. |
| [6] | 中华医学会儿科学分会免疫学组《中华儿科杂志》编辑委员会.儿童过敏性紫癜循证诊治建议[J].中华儿科杂志, 2013, 51(7): 502-507. |
| [7] | Huang W, Tang Y, Li LH. MGB1, a potent proinflammatory cytokine in sepsis[J]. Cytokine, 2010, 51(2): 119-126. |
| [8] | Yang H, Tracey KJ. Targeting HMGB1 in inflammation[J]. Biochim Biophys Acta, 2010, 1799(1-2): 149-156. |
| [9] | Venereau E, Schiraldi M, Uguccioni M, et al. HMGB1 and leukocyte migration during trauma and sterile inflammation[J]. Mol Immunol, 2013, 55(1): 76-82. |
| [10] | Wang H, Vishnubhakat JM, Bloom O, et al. Proinflammatory cytokines (tumor necrosis factor and interleukin 1) stimulate release of high mobility group protein-1 by pituicytes[J]. Surgery, 1999, 126(2): 389-392. |
| [11] | Beyer C, Stearns NA, Giessl A, et al. The extracellular release of DNA and HMGB1 from Jurkat T cells during in vitro necrotic cell death[J]. Innate Immun, 2012, 18(5): 727-737. |
| [12] | Luo Y, Chihara Y, Fujimoto K, et al. High mobility group box 1 released from necrotic cells enhances regrowth and metastasis of cancer cells that have survived chemotherapy[J]. Eur J Cancer, 2013, 49(3): 741-751. |
| [13] | 刘洋,袁海, 金星. 高迁移率族蛋白B1与周围血管疾病相关性的研究进展[J/CD].中华临床医师杂志(电子版), 2013, 7(13): 6072-6075. |
| [14] | Kang R, Chen R, Zhang Q, et al. HMGB1 in health and disease[J]. Mol Aspects Med, 2014, 40C: 1-116. |
| [15] | Tanaskovic S, Isenovic ER, Radak D. Inflammation as a marker for the prediction of internal carotid artery restenosis following eversion endarterectomy-evidence from clinical studies[J]. Angiology, 2011, 62(7): 535-542. |
| [16] | 周利江,高纯, 蒋天如, 等. 血清Cys-C、ASO、hs-CRP和尿mALB对过敏性紫癜患儿早期肾功能损伤的诊断意义[J].国际检验医学杂志, 2012, 33(23): 2908-2909. |
| [17] | Howren MB, Lamkin DM, Suls J. Associations of depression with C-reactive protein, IL-1, and IL-6: a meta-analysis[J]. Psychosom Med, 2009, 71(2): 171-186. |
| [18] | 李平. 过敏性紫癜肾炎患儿血清hs-CRP, MMP-9的表达意义[J]. 中国实用医药, 2013, 8(3): 10-12. |
| [19] | Yilmaz D, Kavakli K, Ozkayin N. The elevated markers of hypercoagulability in children with Henoch-Schönlein purpura[J]. Pediatr Hematol Oncol, 2005, 22(1): 41-48. |
| [20] | 赵建国.儿童过敏性紫癜血浆D-二聚体纤维蛋白原降解物检测的临床意义及应用[J].中国全科医学, 2010, 13(8C): 2725-2726. |
| [21] | Strizhakov LA, Chegaeva EP, Krivosheev OG, et al. Signs of hypercoagulation and activation of fibrinolysis in patients with Wegeners's granulomatosis and Schoenlein-Genoch's purpura[J]. Klin Med (Mosk), 2012, 90(5): 43-45. |
| [22] | 江华, 丁甫月, 顾龙君. 过敏性紫癜患儿血清IFN-α、IL-2、IL-4、TNF-α水平的变化[J].中国当代儿科杂志, 2002, 4(2): 117-118. |
| [23] | Nogueira-Machado JA, de Oliveira Volpe CM. HMGB-1 as a target for inflammation controlling[J]. Recent Pat Endocr Metab Immune Drug Discov, 2012, 6(3): 201-209. |
 2015, Vol. 17
2015, Vol. 17