过敏性紫癜(Henoch-Schönlein purpura,HSP)是儿童期较为常见的小血管炎,患病率为10/10万~20/10万[1],近年来其发病率有上升的趋势[2],其病因和发病机制迄今尚未完全清楚,但与免疫炎症反应密切相关,近年来研究显示Th17细胞在过敏性紫癜患儿中表达升高[3],但通过怎样的作用机制尚不明确。白介素(interleukin,IL)17是Th7细胞最主要的效应分子,且在HSP患儿中表达升高[4],IL-23在Th17细胞的分化增殖及IL-17的分泌过程中具有重要的作用[5]。IL-23/IL-17轴在多种自身免疫性炎症性疾病的发病机制中具有重要的作用,该轴主要通过影响Th17细胞的活化和增殖来参与炎症性及自身免疫性疾病的发病机制[5, 6],IL-17、IL-23在HSP中的作用尚不清楚。血液灌流(hemoperfusion,HP)作为一种新的方法应用于HSP的治疗,其作用机理为清除炎性介质、抗体及循环免疫复合物,调节并重建免疫平衡。本研究通过检测HSP患儿HP治疗前后外周血IL-17、IL-23的水平变化,探索IL-23/IL-17轴在HSP发病机制中的作用及HP对其表达的影响,进一步阐明HSP的发病机制,深入了解HP治疗HSP的作用机理。 1 资料与方法 1.1 研究对象
选取2011年1月至2012年12月在西安交通大学第一附属医院住院的HSP患儿87例为病例组,其中男51例,女36例,平均年龄8.5±2.9岁;纳入标准:(1)符合HSP的诊断标准[7],(2)为初发病例,(3)发病前1 个月未接受过糖皮质激素和免疫抑制剂等特殊治疗,(4)血小板计数在正常范围内,(5)入院后均行HP治疗,(6)监护人知情同意;剔除标准:(1)血常规显示血小板减少,(2)有其他系统疾病如血液系统疾病、结缔组织病及系统性红斑狼疮等全身性疾病等,(3)其他肾脏疾病,如肾病综合征、IgA肾病等。另选取同期于本院门诊行健康普查,排除既往有HSP、系统性红斑狼疮等疾病史,4周内无感染及过敏史,经体格检查、肝肾功能、尿常规等实验室检查后确定为健康的27例儿童作为对照组,其中男15例,女12例,平均年龄8.5±2.6岁。 1.2 HP操作步骤及适应证
采用HP机为动力装置,普通透析管路及双腔静脉导管留置针连接血管通路。首先依次用5%葡萄糖、含肝素的生理盐水自下而上预冲灌流器和管道。选择将动脉导管与肝素生理盐水连通,开动血泵,排除空气,使灌流器达到充分肝素化,最后使用不含肝素的生理盐水冲入管路、灌流器中,排除其中含肝素的生理盐水。静脉穿刺成功后,灌流前半小时肌肉注射肝素钠60~80单位/kg。连接静脉通路,开动血泵,血流量从50 mL/min 开始,若生命体征平稳,每5 min增加50~80 mL,15~20 min后可增加至150~200 mL/min。灌流结束时用生理盐水或空气回血法将灌流器及管道内的血液输回体内,在灌流中每10~30 min监测血压1次,HP一般2~3 h结束,>3 h后需更换灌流器。HPS患儿一次病程中接受3~5次灌流,连续进行。HP应用于HSP患儿适应证:(1) 确诊为HSP的患儿,(2)实验室检查血小板正常,凝血功能正常,(3)生命体征平稳,无高血压、心脏病等基础疾病。禁忌证:凝血功能异常、高血压、心脏病、对灌流器过敏者。 1.3 血标本采集
(1)HP前标本采集:确诊为HSP的患儿收入院后,暂禁蛋白饮食,嘱其注意休息及避免剧烈运动。次日清晨空腹抽取静脉血3 mL,置于试管中,30 min内离心(2 500 r/min×10 min),分离获得血清,置于EP管中-80℃冰箱冻存待测。(2)HP后标本采集:最后一次HP后次日清晨空腹抽取静脉血3 mL,置于试管中,30 min内离心(2 500 r/min×10 min),分离获得血清,置于EP管中-80℃冰箱冻存待测。对照组儿童在同时间段清晨空腹采集静脉血3 mL,按上述方法分离血清冻存待测。 1.4 细胞因子检测
采用ELISA法检测病例组治疗前后及对照组血清IL-17、IL-23的水平。ELISA试剂盒购自上海西唐生物科技有限公司。实验操作步骤严格按照试剂盒说明书进行。 1.5 统计学分析
采用SPSS 13.0统计软件对所有数据进行统计学分析,符合正态分布的计量资料以均数±标准差(x±s)表示,多组间比较采用方差分析,组间两两比较采用SNK-q 检验。采用Pearson相关分析对IL-17和IL-23进行相关性分析。P<0.05为差异有统计学意义。 2 结果 2.1 HSP患儿治疗前后与对照组血清IL-23和IL-17水平的比较
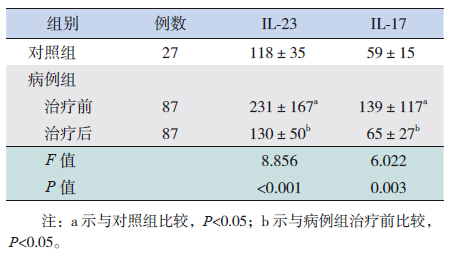
HSP患儿治疗前血清IL-23及IL-17水平均明显高于对照组(P<0.05);HSP患儿治疗后血清IL-23及IL-17水平较治疗前均显著降低(P<0.05),与对照组比较差异无统计学意义(P>0.05)。见表 1。
| 表 1 病例组治疗前后和对照组血清IL-23及IL-17水平比较(x±s,pg/mL) |
IL-17是Th17细胞最主要的效应分子,IL-23在Th17细胞的分化增殖及IL-17的分泌过程中具有重要的作用。近年来IL-23/IL-17轴在炎症性及自身免疫性疾病中的研究越来越多,该轴主要通过影响Th17细胞的活化和增殖来参与炎症性及自身免疫性疾病的发病机制。目前在许多炎症性及自身免疫性疾病中IL-23和IL-17常同时升高,被看做是一个紧密相关的轴系,即IL-23/IL-17轴,以此来代表Th17细胞为主的免疫反应,区别与Th1 细胞相关的IL-12/IFN-γ轴系和与Th2细胞相关的IL-4/IL-5/IL-13轴系。早期对IL-23/IL-17轴的研究主要集中在自身免疫性及炎症性疾病,如类风湿性关节炎、系统性红斑狼疮等[8, 9]。近年来研究显示IL-23/IL-17轴参与了多种变态反应性疾病的发病过程,如哮喘[10]、过敏性湿疹等[11],其作用机制为IL-23通过诱导STAT-3磷酸化促进Th17细胞的分化及增殖,STAT-3磷酸化可促进Th17细胞特异性转录因子RORγt的表达,成熟的Th17可分泌促炎因子IL-17,IL-17通过诱导皮细胞、上皮细胞、成纤维细胞、髓样细胞分泌TNF-α、IL-1β、IL-6等炎症因子,参与并扩大炎症反应。HSP作为一种小血管炎性病变,免疫紊乱、炎症反应、过敏反应都参与了其发病过程,推测IL-23/IL-17轴可能参与了HSP的发病。
本实验采用ELISA检测方法,对HSP患者外周血中IL-23和IL-17水平进行了检测。结果显示HSP患者急性期血清中IL-23和IL-17水平均明显高于对照组,差异有统计学意义。表示IL-23、IL-17参与了HSP的发病,为进一步探讨其在HSP中的发病机制,本实验对HSP患者外周血IL-23和IL-17的水平进行了相关性分析的检测,结果显示二者之间呈明显正相关。综上,HSP患儿血清IL-17和IL-23水平均升高,且二者升高呈正相关,据此推测Th17细胞可能通过IL-23/IL-17轴参与HSP的免疫炎症反应过程。
HP治疗技术是一种新的血液净化治疗手段,其原理是借助体外循环将病人血液引入到装有固态吸附剂的容器中,以清除血液中某些外源性或内源性的毒物,达到血液净化和治疗的目的,同时吸附剂对循环免疫复合物也具有清除作用,可有效清除炎性介质、抗体及循环免疫复合物,调节并重建免疫平衡。有研究发现SLE患儿经HP治疗后一些临床症状得到明显缓解,如乏力、关节痛等症状较对照组明显好转,生活质量明显提高,病死率亦显著下降[12]。本研究选取的HSP患儿均行HP治疗,用ELISA法检测HP治疗前后患者血清中IL-23和IL-17水平的变化,结果显示:实验组血清IL-23水平在HP治疗后较治疗前明显下降,差异有统计学意义;IL-17水平在HP治疗后较治疗前亦明显下降,差异有统计学意义。以上实验数据表明,HP治疗能有效的降低HSP患儿急性期血清IL-23和IL-17的水平,从而减轻炎症反应,调节免疫紊乱,减轻炎症因子及异常增多的免疫分子对机体的损伤。
综合分析,HSP患儿急性期IL-23和IL-17水平均明显升高,共同参与了HSP的发病过程;HP可以有效降低HSP患儿急性期血清中IL-23、IL-17水平从而减轻急性期炎症反应,调节免疫紊乱,降低炎症因子对脏器的损伤,是急性期治疗HSP的安全有效的方法之一。
| [1] | Hamdan JM, Barqawi MA. Henoch -Schönlein purpura in children: influence of age on the incidence of nephritis and arthritis[J]. Saudi Med J, 2008, 29(4): 549-552. |
| [2] | Gardenrmedwin JM, Dolezalova P, Cummins C, et al. Incidence of Henoch-Schönlein purpura, Kawasaki disease, and rare vasculitides in children of different ethnic origins[J]. Lancet, 2002, 360(9341): 1197-1202. |
| [3] | Chen O, Zhu XB, Ren H, et al. The imbalance of Th17/Treg in Chinese children with Henoch-Schönlein purpura[J]. Int Immunopharmacol, 2013, 16(1): 67-71. |
| [4] | Jen HY, Chuang YH, Lin SC, et al. Increased serum interleukin-17 and peripheral Th17 cells in children with acute Henoch-Schönlein purpura[J]. Psdiatr Allergy Immunol, 2011, 22(8): 862-868. |
| [5] | Qu N, Xu M, Mizoguchi I, et al. Pivotal roles of T-helper 17-related cytokines, IL-17, IL-22, and IL-23, in inflammatory diseases[J]. Clin Dev Immunol, 2013, 2013: 968549. |
| [6] | Nakajima K. Critical role of the interleukin-23/T-helper 17 cell axis in the pathogenesis of psoriasis[J]. J Dermatol, 2012, 39(3): 219-224. |
| [7] | 胡亚美, 江载芳. 诸福棠实用儿科学[M]. 第7版. 北京: 人民卫生出版社, 2002: 688-691. |
| [8] | Brentano F, Ospelt C, Stanczyk J, et al. Abundant expression of the interleukin (IL) 23 subunit p19, but low levels of bioactive IL23 in the rheumatoidsynovium: differential expression and Toll-like receptor-(TLR) dependent regulation of the IL23 subunits, p19 and p40, in rheumatoid arthritis[J]. Ann Rheum Dis, 2009, 68(1): 143-150. |
| [9] | Martin JC, Baeten DL, Josien R. Emerging role of IL-17 and Th17 cell in systemic lupus erythematosus[J]. Clin Immunol, 2014, 154(1): 1-12. |
| [10] | Leonardi S, Cuppari C, Manti S, et al. Serum interleukin 17, interleukin 23, and interleukin 10 values in children with atopic eczema/dermatitis syndrome(AEDS): association with clinical severity and phenotype[J]. Allergy Asthma Proc, 2015, 36(1): 74-81. |
| [11] | Li Y, Hua S. Mechanisms of pathogenesis in allergic asthma: role of interleukin-23[J]. Respirology, 2014, 19(5): 663-669. |
| [12] | 李治玖, 齐兆生, 刘玉法, 等. DNA免疫吸附剂血液灌流治疗系统性红斑狼疮临床应用研究[J].中国生物医学工程学报, 2002, 2(5): 422-425. |
 2015, Vol. 17
2015, Vol. 17