社区获得性肺炎(community-acquired pneumonia,CAP)是指健康儿童在医院外获得的感染性肺炎[1]。根据患儿有无喘息表现,可分为喘息性肺炎和非喘息性肺炎。研究发现,血清中C反应蛋白(C-reactive protein,CRP)、可溶性髓系细胞触发受体-1(soluble triggering receptor expressed on myeloid cell-l,sTREM-1)等提示感染的炎症指标在哮喘患者中增高[2, 3]。临床工作中常用CRP、降钙素原(procalcitonin,PCT)、sTREM-1等炎症指标辅助诊断呼吸道细菌感染的存在,而呼吸道细菌感染与哮喘密切相关[4]。T淋巴细胞Th1/Th2细胞亚群失平衡是哮喘的主要免疫发病机制,Thl细胞主要分泌以γ干扰素(interferon-γ,IFN-γ)为代表的细胞因子,Th2细胞主要分泌以白细胞介素4(interleukin-4,IL-4)为代表的细胞因子。白细胞介素10(interleukin-10,IL-10)是调节性T细胞分泌的主要细胞因子,对Th1/Th2细胞亚群的功能具有调节作用。婴幼儿期哮喘诊断比较困难,通过测定有喘息表现的CAP婴幼儿血CRP、PCT、sTREM-1及Th1/Th2细胞亚群相关炎症因子的变化,了解婴幼儿喘息性肺炎患儿中这些炎症因子是否与喘息的发生有关,是否与哮喘有相似的免疫机制,有助于婴幼儿喘息性肺炎的治疗。 1 资料与方法 1.1 研究对象
选择我院病房及门诊婴幼儿CAP 89例,其中男54例,女35例;年龄1个月至3岁。根据患儿有无喘息表现分为非喘息性肺炎组(42例)、喘息性肺炎组(47例)。患儿诊断和病情评估符合中国儿童CAP管理指南标准[1]。30例健康儿童作为对照组。对照组来源于门诊健康体检的正常婴幼儿,无喘息及慢性咳嗽病史,体检心肺无异常,4周内无呼吸道感染病史,否认有个人及家族过敏史。3组年龄(H=1.74,P=0.4194)、性别(χ2=2.22,P=0.3294)比较差异无统计学意义。本研究获得我院医学伦理委员会的批准和家长知情同意。 1.2 血清炎症因子等的测定
每例儿童抽取静脉血后采用乳胶增强免疫比浊法测定血清CRP(日本东芝120全自动生化分析仪)、定量固相免疫测定法测定PCT(德国BRAHMS公司)。同时每例儿童抽取静脉血分离血清储存于-70℃冰箱待测,ELISA法检测血骨膜蛋白(periostin;试剂来源:美国Cloud-Clone公司)、sTREM-1、IFN-γ、IL-4、IL-10(试剂来源:上海西唐生物科技有限公司)。 1.3 统计学分析
采用SAS 9.3统计软件进行统计学处理与分析。计量资料经检验不符合正态分布,以中位数(四分位间距)[P50(P25,P75)]表示,采用Kruskal Wallis秩和检验,多组间两两比较采用Nemenyi法。计数资料采用行×列表的χ2检验。相关分析采用Spearman等级相关分析。P<0.05为差异有统计学意义。 2 结果 2.1 3组血清炎症指标水平的比较
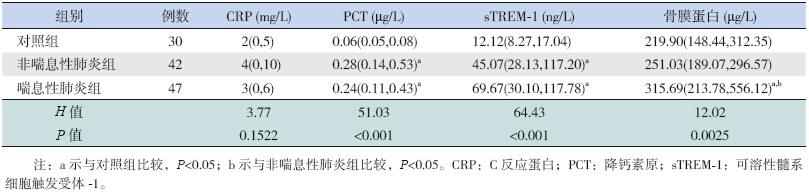
非喘息性肺炎组、喘息性肺炎组、对照组 3组血清CRP水平比较差异无统计学意义(H=3.77,P=0.1522),见表 1。
| 表 1 3组血清炎症指标水平的比较[P50(P25,P75)] |
3组血清PCT水平比较差异具有统计学意义(H=51.03,P<0.001),其中非喘息性肺炎组和喘息性肺炎组血清PCT水平高于对照组 (分别χ2=43.91、36.92,均P<0.05);两个肺炎组间比较差异无统计学意义(χ2=0.60,P>0.05)(表 1)。
3组间血清sTREM-1水平比较差异有统计学意义(H=64.43,P<0.001),其中非喘息性肺炎组和喘息性肺炎组血清sTREM-1水平高于对照组 (分别χ2为42.95、58.21,均P<0.05);两个肺炎组间比较差异无统计学意义(χ2=1.04,P>0.05)(表 1)。
3组血清骨膜蛋白水平比较差异有统计学意义(H=12.02,P=0.0025),其中喘息性肺炎组血清骨膜蛋白水平高于对照组(χ2=9.42,P<0.05)和非喘息性肺炎组(χ2=7.69,P<0.05);非喘息性肺炎组与对照组相比差异无统计学意义(χ2=0.29,P>0.05)(表 1)。 2.2 3组细胞因子检测结果的比较
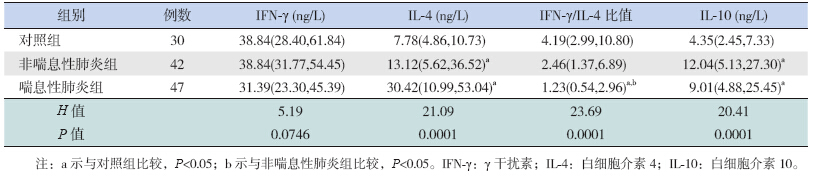
非喘息性肺炎组、喘息性肺炎组、对照组 3组血清IFN-γ比较差异无统计学意义(H=5.19,P=0.0746),见表 2。
| 表 2 3组细胞因子检测结果的比较[P50(P25,P75)] |
3组血清IL-4水平比较差异具有统计学意义(H=21.09,P<0.001),其中非喘息性肺炎组、喘息性肺炎组血清IL-4水平均高于对照组(分别χ2=6.46、χ2=21.03,均P<0.05);两个肺炎组间比较差异无统计学意义(χ2=4.77,P>0.05)(表 2)。
3组IFN-γ/IL-4比值比较差异具有统计学意义(H=23.69,P<0.001),其中喘息性肺炎组IFN-γ/L-4比值低于对照组(χ2=23.28,P<0.05)和非喘息性肺炎组(χ2=7.01,P<0.05);非喘息性肺炎组IFN-γ/IL-4比值与对照组相比差异无统计学意义(χ2=5.60,P>0.05)(表 2)。
3组血清IL-10水平比较差异具有统计学意义(H=20.41,P<0.001),其中非喘息性肺炎组、喘息性肺炎组血清IL-10水平高于对照组(分别χ2=17.75、14.61,均P<0.05);两个肺炎组间比较差异无统计学意义(χ2=0.29,P>0.05)(表 2)。
2.3 IFN-γ/IL-4比值与骨膜蛋白水平的相关分析IFN-γ/IL-4比值与血清骨膜蛋白水平无相关性(r=-0.11,P=0.2250)。 3 讨论
许多实验室炎症指标包括CRP、PCT、sTREM-1等常用于鉴别细菌与病毒感染。CRP是机体对炎性刺激或组织损伤发生的急性时相反应时出现的一种急性时相蛋白,往往用于各种细菌感染和组织损伤的检测。研究发现,没有使用激素的哮喘患者中血CRP水平高于正常人,而且血CRP的增高与肺功能的下降和痰中嗜酸性粒细胞数量相关[2]。PCT是降钙素的前体激素,由甲状腺C细胞分泌,存在细菌感染时PCT升高,而在病毒感染和非特异性炎症时PCT保持低水平。国外研究报道,呼吸道细菌感染与哮喘密切相关,且其可以不依赖病毒感染而独立存在[4]。TREM-1是一相对分子质量为26 000 D的免疫球蛋白家族成员,是近年来发现的一种表达于中性粒细胞和单核细胞的细胞膜受体,sTREM-1是TREM-1经蛋白酶水解的产物,感染状态下可释放入体液[5, 6]。研究发现,哮喘急性发作期血sTREM-1水平高于健康对照组,低于CAP组,说明哮喘急性发作所致的炎症可引起sTREM-1的上调[3]。以上这些研究提示CRP、PCT、sTREM-1与哮喘引起的喘息有关,喘息性肺炎与哮喘相似,也具有喘息临床表现。但本研究发现,非喘息性肺炎组与喘息性肺炎组相比,外周血CRP、PCT、sTREM-1差异均无统计学意义,因此,尚不能认为CRP、PCT、sTREM-1与肺炎患者的喘息发生有关。
喘息是婴幼儿时期常见的呼吸道症状,婴幼儿喘息中有部分是哮喘,婴幼儿喘息的主要病因为被动吸烟、吸入或食物过敏原过敏、病毒感染、支原体感染等引起气道异常免疫反应,导致喘息发生,预防及避免这些致病因素从而降低喘息发生率、预防哮喘至关重要[7, 8, 9]。CD4+ T细胞在哮喘发病机制中发挥了重要作用,未致敏的CD4+ T细胞(Th0细胞)在受到抗原刺激后可分化为Thl和Th2两个细胞亚群,Thl细胞主要分泌以IFN-γ为代表的细胞因子,Th2细胞主要分泌以IL-4为代表的细胞因子。Thl/Th2细胞比例失衡既往被认为是哮喘免疫学机制的发病基础,表现为Th2细胞效应增强,Thl细胞效应减弱,尤其是向Th2细胞的偏移。分析喘息性肺炎患儿IFN-γ和IL-4的水平及其比值可以初步了解喘息性肺炎Thl/Th2细胞的动态平衡情况,有助于阐明喘息性肺炎发病机制及其与哮喘的异同。
本研究发现,喘息性肺炎组IFN-γ/IL-4比值低于非喘息性肺炎组和正常对照组,提示喘息性肺炎与哮喘发病机制相似,也存在Thl/Th2细胞亚群失衡,并以Th2细胞亚群占优势。随着对哮喘研究的不断深入,单纯用Th1/Th2细胞亚群失平衡理论不足以全面解释哮喘的发病机制,调节性T细胞及相关细胞因子在哮喘中的重要性已得到公认。IL-10是调节性T细胞分泌的主要细胞因子,在哮喘发病机制中对Th1/Th2细胞亚群的功能具有调节作用。非喘息性肺炎组、喘息性肺炎组血清IL-10水平较正常对照组升高,提示IL-10在非喘息性肺炎、喘息性肺炎中可能均发挥了调节作用。非喘息性肺炎组与喘息性肺炎组IL-10水平相比差异无统计学意义,因此,尚不能认为IL-10在肺炎患者喘息发生的过程中发挥了显著调节作用。
骨膜蛋白是成骨细胞及其前体细胞分泌的一种细胞外基质蛋白,研究表明,与其他生物标志物(包括血清免疫球蛋白E、外周血嗜酸性粒细胞和呼出气一氧化氮等)相比,骨膜蛋白水平是气道嗜酸性粒细胞增多的最显著预测指标,检测血清骨膜蛋白水平可直接反映气道内嗜酸性粒细胞的活化程度,反映哮喘患者气道嗜酸性粒细胞炎症的变化[10, 11]。本研究发现,喘息性肺炎组骨膜蛋白高于非喘息性肺炎组和正常对照组,提示喘息性肺炎也存在与哮喘相似的气道嗜酸性粒细胞炎症。本研究还显示,IFN-γ/IL-4比值与血清骨膜蛋白水平无相关性。因此,尚不能认为Th1/Th2亚群失平衡与气道嗜酸性粒细胞炎症之间存在必然联系,可能还有其他因素参与,如气道非嗜酸粒细胞性炎症反应。
喘息是婴幼儿呼吸系统疾病常见的临床症状,部分婴幼儿喘息是儿童哮喘的早期表现。目前婴幼儿喘息的发病机制还不完全清楚,对于存在喘息发作的婴幼儿肺炎,如何判断是暂时性的喘息还是哮喘,仍然是儿科医务工作者需要面对的难题。婴幼儿喘息性肺炎存在IFN-γ/IL-4比值失衡,存在气道嗜酸性粒细胞炎症,提示婴幼儿喘息性肺炎有与哮喘相似的免疫机制,应注意随访观察。了解婴幼儿喘息性肺炎的炎症反应机制,有助于婴幼儿喘息性肺炎的随访和治疗。
| [1] | 中华医学会儿科学分会呼吸学组. 儿童社区获得性肺炎管理指南(2013修订)(上) [J]. 中华儿科杂志, 2013, 51(10): 745-752. |
| [2] | Hoshino M, Ohtawa J, Akitsu K. Increased C-reactive protein is associated with airway wall thickness in steroid-naive asthma[J]. Ann Allergy Asthma Immunol, 2014, 113(1): 37-41. |
| [3] | Phua J, Koay ES, Zhang D, et al. Soluble triggering receptor expressed on myeloid cells-1 in acute respiratory infections[J]. Eur Respir J, 2006, 28(4): 695-702. |
| [4] | Darveaux JI, Lemanske RF Jr. Infection-related asthma[J]. J Allergy Clin Immunol Pract, 2014, 2(6): 658-663. |
| [5] | Gibot S, Cravoisy A, Levy B, et al. Soluble triggering receptor expressed on myeloid cells and the diagnosis of pneumonia[J]. N Engl J Med, 2004, 350(5): 451-458. |
| [6] | Oku R, Oda S, Nakada TA, et al. Differential pattern of cell-surface and soluble TREM-1 between sepsis and SIRS[J]. Cytokine, 2013, 61(1): 112-117. |
| [7] | Kalliola S, Pelkonen AS, Malmberg LP, et al. Maternal smoking affects lung function and airway inflammation in young children with multiple-trigger wheeze[J]. J Allergy Clin Immunol, 2013, 131(3): 730-735. |
| [8] | Kusel MM, Kebadze T, Johnston SL, et al. Febrile respiratory illnesses in infancy and atopy are risk factors for persistent asthma and wheeze[J]. Eur Respir J, 2012, 39(4): 876-882. |
| [9] | 刘翔腾, 王桂兰, 罗序锋, 等. 儿童社区获得性肺炎病原微生物分布特点分析[J]. 中国当代儿科杂志, 2013, 15(1): 42-45. |
| [10] | Nair P, Kraft M. Serum periostin as a marker of T(H)2-dependent eosinophilic airway inflammation[J]. J Allergy Clin Immunol, 2012, 130(3): 655-656. |
| [11] | Kanemitsu Y, Matsumoto H, Izuhara K, et al. Increased periostin associates with greater airflow limitation in patients receiving inhaled corticosteroids[J]. J Allergy Clin Immunol, 2013, 132(2): 305-312. |
 2015, Vol. 17
2015, Vol. 17