急性B淋巴细胞白血病(acute B-lymphocytic leukemia,B-ALL)发病率约占急性淋巴细胞白血病的85%,是儿童最常见的恶性血液病[1]。白血病复发是白血病治疗失败的主要原因,复发的根源在于体内残存的白血病细胞。因此,在化疗过程中准确检测患儿体内微小残留病(minimal residual disease,MRD)显得越来越重要。目前,普遍应用基于白血病细胞免疫表型的多参数流式细胞术(flow cytometry,FCM)检测MRD,作为儿童ALL预后的独立指标[2]。FCM检测MRD的关键是找到一种免疫表型能够高度灵敏特异地鉴别正常B系前体细胞和白血病细胞[3]。近来,Lee等[4]研究表明CD58在B-ALL白血病细胞上的表达量高于正常的B系前体细胞。本研究通过检测分析CD58在白血病细胞表面的表达特点,评估其用于B-ALL患儿骨髓标本的MRD检测的可行性。 1 资料与方法 1.1 一般资料
选取2014年1~9月于郑州大学第一附属医院住院的B-ALL患儿87例为研究对象,所有患者都经过FAB分型法和FCM免疫分型法明确诊断,其中男64例,女23例,年龄8个月~13岁。所有患儿均采用VDLP(长春新碱+柔红霉素+左旋门冬酰胺酶+泼尼松)方案进行诱导缓解治疗。在第1疗程结束、达到临床缓解后以及在以后的持续治疗过程中共有44例患儿进行了MRD的监测。同期选取20例非肿瘤、非血液病且骨髓涂片细胞形态正常的住院患儿作为对照组,其中男15例,女5例,年龄1~13岁。本研究获得郑州大学医学伦理委员会研究批准,且所有入组患儿家属均签署知情同意书。 1.2 FCM检测各组CD58表达
将B-ALL患儿各阶段的骨髓标本用Ficoll液分离单个核细胞,PBSA洗涤两次,用PBSA悬浮,调节有核细胞数至每管106个左右。用CD58-FITC、CD10-PE、CD19-APC、CD45-ECD单克隆抗体(均购自美国BD公司)进行膜表面抗体标记,室温暗置15 min。加入1 mL溶血剂(0.83%的氯化铵溶液)暗置10 min,用PBSA洗两遍加入低聚甲醛待检。采用FACSCalibur型(美国BD公司)流式细胞仪进行检测,荧光激发波长为488 nm,测定前用标准荧光微球校准仪器。用CellQuest软件(version 3.3)对数据进行采集,CD58的结果以平均荧光强度(MFI)表示。
根据FCM检测CD58表达量的结果,将B-ALL患儿分为CD58低表达组和CD58强表达组。分组原则为:患儿CD58过强表达,导致B-ALL细胞在流式CD58和CD10双参数点图上与正常骨髓CD19+CD10+的细胞无重叠,明显区分开时,确认为CD58强表达组;而其余患儿的B-ALL细胞在流式CD58和CD10双参数点图上与正常骨髓CD19+CD10+的细胞有重叠而无法区分时,确认为CD58低表达组。 1.3 实时荧光定量聚合酶链反应检测MRD水平
用Ficoll液分离骨髓单个核细胞,按照Qiagen DNA提取试剂盒的说明书提取DNA。采用多重聚合酶链反应(多重PCR)筛查IgH和TCR基因重排。所用引物及反应体系见文献[5, 6]。多重PCR反应条件为:95℃预变性7 min;95℃变性45 s,60℃退火45 s,72℃延伸1.5 min,共35个循环。多重PCR产物经电泳后,选择克隆重排的样本,纯化后送上海生工生物工程技术公司进行测序。将测序所得的DNA序列输入BLAST和IMGT数据库与保守的VDJ序列进行比对,未比对上的序列为患者白血病细胞特异性连接区序列。
以患儿特异性IgH和TCR基因为靶基因设计特异性引物。用正常人的DNA将初诊时的骨髓细胞DNA稀释至1.0×10-6~1.0×10-1浓度以建立IgH/TCR基因重排的标准曲线;以去离子水将正常人DNA梯度序列稀释以建立内参基因albumin的标准曲线。在实时荧光定量聚合酶链反应(RT PCR)仪(美国ABI PRISM 7500)上对患儿化疗第33天的骨髓细胞DNA进行检测,以IgH/TCR基因重排的相对表达量反映MRD水平。根据诱导治疗结束时骨髓MRD水平进行判断,MRD≥10-4为阳性,MRD<10-4为阴性[7]。 1.4 统计学分析
采用SPSS 17.0统计软件对数据进行统计学分析,正态分布计量资料以均数±标准差(x±s)表示,两独立样本均数的比较采用t检验,配对设计计量资料比较采用配对t检验,P<0.05为差异有统计学意义。 2 结果 2.1 CD58在正常分化B系前体细胞和B-ALL白血病细胞中的表达情况
B-ALL患儿初诊时骨髓CD58的MFI(91±33)显著高于对照组(14±6)(t=10.33,P<0.001)(图 1)。CD58的阳性率为99%(86/87),44例(51%,44/87)B-ALL患儿的白血病细胞在流式CD58和CD10双参数点图上与正常骨髓CD19+CD10+的细胞无重叠,确认为CD58强表达。
 |
图 1 对照组正常早期B细胞及初诊和化疗15 d时B-ALL患儿B系白血病细胞的CD58表达情况 图中细胞均以CD19阳性设门。对照组正常的早期B细胞CD58 MFI显著低于B-ALL患儿初诊时白血病细胞CD58 MFI;经化疗15 d后,B-ALL患儿白血病细胞数量减少,但CD58 MFI与初诊时比较差异无统计学意义。 |
为检测CD58在诱导治疗过程中表达的稳定性,从44例CD58强表达患儿中随机选取38例,在诱导化疗后第15天检测骨髓细胞CD58的表达强度,结果显示,化疗第15天时,38例CD58强表达患儿的CD58 MFI(105±22)与初诊时(107±26)比较差异无统计学意义(t=0.801,P=0.428),见图 1。 2.3 CD58用于MRD检测的准确性
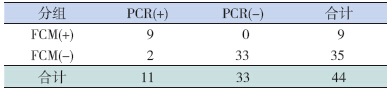
在B-ALL患儿诱导化疗第33天,且已达临床完全缓解状态时,为评价CD58能否作为检测MRD的一个指标,采用FCM和RT-PCR两种方法对44例CD58强表达的B-ALL患儿进行MRD监测。结果显示:FCM检测MRD阳性患儿9例,阴性患儿35例,白血病细胞比例为0.01%~0.29%;RT-PCR检测MRD阳性患儿11例,阴性患儿33例,白血病细胞比例为0.01%~0.47%(表 1)。采用FCM检测为阳性的9例患儿用RT-PCR检测结果均为阳性;另2例RT-PCR检测结果为阳性而FCM检测结果为阴性的患儿,白血病细胞比例范围为0.001%~0.01%。两种方法的检测结果差异无统计学意义(χ2=0.50,P=0.500)。
| 表 1 FCM和RT-PCR监测B-ALL患儿化疗33d时骨髓MRD结果比较(例) |
近年来发现白血病细胞可表达一些在正常前体细胞上不表达的特异性免疫标记物,称为异型表型[8, 9]。基于这种考虑,目前研究的重点放在发现能够准确甄别正常B系前体细胞和白血病细胞的特异性免疫标记物上,并且要求该免疫标记物具有高度的敏感性和特异性,且能够在治疗前后表达稳定[10, 11]。
CD58又称为淋巴细胞功能相关抗原-3,属于免疫球蛋白超家族,配体为CD2(LFA-2),参与杀伤性T淋巴细胞与靶细胞、抗原提呈细胞与T淋巴细胞、胸腺细胞与胸腺上皮细胞间的黏附反应,提供共刺激信号,已被证实在多种细胞上均有表达,但表达强度各有不同,并且CD58在ALL中的表达强度高于正常的B系前体细胞,可能作为儿童ALL MRD检测的一种新的免疫标记物[12, 13]。本研究对87例B-ALL患儿的初诊骨髓标本和20例因其他原因住院的患儿的正常骨髓标本检测后表明,B-ALL患儿CD58的表达强度显著高于对照组对照组患儿。研究结果还显示白血病细胞CD58的阳性率为99%,44例(51%)B-ALL患儿CD58分子强表达,白血病细胞CD58 MFI和正常骨髓细胞 MFI无重叠。因此,CD58/CD10/CD19/CD45抗体组合可以用于儿童B-ALL MRD检测。
FCM检测白血病MRD出现假阴性结果的一个重要因素是在化疗过程中或诱导缓解后白血病细胞表面的单克隆标记表达强度发生改变,可能潜在影响MRD检测的准确性[14, 15]。在儿童ALL治疗过程中也会出现表型的改变,尤其是在使用类固醇激素的过程中[16]。为评估CD58在儿童B-ALL诱导化疗过程中表达是否稳定,本研究检测了38例CD58强表达B-ALL患儿化疗第15天时骨髓细胞CD58的表达情况,与初诊时比较差异无统计学意义。所以,CD58在细胞膜上是一种表达稳定的表型,可用于B-ALL MRD检测。
CD58在B-ALL中表达率在90%以上,并且相对于正常儿童骨髓中的B系前体细胞和成熟淋巴细胞CD58的表达量呈现过度表达的特点,而且CD58在白血病细胞上的表达量在化疗过程中的稳定性较好,因此提示CD58可作为儿童B-ALL MRD监测的较好指标。为分析CD58用于MRD检测结果的准确性,本研究对44例CD58强表达B-ALL患儿化疗第33天的骨髓(涂片骨髓形态学检查均为临床完全缓解状态)分别采用四色FCM和RT-PCR两种方法进行MRD检测,比较两者准确性,结果差异无统计学意义。但是,有2例患儿RT-PCR检测结果为MRD阳性,而FCM检测为阴性。这种差异可能是由于采用标本中淋巴细胞数量的差异造成的,因为RT-PCR检测的标本是经过Ficoll淋巴细胞分离液分离出来的单个核细胞,而FCM检测的标本是骨髓中的所有细胞[17]。由于ALL中部分白血病细胞和正常的B系前体细胞在免疫表型上有相似之处,都表达CD10和CD45[18],而一些白血病细胞的CD58表达量较低,在B系前体细胞群也可能残留有白血病细胞,从而造成MRD假阴性,因此需要增加抗体鉴别白血病细胞。但是CD58/CD10/CD19/CD45抗体组合的检测结果说明CD58可用于B-ALL MRD的检测,并且具有较好的准确性。
到目前为止,国内外均无监测MRD的经典组合,因为白血病细胞是病理性细胞,分子表达存在许多不确定性和偶然性,需要靠多个组合来把握和筛选可能的MRD细胞。本实验室常用TDT/CD10/CD34/CD19,CD38/CD10/CD34/CD19,CD45/CD10/CD34/CD19抗体组合,其敏感性分别为58.7%、42.5%、47.4%。从本研究可见CD58/CD10/CD19/CD45抗体组合用于儿童B-ALL MRD检测的敏感性为51%,仅次与TDT/CD10/CD34/CD19组合。另外,CD58只是作为MRD检测的其中一个指标,它和别的组合一并使用,可使MRD检测的覆盖面增加。由于MRD检测的临床意义也有一定的时间性,根据我们的临床实践和临床检测,确实发现不少完全缓解的病例在检测到CD58+的早期B淋巴细胞(如CD10+,CD34+,CD38+)出现后如果不加干预,就出现异常细胞(白血病细胞)逐渐增多。由于没有长时间的随访研究,在与时间的特异性上还不能下结论。
综上所述,CD58在大部分B-ALL患儿中呈现高表达,表达状态稳定;CD58作为MRD检测抗体组合其中的一个指标,具有较高的敏感性。因此,CD58可以作为FCM监测B-ALL MRD的一个指标。
| [1] | Mullighan CG. Molecular genetics of B-precursor acute lymphoblastic leukemia[J]. J Clin Invest, 2012, 122(10): 3407-3415. |
| [2] | Patkar N, Alex AA, Ahmed R, et al. Standardizing minimal residual disease by flow cytometry for precursor B lineage acute lymphoblastic leukemia in a developing country[J]. Cytometry B Clin Cytom, 2012, 82(4): 252-258. |
| [3] | Liu Q, Wang M, Hu Y, et al. Significance of CD71 expression by flow cytometry in diagnosis of acute leukemia[J]. Leuk Lymphoma, 2014, 55(4): 892-898. |
| [4] | Lee RV, Braylan RC, Rimsza LM. CD58 expression decreases as nonmalignant B cells mature inbone marrow and is frequently overexpressed in adult and pediatric precursor B cell acute lymphoblastic leukemia[J]. Am J Clin Pathol, 2005, 123(1): 119-124. |
| [5] | 李彦媚, 叶铁真, 赖冬波, 等. RQ-PCR检测Ig/TCR基因重排监测急性淋巴细胞白血病患儿治疗过程微小残留白血病[J]. 中国循证儿科杂志, 2012, 7(6): 454-458. |
| [6] | Garand R, Beldjord K, Cave H, et al. Flow cytometry and IG/TCR quantitative PCR for minimal residual disease quantitation in acute lymphoblastic leukemia: a French multicenter prospective study on behalf of the FRALLE, EORTC and GRAALL[J]. Leukemia, 2013, 27(2): 370-376. |
| [7] | 帖利军, 顾龙军, 蒋黎敏, 等. 流式细胞技术与PCR技术联用筛选儿童急性淋巴细胞白血病微量残留标记[J]. 中国当代儿科杂志, 2009, 11(4): 246-250. |
| [8] | Gaipa G, Basso G, Biondi A, et al. Detection of minimal residual disease in pediatric acute lymphoblastic leukemia[J]. Cytometry B Clin Cytom, 2013, 84(6):359-369. |
| [9] | Lutz C, Woll PS, Hall G, et al. Quiescent leukemic cells account for minimal residual disease in children lymphoblastic leukemia[J]. Leukemia, 2013, 27(5): 1204-1207. |
| [10] | Zhao XS, Liu YR, Zhu HH, et al. Monitoring MRD with flow cytometry: an effective method to predict relapse for ALL patients after allogeneic hematopoietic stem cell transplantation[J]. Ann Hematol, 2012, 91(2): 183-192. |
| [11] | 张耀东, 谭利娜, 胡群, 等.儿童急性淋巴细胞白血病免疫分型特征及其临床意义[J]. 中国当代儿科杂志, 2012, 14(3): 188-191. |
| [12] | Comerci CJ, Mace EM, Banerjee PP. CD2 promotes human natural killer cell membrane nanotube formation[J]. PLoS One, 2012, 7(10): e47664. |
| [13] | Nina F, Lars P, Ryder, et al. Identification of residual leukemic cells by flow cytometry in childhood B-cell precursor acute lymphoblastic leukemia: verification of leukemic state by flow-sorting and molecular/cytogenetic methords[J]. Haematologica, 2012, 97(1): 137-141. |
| [14] | Thörn I, Forestier E, Botling J, et al. Minimal residual disease assessment in childhood acute lymphoblastic leukaemia: a Swedish multi-centre study comparing real-time polymerase chain reaction and multicolour flow cytometry[J]. Br J Haematol, 2011, 152(6): 743-753. |
| [15] | Denys B, van der Sluijs-Gelling AJ, Homburg C, et al. Improved flow cytometric detection of minimal residual disease in childhood acute lymphoblastic leukemia[J]. Leukemia, 2013, 27(3): 635-641. |
| [16] | Ratei R, Basso G, Dworzak M, et al. Monitoring treatment response of childhood precursor B-cell acute lymphoblastic leukemia in the AIEOP-BFM-ALL 2000 protocol with multiparameter flow cytometry: predictive impact of early blast reduction on the remission status after induction[J]. Leukemia, 2009, 23(3): 528-534. |
| [17] | 王丽. 儿童急性白血病微小残留病检测方法与评价[J]. 国际儿科学杂志, 2011, 38(3): 229-231. |
| [18] | Sędek Ł, Bulsa J, Sonsala A, et al. The immunophenotypes of blast cells in B-cell precursor acute lymphoblastic leukemia: how different are they from their normal counterparts?[J]. Cytometry B Clin Cytom, 2014, 86(5): 329-339. |
 2015, Vol. 17
2015, Vol. 17