新生儿呼吸窘迫综合征(respiratory distress syndrome,RDS)是导致新生儿呼吸功能不全的主要原因,是导致早产儿死亡的主要疾病之一[1]。有创呼吸支持能够迅速改善缺氧状态,解决肺泡萎陷症状,是治疗RDS的有效措施,但其造成的喉头水肿、呼吸机相关性肺炎和支气管肺发育不良(bronchopulmonary dysplasia,BPD)等并发症对患儿相关损伤较大[2]。鼻塞式持续气道正压通气(nasal continuous positive airway pressure,NCPAP)已被广泛应用于治疗早产儿RDS的临床实践[3, 4],但随着NCPAP的推广应用,发现其造成的鼻部损伤、腹胀及气漏等并发症也可直接影响疗效[5]。加温湿化经鼻导管高流量通气(heated humidified high flow nasal cannula,HHHFNC)是近年来国际上应用较为广泛的另一种无创呼吸支持模式[6, 7, 8],但有关两种无创通气作为首选呼吸支持模式治疗极低出生体重儿RDS的效果评价国内外均少有报道,本研究通过对HHHFNC和NCPAP治疗极低出生体重儿RDS临床疗效的比较,探讨临床上HHHFNC治疗RDS的效果及技术安全性,寻求一种更加理想的治疗RDS的无创呼吸支持模式。 1 资料与方法 1.1 研究对象
选择2013年10月至2014年10月我院收治的RDS极低出生体重儿纳入本前瞻性随机对照研究。
入选标准:(1)在我院出生;(2)胎龄<37周且体重<1 500 g;(3)生后2~6 h出现呼吸困难,进行性加重,并出现低氧血症,胸部X线证实为Ⅱ~Ⅲ级RDS,符合RDS 的诊断标准[9];(4)同意接受肺表面活性物质替代治疗。
排除标准:(1)先天性呼吸道畸形、唇裂、腭裂、Pierre-Robin综合征、先天性膈疝、先天性肺发育不良、气管食管瘘、脐膨出、腹裂等及其他危及生命的先天畸形;(2)患胎粪吸入综合征、胆红素脑病、肺出血等;(3)未能完成治疗自动出院者。
本研究获得我院医学伦理委员会批准及家长书面知情同意。
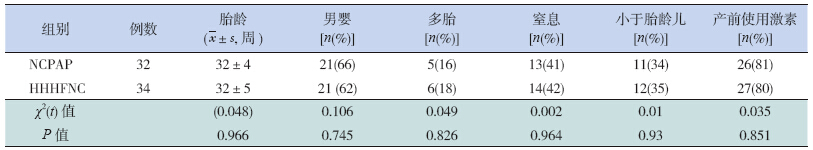
最终有66 例极低出生体重儿纳入本研究,其中HHHFNC组34 例,NCPAP组32 例。两组患儿出生胎龄、性别等一般情况比较差异无统计学意义(表 1)。
| 表 1 两组患儿一般资料的比较 |
入选患儿生后4~6 h内均气管内注入猪肺表面活性物质(pulmonary surfactant,PS)200 mg/kg后随机分组,分别给予相应的呼吸支持。
HHHFNC组应用美国BIRD公司生产的鸟牌空氧混合器连接新西兰费雪派克(Fisher & Paykel)医疗公司生产的OptiflowTM鼻导管吸氧系统。初设参数:吸入氧浓度(FiO2)30%~40%,流量(Flow)2~8 L/min,加温湿化吸入气体温度37℃。
NCPAP组应用英国EME公司所生产Infant Flow System及美国Fisher & Paykel 公司生产的 Bubble CPAP。初调参数:Flow 4~8 L/min,PEEP 5~7 cm H2O,FiO2 40%。根据患儿临床症状改善情况和血气结果调整呼吸机参数,以维持PaO2 60~80 mm Hg,PaCO2 40~50 mm Hg,经皮氧饱和度(SpO2)88%~92%。
两组患儿若发生无创辅助通气失败,立即改用气管插管,接同步间歇指令通气(synchronized intermittent mandatory ventilation,SIMV)辅助通气。出生后3 d内无创辅助通气失败的患儿立即予气管插管的给予第2次PS(100 mg/kg)。 1.3 无创辅助通气失败指征
(1)PEEP>8 cm H2O或者FiO2>60%仍不能维持SpO2≥88%;(2)严重呼吸暂停:24 h内发作>6次,或>2次经复苏囊正压通气;(3)面色苍白,末梢紫绀,四肢湿冷,毛细血管再充盈时间延长,无法维持与胎龄相符的正常血压或休克;(4)难以纠正的严重的代谢性酸中毒或呼吸性酸中毒;(5)腹壁紧张、明显腹胀(24 h腹围增加大于1.5 cm并伴有肠型)并伴有以下任一条:①反应差、伴血糖波动;②消化道出血;③代谢性酸中毒(BE< -10 mmol/L);④体温不稳定;⑤呼吸暂停和心动过缓的发生明显增加(超过3次/日)。 1.4 撤除无创呼吸支持的标准
患儿胸部X光片及临床表现好转;SpO2及血气分析正常。HHHFNC组呼吸机参数降低:Flow<2 L/min,FiO2<25%;NCPAP组呼吸机参数降低:PEEP<4 cm H2O,FiO2<25%。 1.5 观察指标
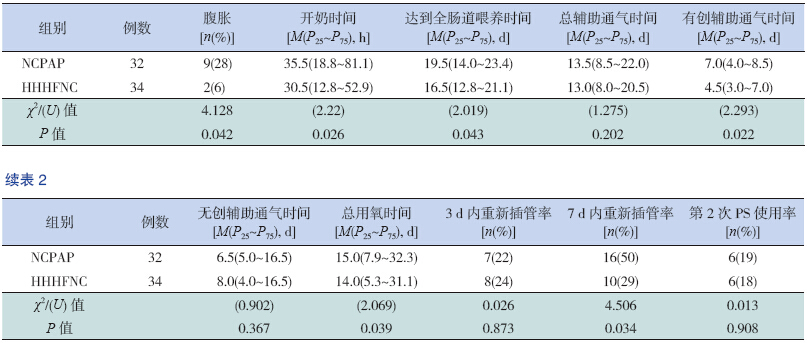
主要观察指标:腹胀发生率、开奶时间、达到全肠道喂养时间、总辅助通气时间、无创辅助通气时间、有创辅助通气的时间、总用氧时间、治疗后3 d内重新插管率、7 d内重新插管率、第二次PS使用率等。
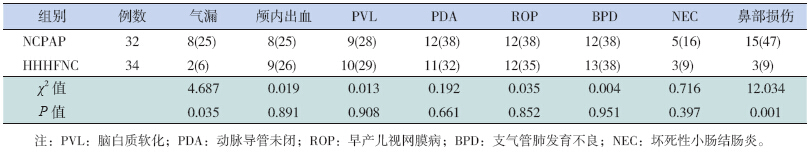
并发症及转归:(1)鼻部损伤:包括鼻部外伤、鼻中隔损伤、前庭狭窄、鼻黏膜溃疡、鼻黏膜红肿等;(2)气漏:包括间质性肺气肿、纵隔积气、气胸、心包积气、气腹和皮下气肿等;(3)颅内出血;(4)脑白质软化(PVL)[10];(5)坏死性小肠结肠炎(NEC);(6)早产儿视网膜病(ROP);(7)动脉导管未闭(PDA);(8)支气管肺发育不良BPD[11];(9)全肠道喂养时间:奶量达到每日130~150 mL/kg 的时间[12]。 1.6 统计学分析
采用SPSS 18.0统计软件进行统计学分析。计量资料以均数±标准差(x±s)或中位数(四分位间距)[M(P25~P75)]表示,组间比较采用t检验或Mann-Whitney U 检验;计数资料用率(%)表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。 2 结果 2.1 主要观察指标的比较
与NCPAP组相比,HHHFNC组腹胀发生率明显降低,开奶时间及达到全肠道喂养时间明显提前,总用氧时间和有创辅助通气的时间明显减少,7 d内的重新插管率明显降低,差异有统计学意义(P<0.05);两组总辅助通气时间、无创辅助通气时间、3 d内重新插管率、第2次PS使用率的差异无统计学意义,见表 2。
| 表 2 两组患儿主要观察指标的比较 |
HHHFNC 组气漏、鼻部损伤的发生率明显低于NCPAP组,差异有统计学意义(P<0.05);两组颅内出血、PVL、PDA、ROP、BPD、NEC的发生率比较差异无统计学意义(P>0.05)(表 3)。
| 表 3 两组患儿临床并发症的比较[n(%)] |
国内外研究均证实INSURE策略[13, 14, 15]可以很快改善患儿氧合状态,是治疗早产儿RDS的有效手段,而NCPAP是最早应用于治疗RDS呼吸支持的无创通气模式,但由于NCPAP头面部繁琐厚重的装束所产生的压力可使局部组织坏死,容易导致患儿的鼻翼受压、鼻周皮肤受损,鼻孔明显扩张、变形,造成鼻黏膜水肿、淤血等损伤;鼻塞会刺激鼻孔使鼻腔内分泌物增多,增加鼻部和全身性感染的风险。在Jatana等[16]的研究中,13.2%的患儿接受NCPAP支持治疗后仅10 d即出现了一系列的鼻腔并发症,包括前庭狭窄、鼻黏膜溃疡、鼻部外伤等。
HHHFNC近年来逐渐成为新生儿无创呼吸支持的另一模式[17],该模式无需头部包裹,直接将适宜双侧鼻孔的鼻导管放入鼻腔,不存在外力的压迫,有效避免头部变形和鼻损伤,己在许多新生儿重症监护病房广泛使用。Saslow等[18]研究发现,在HHHFNC流量达到5 L/min时,对于早产儿呼吸功和肺顺应性的改善与NCPAP 6 cm H2O相当。 HHHFNC较NCPAP装置轻便,但呼吸产生的压力接近于NCPAP产生的压力[19, 20],国外临床研究也表明,HHHFNC能与NCPAP产生同样的治疗效果,具有更好的耐受性;并且在没有增加病死率和BPD等疾病发生率的情况下,缩短了呼吸机使用天数[21]。极低出生体重儿早期使用NCPAP呼吸支持时,舒适度和鼻部损伤是两个一直存在的问题。本研究证实HHHFNC组患儿鼻部损伤的发生率明显低于NCPAP组,表明HHHFNC可有效避免极低出生体重儿鼻部损伤。Osman等[22]对使用HHHFNC和NCPAP的患儿行疼痛评分,发现HHHFNC组患儿疼痛明显较少,耐受性明显提升。
HHHFNC组患儿相对NCPAP组鼻部损伤和气漏发生率显著减少,还与HHHFNC装置的加温湿化率相对较高有关。Campbell等[23]研究发现出生体重<1 250 g的新生儿吸入未经湿化、加温处理的气体的通气支持可导致气漏发生率的增加、肺表面活性物质的活性降低以及引发更严重的慢性肺部病变。
腹胀、NEC同样是NCPAP应用于治疗早产儿RDS中的突出问题,也是造成早产儿3 d后无创辅助通气失败,需要重新插管的重要因素。本研究证实,HHHFNC组发生腹胀发生率明显低于NCPAP组,而且开奶及达到全肠道喂养时间也明显短于NCPAP组。对于极低出生体重儿来说,尽早开奶及达到全肠道喂养至关重要,可降低胆汁淤积等并发症的发生率。因此HHHFNC较NCPAP更有利于患儿体重的增长、有助于肠内营养以及蛋白/能量比值的均衡,从而满足患儿生长发育的需求,有利于极低出生体重儿的远期生存质量。本研究结果还显示,患儿应用HHHFNC进行呼吸支持与NCPAP相比总用氧时间及有创辅助通气时间明显缩短,这与Woodhead等[24]研究结果相一致。
综上所述,HHHFNC较NCPAP可明显降低患儿鼻损伤、腹胀的发生率,缩短用氧时间,提早开奶时间,尽早达到全肠道喂养,减少有创呼吸支持的使用,并且未增加BPD、ROP、PVL、颅内出血、PDA的发生率,未延长无创辅助通气时间,且使患儿更加舒适、容易耐受,装置易于操作,可作为早产极低出生体重儿无创通气模式中一种较好的选择。
| [1] | Jobe AH. What is RDS in 2012?[J]. Early Hum De, 2012, 88 Suppl 2: S42-S44. |
| [2] | Kamath BD, Macguire ER, McClure EM, et al. Neonatal mortality from respiratory distress syndrome: lessons for low-resource countries[J]. Pediatrics, 2011, 127(6): 1139-1146. |
| [3] | Verder H, Bohlin K, Kamper J, et al. Nasal CPAP and surfactant for treatment of respiratory distress syndrome and prevention of bronchopulmonary dysplasia[J]. Acta Paediatr, 2009, 98(9): 1400-1408. |
| [4] | 陈信, 潘家华.无创通气在早产儿呼吸窘迫综合征中的应用进展[J].中国当代儿科杂志, 2014, 16 (11): 1177-1182. |
| [5] | Walsh BK, Brooks TM, Grenier BM. Oxygen therapy in the neonatal care environment[J]. Respir Care, 2009, 54(9): 1193-1202. |
| [6] | Manley BJ, Owen L, Doyle LW, et al. High flow nasal cannulae and nasal continuous positive airway pressure use in non-tertiary special care nurseries in Australia and New Zealand[J]. J Paediatr Child Health, 2012, 48(1): 16-21. |
| [7] | Nath P, Ponnusamy V, Willis K, et al. Current practices of high and low flow oxygen therapy and humidification in UK neonatal units[J]. Pediatr Int, 2010, 52(6): 893-894. |
| [8] | Holleman-Duray D, Kaupie D, Weiss MG. Heated humidified high-flow nasal cannula: use and a neonatal early extubation protocol[J]. J Perinatol, 2007, 27(12): 776-781. |
| [9] | 邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学[M].第4版.北京: 人民卫生出版社, 2011: 395-398. |
| [10] | 周丛乐, 姜毅, 汤泽中, 等.早产儿脑白质损伤的发生、预后与病因探讨[J]. 中华围产医学杂志, 2003, 6(6): 325-328. |
| [11] | Ramani M, Ambalavanan N. Feeding practices and necrotizing enterocolitis[J]. Clin Perinatol, 2013, 40(1): 1-10. |
| [12] | Jobe AH, Bancalari E. Bronchopulmonary dysplasia[J]. Am J Respir Crit Care Med, 2001, 163(7): 1723-1729. |
| [13] | Dani C, Corsini I, Bertini G, et al. The INSURE method in preterm infants of less than 30 weeks'gestation[J]. J Matern Fetal Neonatal Med, 2010, 23(9): 1024-1029. |
| [14] | 徐小静, 虞人杰, 王俊怡. INSURE技术在和超低出生体重儿呼吸支持中的应用价值83例临床分析[J]. 中华围产医学杂志, 2013, 16(1): 30-34. |
| [15] | 黄西林, 陈丹, 李小萍, 等. INSURE策略治疗新生儿呼吸窘迫综合征的临床研究[J]. 中国当代儿科杂志, 2013, 15(1): 9-13. |
| [16] | Jatana KR, Oplatek A, Stein M, et al. Effects of nasal continuous positive airway pressure and cannula use in the neonatal intensive care unit setting[J]. Arch Otolaryngol Head Neck Surg, 2010, 136(3): 287-291. |
| [17] | Hough JL, Shearman AD, Jardine LA, et al. Humidified high flow nasal cannulae: current practice in Australasian nurseries, a survey[J]. J Paediatr Child Health, 2012, 48(2): 106-113. |
| [18] | Saslow JG, Aghai ZH, Nakhla TA, et al. Work of breathingusing high—flow nasal cannula in preterrn infants[J]. J Perinatol, 2006, 26(8): 476-480. |
| [19] | Al-Alaiyan S, Dawoud M, Al-Hazzani F. Positive distending pressure produced by heated, humidified high flow nasal cannula as compared to nasal continuous positive airway pressure in premature infants[J]. J Neonatal Perinatal Med, 2014, 7(2): 119-124. |
| [20] | Lavizzari A, Veneroni C, Colnaghi M, et al. Respiratory mechanics during NCPAP and HHHFNC at equal distending pressures[J]. Arch Dis Child Fetal Neonatal Ed, 2014, 99(4): F315-F320. |
| [21] | Shoemaker MT, Pierce MR, Yoder BA, et al. High flow nasal cannula versus nasal CPAP for neonatal respiratory disease: a retrospective study[J]. J Perinatol, 2007, 27(2): 85-91. |
| [22] | Osman M, Elsharkawy A, Abdel-Hady H. Assessment of pain during application of nasal-continuous positive airway pressure and heated, humidified high-flow nasal cannulae in preterm infants[J]. J Perinatol, 2015, 35(4): 263-267. |
| [23] | Campbell DM, Shah PS, Shah V, et al. Nasal continuous positive airway pressure from high flow cannula versus Infant flow for preterm infants[J]. J Perinatol, 2006, 26(9): 546-549. |
| [24] | Woodhead DD, Lambert DK, Clark JM, et al. Comparing two methods of delivering high-flow gas therapy by nasal cannula following endotracheal extubation: a prospective, randomized, masked, crossover trial[J]. J Perinatol, 2006, 26(8): 481-485. |
 2015, Vol. 17
2015, Vol. 17