2. 解放军306医院儿科, 北京 100101
食物介导的变态反应(食物过敏)发病率日益攀升,是儿童时期尤其是婴幼儿期常见的变态反应性疾病之一,已经成为儿童时期重要的公共健康问题。Th1/Th2细胞比例和功能失衡,Th2反应占优势是过敏性疾病的重要机制之一,亦有研究认为过敏性疾病是肠道黏膜疾病,是与食物抗原所致口服耐受被打破有关的异常Th2型免疫反应。
随着人们生活环境改善,暴露微生物的机会减少,微生物表面的脂多糖(LPS)和胞嘧啶鸟嘌呤(CpG)等病原相关分子通过Toll样受体刺激机体免疫调节细胞减少,调节性T细胞成熟不良,转化生长因子β(TGF-β)分泌减少,从而失去了对Th1和Th2免疫应答的平衡作用。现有研究认为TGF-β是一种多功能细胞因子,有抑炎与致炎双重作用,在过敏反应中的作用报道也不一致。流行病学调查显示TGF-β作为一种抑制性细胞因子在降低过敏性疾病风险中可能起了决定性作用[1]。非甲基化CpG-寡核苷酸(ODN) 作为免疫调节剂能够诱导Th1型免疫反应,抑制Th2型反应,进而在过敏反应中起调节作用[2]。TGF-β在过敏性疾病中可能起抑制作用,因啮齿动物免疫调节与人类相似[3],为探索非甲基化CpG-ODN对食物过敏幼鼠模型TGF-β的影响,本研究以2~3周BALB/c 幼鼠模拟婴幼儿期,通过OVA基础和激发致敏建立食物过敏幼鼠动物模型,于激发致敏前予非甲基化CpG-ODN干预,观察非甲基化CpG-ODN对致敏幼鼠血清中TGF-β的影响,探讨非甲基化CpG-ODN作为免疫调节剂在食物过敏中的作用。 1 资料与方法 1.1 实验动物
2~3周龄BALB/c雌性小鼠30只购自北京维通利华实验动物技术有限公司,体重8~11 g,饲养于中国科学院动物研究所,条件为清洁级环境,室温22~26℃,湿度40%~70%,自由饮水,以不含卵清蛋白(OVA)的饲料自由进食,实验前所有小鼠均适应性饲养1周。 1.2 药品及试剂
OVA(V级,美国Sigma公司),OVA-IgE试剂盒(Biolegend公司),氢氧化铝[Al(OH)3,美国Sigma公司],IL-4、干扰素(IFN)-γ、TGF-β检测试剂盒(BD Biosciences公司),非甲基化CpG-ODN1826(上海生工生物工程股份有限公司北京合成部)。 1.3 食物过敏模型制备及分组
将30只小鼠随机分为对照组、模型组及非甲基化CpG-ODN干预组(简称CpG-ODN组),每组10只。食物过敏动物模型制作方法参照文献[4, 5]。基础致敏:于实验第0、14天给予小鼠腹腔注射OVA(50 μg/只)致敏液0.2 mL,OVA浓度根据前期预实验结果确定;激发致敏:自第17天起,以OVA液0.3 mL(2 mg/mL)隔2 d给予小鼠灌胃激发,直至第29天;CpG-ODN组小鼠在每次灌胃激发前1 h均腹腔注射非甲基化CpG-ODN溶液(40 μg/只,约0.08 mL);在基础致敏和激发致敏阶段,对照组小鼠则以等量生理盐水替代。
观察致敏前后各组小鼠过敏症状;于最后一次激发3 h后摘眼球取血约0.8 mL,离心血清于-80℃冰箱保存待测;取空肠0.5 cm做常规苏木精-伊红(HE)染色行病理观察。 1.4 食物过敏模型制备及分组
症状评分参照Li等[6]报道的评分系统:没有症状计0分;抓、挠头和鼻子计1分;眼睛和嘴浮肿、腹泻、活动减少和/或活动减少的同时呼吸急促计2分;哮喘、呼吸缓慢、嘴和尾巴紫绀计3分;刺激或震动时没有活动计4分;死亡计5分。 1.5 血清中OVA-IgE含量测定及细胞因子检测
采用ELISA法检测小鼠血清OVA-IgE含量,CBA方法检测小鼠血清中IL-4、IFN-γ、TGF-β含量,具体步骤按照试剂盒说明书操作。 1.6 食物过敏模型成功建立判别标准
参考文献[7],以模型组小鼠过敏症状评分、血清OVA-IgE≥对照组均数+3标准差(x+3s)及肠道组织病理情况作为判别模型制备成功的标准。 1.7 统计学分析
采用SPSS 17.0统计软件对数据进行统计学分析,正态分布计量资料采用均数±标准差(x±s)表示,若方差齐,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验;若方差不齐,多组间比较采用Kruskal-Wallis H检验,组间两两比较采用Nemenyi法,P<0.05为差异有统计学意义。 2 结果 2.1 成功建立OVA幼鼠食物过敏模型
在预实验中发现,以50 μg OVA致敏效果最好,在完成OVA激发致敏后,模型组小鼠食物过敏症状评分(3.2±2.2)明显高于对照组(0)(Z=3.75,P<0.001);模型组小鼠空肠组织病理表现为I型过敏反应;模型组小鼠OVA-IgE含量(16.50±5.80)≥对照组x+3s(0.24±0.07)。根据上述实验结果判定食物过敏小鼠模型构建成功。 2.2 非甲基化CpG-ODN对小鼠过敏症状评分及病理情况的影响
对照组小鼠肠黏膜完整,无明显炎性细胞浸润;模型组可见淋巴细胞及少量嗜酸性粒细胞浸润,血管扩张明显,绒毛结构破坏不明显;CpG-ODN组绒毛结构较完整,炎性细胞浸润少(图 1)。以上3组过敏症状评分比较差异有统计学意义(H=17.53,P<0.001);模型组食物过敏症状评分(3.2±2.2)高于对照组(0)(Z=3.75,P<0.001),与CpG-ODN组(2.2±1.8)比较差异无统计学意义(Z=1.04,P=0.301);CpG-ODN组过敏症状评分高于对照组(Z=3.75,P<0.001)。
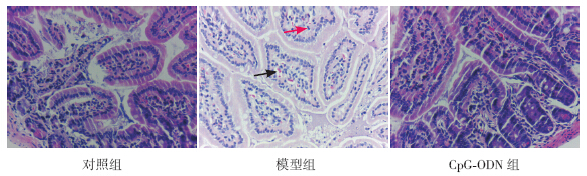 |
图 1 小鼠空肠黏膜形态及结构HE染色(×400) 对照组小鼠肠黏膜结构完整,无明显炎性细胞浸润。模型组小鼠淋巴细胞(红色箭头所示)及少量嗜酸性粒细胞浸润,血管扩张明显(黑色箭头所示)。CPG-ODN组小鼠绒毛结构较完整,炎性细胞浸润少。 |
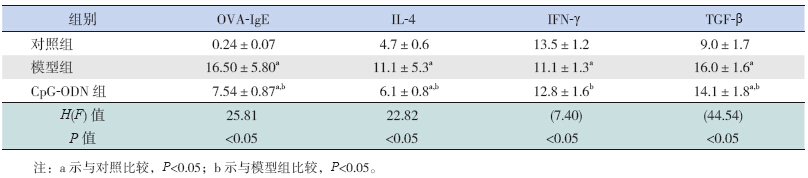
与对照组比较,模型组血清中OVA-IgE、IL-4及TGF-β水平均升高,IFN-γ水平降低(P<0.05)。与模型组比较,CpG-ODN组血清中OVA-IgE、IL-4及TGF-β均降低,但仍高于对照组(P<0.05);而IFN-γ水平升高(P=0.014),与对照组比较差异无统计学意义(P>0.05)(表 1)。提示非甲基化CpG-ODN可促进Th1型细胞因子IFN-γ产生,抑制Th2细胞因子IL-4及TGF-β、OVA-IgE分泌。
| 表 1 各组血清中OVA-IgE及细胞因子水平变化 (n=10,x±s,pg/mL) |
食物过敏是主要由摄入的食物过敏原扰乱机体免疫系统,造成免疫失调引起的高敏状态,可引起机体各系统受累[8]。大多数人对环境中过敏原的免疫反应在生命早期即已开启[9],蛋白食物(牛奶、鸡蛋等)成为婴幼儿期最常见的过敏原[10]。研究发现TGF-β作为一种抑制性细胞因子在降低过敏性疾病风险中可能起了决定性作用。近来,免疫调节剂在过敏性疾病中的作用越来越受到重视,具有免疫刺激作用的非甲基化CpG-ODN作为一种新型免疫佐剂诱导以Th1型为主的免疫应答,在过敏性疾病中可能起到免疫调节作用,那么两者在食物过敏中的作用如何。本实验采用OVA诱导2~3周龄幼鼠制备过敏模型来模拟婴幼儿期食物过敏,研究非甲基化CpG-ODN对食物过敏幼鼠模型血清中TGF-β的影响,探索给予非甲基化CpG-ODN后其在过敏幼鼠体内的免疫调节作用。
依据前期预实验结果发现50 μg OVA致敏效果较好,故本实验干预组选取此剂量。该模型经过过敏症状临床评分、血清特异性IgE水平及空肠病理结果显示制备成功。关于剂量摸索的预实验中,参照了Chen等[11]、湛孝东等[12]及Sakamoto等[13]成年鼠(BALB/c)剂量,同时依据小鼠的周龄及体重进行调整。 Th1/Th2平衡向Th2偏移是产生过敏的关键免疫机制,并且在致敏和激发阶段都发挥着重要作用。Th2相关细胞因子如IL-4、IL-5等分泌增多,而Th1型细胞因子分泌减少。且IL-4可促使Th0细胞分化为Th2细胞,刺激B细胞分化为浆细胞诱导IgE的产生[14]。本实验中,模型组及干预组IL-4及OVA-IgE水平均较对照组明显升高,与上述观点一致。
TGF-β是一种具有调节细胞生长、分化、凋亡、迁移和发育的多功能细胞因子,能够调节多种免疫细胞,尤其是调节性T淋巴细胞及辅助性T淋巴细胞的增殖、分化及免疫应答,作为负性调节因子,可以抑制或下调Th1/Th2,维持机体免疫平衡。通过TGF-β受体激活后与R-Smad蛋白特定区域结构特异性结合,识别和活化下游信号分子Smad蛋白,启动胞内信号级联反应,在过敏反应中起调节作用。这种作用的产生可能与抑制T淋巴细胞、B淋巴细胞、NK细胞及其表达在抗原提呈细胞表面MHC2分子的增殖有关,另有研究发现,TGF-β作为抑制性细胞因子抑制嗜酸性粒细胞、嗜碱性粒细胞及肥大细胞的致炎作用,进而抑制Th2细胞相关细胞因子IL-4的分泌及特异性IgE的产生,调节失衡的Th1/Th2反应,直接抑制变态反应。近年来,关于TGF-β在过敏性疾病中的研究发现,既有TGF-β在过敏小鼠肠黏膜中降低的研究,亦有在食物过敏患儿体内TGF-β水平明显升高的报道。其对过敏患者的效应细胞作用呈现复杂矛盾的结果,既可诱导肥大细胞的趋化作用,阻滞FcεRI表达,又能促使幼稚的CD4+CD25-T细胞转化为功能性Treg细胞,这一机制通过诱导Foxp3表达对免疫耐受发挥重要作用,TGF-β增高对组织纤维化和重塑发挥作用,应用抗TGF-β抗体或中和Smad3可显著降低平滑肌增生和炎症反应。另有研究发现OVA-CD4+T细胞中TGF-β高表达能消除小鼠模型OVA-Th2细胞诱导的气道高反应性和炎症反应[15, 16]。
本研究则将其作为一种细胞因子了解其在食物过敏幼鼠中的分泌情况,发现模型组小鼠血清TGF-β水平较对照组水平升高,与Cardoso等[17]报道一致,我们推测TGF-β在疾病早期升高是机体启动的以控制过度炎症反应、诱导T细胞耐受的结果。尽管在不同的过敏性疾病研究中发现TGF-β或升高或降低,没有一致性结论,TGF-β作为多功能性细胞因子,在过敏性疾病病程的不同时期TGF-β都会参与,不同时期所发挥的作用不同(双重作用),一方面,它可以控制过度炎症反应(负反馈作用)并诱导T淋巴细胞耐受(保护作用),另一方面,由于其自愈修复机制,诱导组织纤维化和重塑,当然,TGF-β在过敏性疾病免疫调节中的相互矛盾现象仍需进一步研究澄清。
非甲基化CpG-ODN作为细胞内TLR9配体与益生菌有着相似的作用,两者特异性结合后能够启动细胞信号通路,最终激活NF-κB信号通路而发挥作用[18],可刺激浆细胞样树突状细胞诱导抗原特异性Th1和细胞毒T淋巴细胞产生[19],激活单核/巨噬细胞、NK细胞及B、T细胞活化,诱导分泌多种细胞因子、趋化因子、粘附分子等[20, 21],作为强有力的Th1型免疫应答增强剂,不仅可以降低Th2型免疫应答的发生,同时可以将已经发生的Th2型反应转向Th1型,具有特异性免疫记忆效应。本实验中,CpG-ODN组较50 μg组显著降低了血清OVA-IgE、IL-4及TGF-β水平,诱导Th1型免疫反应,使失衡的Th1/Th2得以纠正。对于TGF-β水平的降低可能与非甲基化CpG-ODN交联的NF-κB信号通路有关,有报道称TGF-β 除了Smad信号通路外,还有其他的信号通路包括丝裂原活化蛋白激酶(MAPK)、细胞外信号调节激酶 (ERK)、JNK、P38通路[22],及与Smad7交联的NF-κB通路[23]。而这些信号通路同时也是TLR9与非甲基化CpG-ODN结合后激活的通路。Volpi等[24]研究发现,使用高剂量非甲基化CpG-ODN 刺激小鼠浆细胞样树突细胞,发现高剂量非甲基化CpG-ODN 与浆细胞样树突细胞TLR9 识别后,通过干扰素调节因子3(TLR9-IRF3)信号通路,而非信号通路,激活下游TGF-β,由此可猜测降低的TGF-β水平可能与非甲基化CpG-ODN交联的NF-κB信号通路有关。那么体内给予非甲基化CpG-ODN后是如何影响TGF-β分泌的,影响程度如何还需要进一步研究来阐述。
综上所述,本研究显示OVA所致食物过敏动物模型中TGF-β含量升高。非甲基化CpG-ODN在2~3周龄食物过敏幼鼠模型中可诱导Th1型免疫应答,扭转Th1/Th2紊乱,减轻过敏反应,降低TGF-β水平,但如何降低,或与致敏反应产生的炎性程度是否相关还需进一步的研究来证实。
| [1] | Li F, Wang L, Jin XM, et al. The immunologic effect of TGF-beta1 chitosannanoparticle plasmids on ovalbumin-induced allergic BALB/c mice[J]. Immunobiology, 2009, 214(2): 87-99. |
| [2] | Pali-Schöll I, Szöllösi H, Starkl P, et al. Protamine nanoparticles with CPG-oligodeoxynucleotide prevent an allergen-induced Th2-response in BALB/c mice[J]. Eur J Pharm Biopharm, 2013, 85(3 Pt A): 656-664. |
| [3] | Oyoshi MK, Oettgen HC, Chatila TA, et al. Food allergy: Insights into etiology, prevention, and treatment provided by murine models[J]. J Allergy Clin Immunol, 2014, 133(2): 309-317. |
| [4] | Shin HS, Bae MJ, Jung SY, et al. Preventive effects of skullcap (Scutellaria baicalensis) extract in a mouse model of food allergy[J]. J Ethnopharmacol, 2014, 153(3): 667-673. |
| [5] | Knippels LM, Penninks AH, Spanhaak S, et al. Oral sensitization to food proteins: a brown norway rat model[J]. Clin Exp Allergy, 1998, 28(3): 368-375. |
| [6] | Li XM, Schofield BH, Huang CK, et al. A murine model of IgE-mediated cow's milk hypersensitivity[J]. J Allergy Clin Immunol, 1999, 103(2 Pt 1): 206-214. |
| [7] | 王本贞, 郑成中. CPG寡核苷酸对致敏幼鼠血清Th1/Th2细胞因子及肥大细胞趋化蛋白1的影响[J]. 军医进修学院学报, 2015, 36(5): 505-509. |
| [8] | Ben-Shoshan M, Clarke AE. Anaphylaxis: past, present and future[J]. Allergy, 2011, 66(1): 1-14. |
| [9] | Toomer OT, Ferguson M, Pereira M, et al. Maternal and postnatal dietary probiotic supplementation enhances splenic regulatory T helper cell population and reduces ovalbumin allergen-induced hypersensitivity responses in mice[J]. Immunobiology, 2014, 219(5): 367-376. |
| [10] | Lin YT, Wu CT, Huang JL, et al. Correlation of ovalbumin of egg white components with allergic diseases in children[J]. J Microbiol Immunol Infect, 2014: S1684-S1182. |
| [11] | Chen C, Sun NN, Li YN, et al. A BALB/c mouse model for assessing the potential allergenicity of proteins: comparison of allergen dose, sensitization frequency,timepoint and sex[J]. Food Chem Toxicol, 2013, 62(62): 41-47. |
| [12] | 湛孝东, 姜玉新, 李良怿. 不同浓度卵蛋白变应原对小鼠哮喘模型建立的影响[J]. 中国实验动物学报, 2012, 20(4): 16-20. |
| [13] | Sakamoto Y, Ueno K, Yofu S, et al. The expression of IL-4, IL-6 and TNF-a in food sensitized mice after oral challenge[J]. Int Arch Allergy Immunol, 1999, 118(4): 226. |
| [14] | Sicherer SH, Sampson HA. Food allergy[J]. J Allergy Clin Immunol, 2010, 125(2 Suppl 2): S116-S125. |
| [15] | Palomares O, Martin-fontecha M, Lauener R, et al. Regulatory T cell and immune regulation of allergic diseases: roles of IL-10 and TGF-β[J]. Genes Immun, 2014, 24: 1-10. |
| [16] | Midence NG, Arias K. TGF-βregulates house dust mite-induced allergic airway inflammation but not airway remodeling[J]. Am J Respir Crit Care Med, 2008, 177(6): 593-603. |
| [17] | Cardoso CR, Provinciatto PR, Godoi DF, et al. B cells are involved in the Modulation of pathogenic gut immune response in food-allergic entropathy[J]. Clin ExpImmunol, 2008, 154(2): 153-161. |
| [18] | Jassies-van der Lee A, Rutten V, Spiering R, et al. The immunostimulatory effect of CpG oligodeoxynucleotides on peripheral blood mononuclear cells of healthy dogs and dogs with atopic dermatitis[J]. Vet J, 2014, 200(1): 103-108. |
| [19] | Asanuma H, Zamri NB, Sekine S, et al. A novel combined adjuvant for nasal delivery elicits mucosal immunity to influenza in aging[J]. Vaccine, 2012, 30(4): 803-812. |
| [20] | Cheng Q, Xu C, Zhang L, et al. Administered CpG oligodeoxynucleotide induces mRNA expression of CXC and CC chemokine s at the intestinal mucosa and PBMCs in piglets[J]. Int Immunopharmacol, 2010, 10(5): 611-618. |
| [21] | Nishida A, Lau C, Mizoguchi E, et al. Regulatory B cells in mouse models of intestinal inflammation[J]. Methods Mol Biol, 2014, 1190: 227-241. |
| [22] | Cuschieri J, Maier RV. Mitogen-activated protein kinase (MAPK)[J]. Crit Care Med, 2005, 33(12 Suppl): S417-S419. |
| [23] | Dupont J, McNeilly J, Vaiman A, et a1. Activin signaling pathways in ovine pituitary and LbetaT2 gonadotrope cells[J]. Biol Reprod, 2003, 68(5): 1877-1887. |
| [24] | Volpi C, Fallarino F, Pallotta MT, et al. High doses of CpG oligodeoxynucleotide s stimulate a tolerogenic TLR9-TRIF pathway[J]. Nat Commun, 2013, 4: 1852. |
 2015, Vol. 17
2015, Vol. 17