神经纤维瘤病1型(neurofibromatosis type 1,NF-1)又称为von Recklinghausen病或周围神经纤维瘤病,临床主要表现为外周神经纤维瘤、牛奶咖啡斑、视神经胶质瘤、虹膜黑色素错构瘤(Lisch结节)等[1]。随着MRI在临床应用中的普及,国外已有文献报道NF-1患者T2WI脑内出现异常高信号,由于病理改变并不明确,故称为脑内不明原因亮点(undefined bright objects,UBOs),目前国内关于UBOs的MRI研究文献不多,且多无纵向追踪观察,对UBOs的MRI表现的认识有待于进一步提高。本文运用MRI系统探讨NF-1患者脑实质内UBOs的特点及其临床价值。 1 资料与方法 1.1 研究对象
选取2009年6月至2014年12月我院收治的26例18岁以下NF-1患者作为研究对象,其中男18例,女8例,年龄3个月至18岁,平均年龄12±4岁。所有患者按照美国国立卫生研究院的NF-1诊断标准对患者进行纳入,符合以下2项或2项以上即可:(1)牛奶咖啡斑≥6个;(2)≥2个任何类型的神经纤维瘤,≥1个丛性神经纤维瘤;(3)腋窝或腹股沟雀斑;(4)视神经胶质瘤;(5)≥2个Lisch结节;(6)特征性骨损害,如蝶骨发育不全、长骨皮质变薄或假性关节炎;(7)一级亲属(父母、子女和兄弟姐妹)患NF-1。 1.2 MRI成像参数和图像分析
MRI扫描采用GE3.0T MR扫描仪,行常规轴面、矢状面、冠状面扫描,层厚约5 mm,层间距约1.0 mm。T1WI扫描参数:自旋回波序列,TR 400~600 ms,TE 15~20 ms;T2WI扫描参数:快速自旋回波序列,TR 2 000~4 000 ms,TE 80~120 ms;FOV18 cm×20 cm,激励次数2~4次,矩阵为224×256~256×256;Gd-DTPA剂量为0.1 mmol/kg。
由两位具有从事神经影像的副教授分别阅片确定UBOs,如意见不一,讨论后决定。UBOs的判定标准:脑内片状异常信号,T2WI呈高信号,T1WI呈等信号,Flair呈高信号,增强扫描无强化,无占位效应,周围无水肿。 1.3 统计学分析
采用SPSS 17.0统计软件对数据进行统计学分析,计数资料采用百分率(%)表示,组间比较采用Fisher确切概率法,P<0.05为差异有统计学意义。 2 结果
26例临床确诊为NF-1的患者进行MRI检查,其中13岁以下者15例,14~18岁者11例。9例脑实质内出现UBOs(35%),UBOs 于T2WI呈高信号,T1WI呈等信号,Flair呈高信号,增强扫描无强化,无占位效应,周围无水肿(图 1)。13岁以下脑实质内出现UBOs 8例(53%),14~18岁1例(9%),差异有统计学意义(P=0.036);男性患儿脑实质内出现UBOs 7例(39%),女性患儿2例(25%),差异无统计学意义(P>0.05)。9例患儿总共发现UBOs 35个,发病部位上,苍白球出现率最高(57%,20/35),其中苍白球双侧发病8例,单侧发病1例;背侧丘脑为17%(6/35),脑干、海马、小脑齿状核均为9%(3/35)。
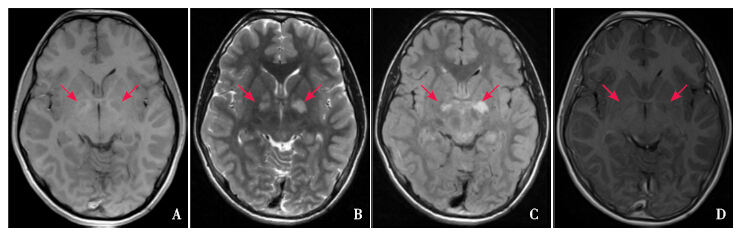 |
图 1 UBOs的典型MRI表现 A~D分别为T1WI、T2WI、Flair、增强后T1WI横断位,显示双侧苍白球UBOs,双侧苍白球呈比较对称的片状异常信号,T1WI呈等信号(箭头所示),T2WI呈高信号(箭头所示),Flair呈高信号(箭头所示),增强扫描无强化,无占位效应,周围无水肿(箭头所示)。 |
9例患者中有3例患者进行了MRI复查。1例分别于1年后、3年后复查,显示患者右侧苍白球及右侧丘脑逐渐缩小(图 2);1例亦出现类似变化,右侧苍白球UBOs较前缩小;另1例患者仅3年后复查,患者右侧苍白球及右侧丘脑病灶明显缩小,左侧小脑齿状核病灶消失(图 3)。9例患者中仅1例(18岁)出现神经症状,UBOs位于右侧丘脑及中脑右侧,表现为睡眠异常。
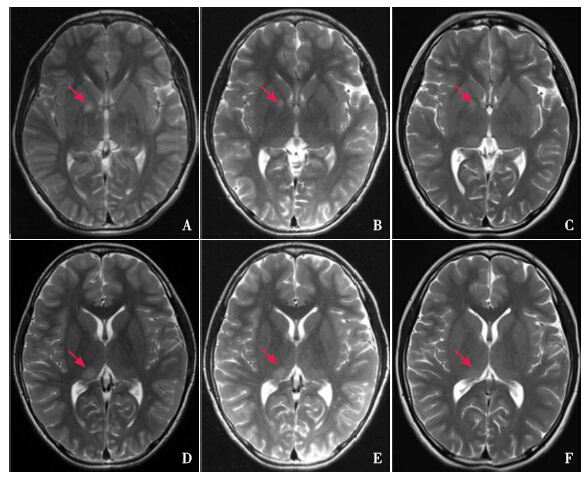 |
图 2 UBOs的演变 患者,女,首次就诊年龄为11岁。A、D为首次T2WI横断位,分别示右侧苍白球及右侧丘脑UBOs呈类圆形高信号灶(箭头所示),边界清晰;B、E为1年后复查T2WI横断位,C、F为3年后复查T2WI横断位,图B、C示右侧苍白球UBOs随年龄增长逐渐缩小,信号较前逐渐减低(箭头所示),边界较前模糊;图E、F示右侧丘脑UBOs逐渐缩小甚至消失(箭头所示)。 |
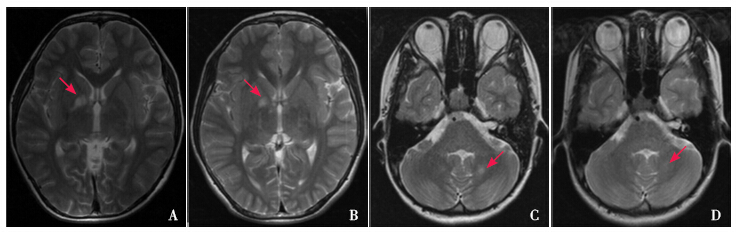 |
图 3 UBOs的演变 患者,女,首次就诊年龄为13岁。A、C为首次T2WI横断位,分别示右侧苍白球及左侧小脑齿状核UBOs呈斑片状高信号灶(箭头所示),边界清晰。B、D为3年后复查T2WI横断位,图B示右侧苍白球类圆形UBOs尺寸明显缩小,信号较前减低(箭头所示),边缘模糊;图D示左侧小脑齿状核UBOs基本消失(箭头所示)。 |
神经纤维瘤病是一种常染色体显性遗传疾病,其中50%因遗传而发病,另外50%由基因突变发展而来。根据临床表现和疾病基因定位至少分为2型,其中NF-1型也称为von Recklinghausen病或周围神经纤维瘤病,是最常见的神经皮肤综合征,发病率为1 : 3 000~1 : 4 000。NF-1基因定位于染色体17q11.2区域,基因产物为神经纤维肽,具有调控细胞增殖与分化的功能,NF-1基因突变后引起细胞的增殖与分化异常。临床首发症状为皮肤表现,常见“牛奶咖啡”斑、腋窝或腹股沟区雀斑、皮下神经纤维瘤[2]。伴有视神经胶质瘤时出现进行性视力丧失。尽管NF-1为周围神经纤维瘤病,但国外已有文献报道NF-1患者脑内出现异常改变,这些异常改变表现为T2WI呈高信号,T1WI呈等信号,Flair呈高信号,增强扫描无强化,无占位效应,无水肿,因其病理生理机制尚未明确,故称为脑内不明原因亮点,即UBOs[3]。本研究系统地探讨26例NF-1患者脑内UBOs的影像学特点及与年龄、性别的相关性并追踪其随年龄增长的变化。
本组资料26例NF-1患儿中9例脑实质内出现UBOs,UBOs好发于13岁以下NF-1患儿,好发部位依次为苍白球、背侧丘脑、脑干、海马、小脑齿状核。UBOs的病理生理机制尚未明确,国外研究认为UBOs可能由髓鞘空泡样变性、局灶性胶质增生、华勒变性、白质不典型增生或肿瘤前病变等多种因素所致[3]。一部分研究者认为是髓鞘成熟异常导致髓鞘内多发空泡形成所致[4, 5],细胞从细胞外获取水分子,细胞内含水率增多及髓鞘内空泡导致T2WI呈高信号。经过多指数T2弛豫(multi-exponential T2 relaxtion,MET2)和轴突导向的分散性与密度成像(neurite orientation dispersion and density imaging,NODDI)的综合分析发现,虽然细胞内水分子增多,但细胞内外的含水率相对稳定,故不会引起脱髓鞘病变及神经轴突损伤[6, 7]。另一部分研究者认为T2WI高信号是由于局灶神经胶质细胞增生所致[8]。本文追踪研究发现3例患儿的UBOs随着年龄增长逐渐变小甚至消退,而且本研究显示14岁以上患儿UBOs发病率明显低于13岁以下,与文献的报道基本一致[5],也进一步提示该病变随着年龄增长可能自行消失。至于其病变可逆的原因,可能是随着年龄的增长,髓鞘的进一步成熟,髓鞘内空泡逐渐消失,导致UBOs缩小甚至消失。但也有文献报道UBOs演变为囊性肿块,出现明显强化,提示演变为肿瘤的可能[9]。笔者认为UBOs病理生理机制可能主要与髓鞘内空泡形成有关,但也不能排除合并局灶神经胶质细胞增生,从而导致UBOs不同的结局。由于UBOs的结局多样性,追踪观察是很有必要的,MRI应该为主要手段。
关于UBOs的数量、尺寸、大小是否与患者的临床表现有联系迄今为止还无确切的定论,有作者研究显示UBOs的数量、尺寸、大小与患者的临床表现并无相关性[5]。当UBOs发生于基底节区、脑干、小脑及大脑半球时,认知功能差异没有统计学意义,当UBOs发生于海马时,认知功能下降较其他部位更加明显[10]。另外,诸多研究已经表明不论其脑实质是否出现UBOs,NF-1患儿均会出现不同程度的认知功能障碍[11, 12, 13]。本研究中9例UBOs患儿,大部分并无神经系统症状或体征,这些患儿有待于进一步追踪观察。
随着影像技术的发展,一些学者不仅关注NF-1患儿脑内UBOs,也开始研究NF-1患儿脑部常规MRI表现正常区域。采用弥散张量成像(diffusion tenser imaging,DTI)研究NF-1患儿正常脑白质区域,显示这些区域部分各向异质性(fractional anistrophy,FA)值出现下降,横向和纵向弥散增高[14, 15, 16],提示NF-1患儿脑白质出现广泛微结构变化,NF-1并非仅为周围性改变,中枢神经系统也存在病理改变。Karlsgodt等[16]研究表明,脑白质FA值普遍下降,以额叶最为突出,并指出是由于神经纤维之间的间距增宽、松弛以及髓鞘内空泡形成所致。因此,对于NF-1患儿,不能仅仅关注其周围神经纤维的病变,应当也要重视中枢神经系统的病变。
NF-1患儿年龄越小,UBOs出现率高,13岁以下为高发年龄,Sabol等[7]研究显示UBOs的出现对于NF-1的诊断灵敏度为74%,在儿童中高达81%;其诊断的特异度在97%~100%之间,在儿童中的特异度为98%,也有研究者呼吁将UBOs作为NF-1的诊断标准之一[7],笔者认为必须提高对UBOs的认识,临床工作中不能忽视NF-1患儿的UBOs,而且对NF-1患儿进行脑部MRI检查及追踪复查是必要的。
总之,NF-1患儿UBOs的发病年龄、部位、MRI表现及演变具有一定规律,UBOs有望成为NF-1的诊断标准之一。在临床工作中应该重视UBOs的诊断,特别是某些患儿早期诊断为NF-1,但临床症状及体征不典型时可以考虑进行MRI检查,必要的定期随访和复查也很有必要。MRI新技术可以进一步揭示NF-1患儿脑部的微小结构改变。
| [1] | Shilyansky C, Karlsgodt KH, Cummings DM, et al. Neurofibromin regulates corticostriatal inhibitory networks during working memory performance[J]. Proc Natl Acad Sci USA, 2010, 107(29): 13141-13146. |
| [2] | 齐凤芹, 孙志刚, 赵志红, 等. 神经纤维瘤病1家系报告[J]. 中国当代儿科杂志, 2008, 10(4): 552. |
| [3] | Yousem DM, Grossman RI. Neuroradiology: the requisites[M]. 3rd ed. Philadelphia: Mosby Elsevier Inc, 2010: 306-307. |
| [4] | Ferraz-Filho JR, da Rocha AJ, Muniz MP, et al. Diffusion tensor MR imaging in neurofibromatosis type 1: expanding the knowledge of microstructural brain abnormalities[J]. Pediatr Radiol, 2012, 42(2): 449-454. |
| [5] | Billiet T, Madler B, Darker, et al. Characterizing the microstructure basis of ""unidentified bright objects"" in neurofibromatosis type 1: a combined in vivo multi-component T2 relaxation and multi-shell diffusion MRI analysis[J]. Neuroimage Clinic, 2014, 4(4): 649-658. |
| [6] | Khan A, Beri S, Baheerathan A, et al. Globus pallidus high-signal lesions: a predominant MRI finding in children with neurofibromatosis type 1[J]. Ann Indian Acad Neurol, 2013, 16(1): 53-56. |
| [7] | Sabol Z, Resic B, Gjergja JR, et al. Clinical sensitivity and specificity of multiple T2-hyperintensities on brain magnetic resonance imaging in diagnosis of neurofibromatosis type 1 in children: diagnostic accuracy study[J]. Croat Med J, 2011, 52(4): 488-496. |
| [8] | Barbier C, Chabernaud C, Barantin L, et al. Proton MR spectroscopic imaging of basal ganglia and thalamus in neurofibromatosis type 1: correlation with T2 hyperintensities[J]. Neuroradiology, 2011, 53(2): 141-148. |
| [9] | Griffiths PD, Blaser S, Mukonoweshuro W, et al. Neurofibromatosis bright objects in children with neurofibromatosis type 1: a proliferative potential?[J]. Pediatrics, 1999, 104(4): e49. |
| [10] | Hyman SL, Gill DS, Shores EA, et al. T2 hyperintensities in children with neurofibromatosis type 1 and their relationship to cognitive functioning[J]. J Neurol Neurosurg Psychiatry, 2007, 78(10): 1088-1091. |
| [11] | Klein-Tasman BP, Janke KM, Luo W, et al. Cognitive and psychosocial phenotype of young children with neurofibromatosis-1[J]. Int Neuropsychol Soc, 2014, 20(1): 88-98. |
| [12] | Payne JM, Pickering T, Porter M, et al. Longitudinal assessment of cognition and T2-hyperintensities in NF1:an 18-year study[J]. Am J Med Genet A, 2014, 164A(3): 661-665. |
| [13] | Lehtonen A, Howie E, Trump D, et al. Behaviour in children with neurofibromatosis type 1: cognition, executive function, attention, emotion, and social competence[J]. Dev Med Child Neurol, 2013, 55(2): 111-125. |
| [14] | Song SK, Sun SW, Ramsbottom MJ, et al. Dysmyelination revealed through MRI as increased radial (but unchanged axial) diffusion of water[J]. Neuroimage, 2002, 17(3): 1429-1436. |
| [15] | Ford JC, Hackney DB, Lavi E, et al. Dependence of apparent diffusion coefficients on axonal spacing, membrane permeability, and diffusion time in spinal cord white matter[J]. Magn Reson Imaging, 1998, 8(4): 775-782. |
| [16] | Karlsgodt KH, Rosser T, Lutkenhoff ES, et al. Alterations in white matter microstructure in neurofibromatosis-1[J]. PLoS One, 2012, 7(10): e47854. |
 2015, Vol. 17
2015, Vol. 17


