随着新生儿复杂危重先天性心脏病手术数量的增加,术后急性肾功能衰竭已成为影响新生儿早期预后的重要并发症,据统计,其发生率为10%~39%[1],病死率高达33%~79%[2]。腹膜透析操作简便,不需要建立另外的血管通路和全身抗凝,费用低,且小儿滤过率高,疗效确切,是目前新生儿和婴幼儿中、重度急性肾功能衰竭的首选替代治疗[3, 4]。然而,传统的腹膜透析并发症在新生儿中的发生率高于一般的婴幼儿,其原因是由于传统的腹膜透析置管过程中需切开腹壁、开放腹腔以及所用Tenckhoff管相对新生儿太长太大太硬所致[5]。Seldinger穿刺置管技术是临床上广泛应用的经皮穿刺置管术,其在穿刺置管过程中创伤小、操作安全简便,临床上应用Seldinger穿刺置管技术向腹腔内置入14G单腔静脉导管进行腹腔积液引流,具有无需切开腹壁及开放腹腔,引流效果良好的特点[6, 7]。而且,置入腹腔的14G单腔静脉导管与传统的腹膜透析Tenckhoff管相比,具有管径更小,更加柔软,组织相容性更好,长期留置不易损伤腹腔内器官的优点。近年来,我们对传统的腹膜透析术进行改良,采用Seldinger穿刺置管技术,在心脏手术后急性肾功能衰竭的新生儿中置入14G单腔静脉导管代替传统的Tenckhoff管进行腹膜透析,以期减少新生儿腹壁创伤,降低新生儿腹膜透析并发症的发生率。本研究将近年来在我院采用改良腹膜透析术进行腹膜透析的11例心脏手术后急性肾功能衰竭新生儿的临床资料进行分析和总结,报道如下。 1 资料与方法 1.1 研究对象
自2007年1月至2014年9月,我院共有11例先天性心脏病新生儿行体外循环下心脏直视手术后出现急性肾功能衰竭并接受改良腹膜透析治疗,其中男7例,女4例;年龄2~28 d;体重2.0~4.8 kg,平均3.2±0.7 kg。术前诊断为法洛四联症3例,完全性大动脉错位3例,完全性房室通道合并重度肺高压2例,房、室间隔缺损合并重度肺高压2例,完全性肺静脉异位引流1例。所有手术均在全麻体外循环下进行,其中法洛四联症根治术3例,双调转术(double switch) 3例,完全性房室通道矫治术2例,完全性肺静脉异位引流矫治术1例,房间隔缺损修补术和室间隔缺损合修补术2例。 1.2 腹膜透析指征及停用指征
术后持续少尿(每小时尿量<1 mL/kg,持续时间≥3 h),经液体量限制、利尿剂及正性肌力药物联合治疗无效;或血清肌酐浓度增高并出现持续代谢性酸中毒、高钾血症(血钾>5.5 mmol/L),容量超负荷、低心排出量综合征等任一种情况者予以腹膜透析[3]。
当循环稳定、尿量>1 mL/(kg · h),血肌酐<80 μmol/L,水、酸碱平衡,电解质正常,尿比重在正常范围,即停止腹膜透析[3]。 1.3 腹膜透析方法
于患儿床旁采用Seldinger穿刺置管技术,置入14G单腔静脉导管。术前应用床旁彩超明确腹腔积液情况,选择脐与右髂前上棘连线中内1/3处为穿刺点,向耻骨联合方向进针,先在皮下潜行1 cm左右后斜向下行进入腹膜腔,向膀胱直肠/子宫陷凹处送入导引钢丝。然后将单腔中心静脉导管沿导引钢丝插入腹腔,尽量使其末端达膀胱直肠凹陷处。导管用专用的固定装置妥善固定于腹壁,并用透明敷料贴覆盖伤口。导管外接腹透液套装(广州百特医疗用品有限公司)的连接导管进行腹膜透析。腹透液选择1.5%或2.5%葡萄糖乳酸盐(广州百特医疗用品有限公司),每100 mL含葡萄糖1.5 g或2.5 g,氯化钠538 mg,氯化钙25.7 mg,氯化镁5.08 mg,乳酸钠448 mg。腹透液经液体加温器加温至37℃,初始每次输入腹透液量为20 mL/kg,于15 min内缓慢流入。腹膜透析液在腹腔留置时间为30 min,流出腹腔时间为15 min,之后根据患儿临床体征改善情况、液体出入量平衡情况和血清肌酐调整透析液浓度及频率。 1.4 观察指标
每日常规检查血常规、血电解质、肝肾功能、血乳酸及腹膜透出液常规,密切注意血流动力学、动脉血气和腹膜透出液性状的变化。分别记录腹膜透析前、腹膜透析结束时尿量、血肌酐、血钾、血乳酸浓度。 1.5 统计学分析
所得数据应用SPSS 13.0统计软件包进行统计学分析。计量资料以均数±标准差(x±s)表示,腹膜透析前后各均值的比较采用配对t检验。P<0.05为差异有统计学意义。 2 结果
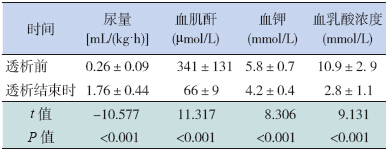
与腹膜透析前比较,患儿腹膜透析结束时尿量明显增加,血尿素氮、血肌酐、血钾、血乳酸浓度显著下降(表 1)。
| 表 1 患儿腹膜透析前后各指标的变化(n=11;x±s) |
11例患儿腹膜透析时间为36~120 h,平均47±24 h,呼吸机辅助时间为11±8 d,入住 ICU时间为22±19 d。随访3个月至3年,目前11例患儿均存活,且肾功能均正常。腹膜透析期间未发生腹膜透析液渗漏、穿刺点感染、腹腔感染等并发症。2例患儿出现导管引流不畅,经用肝素液冲管后恢复通畅。 3 讨论
需要在新生儿期手术的先天性心脏病多为复杂畸形、手术难度大,并且往往术前即存在心肺功能不全,内环境紊乱,病情危重,而且新生儿存在低体重、血容量少,各器官系统功能发育不完全,器官功能代偿储备功能差的特点,以上特点均被大量研究认为是术后发生急性肾功能衰竭的危险因素[5, 8],所以新生儿心脏术后急性肾功能衰竭的发病率明显高于一般儿童,严重影响新生儿心脏手术预后[9, 10]。腹膜透析治疗无需抗凝,操作过程几乎不影响血流动力学,尤其适用于心脏术后早期存在伤口出血倾向及呼吸循环不稳定的患儿[7, 11, 12, 13]。
然而,传统的腹膜透析术需要外科手术植入Tenckhoff管再连接腹膜透析系统进行透析,这对新生儿来说,可能存在如下缺点:(1)新生儿体重小,植入Tenckhoff管过程中的手术(腹壁1 cm切口)相对于新生儿创伤较大,手术过程中有一定量的失血,对于原本不稳定的血流动力学可能会产生不利的影响;而且手术过程开放了腹腔也可能增加腹膜炎的机会[8]。(2)新生儿腹腔较小,国内尚无专门应用于新生儿腹膜透析的Tenckhoff管,临床上目前应用的Tenckhoff管相对新生儿太长太大,实际应用过程中只能剪短Tenckhoff管,末端针刺侧孔,但这种类似于自制的管道,侧孔引流效果欠佳易发生管道堵塞。而且其修剪末端无法做到真正圆滑平整,加之导管材质较硬,新生儿肠管壁菲薄,发生肠穿孔的风险明显增加[14]。(3)新生儿腹壁薄,皮下脂肪少,没有足够的空间埋置Tenckhoff管及管上的涤纶套,易出现透析液渗漏,影响腹膜透析的疗效,增加腹腔感染和腹膜炎发生的风险。(4)传统植入Tenckhoff管手术切口虽然仅1 cm左右,对新生儿而言,仍属于较大切口,由于心脏术后合并急性肾功能衰竭的患儿腹壁薄,组织水肿,营养不良,容易导致切口不愈合,切口感染,切口裂开,发生腹膜炎[8]。(5)在拔除Tenckhoff管时需再次缝合切口,由于手术视野小加之患儿不配合,术中可能误缝肠道,或未能缝闭壁层腹膜,导致术后出现腹壁疝。
本研究采用的改良腹膜透析术,是对新生儿传统的腹膜透析置管术进行改良,采用Seldinger穿刺置管技术,应用14G单腔静脉导管代替Tenckhoff管进行腹膜透析。优点及操作注意事项如下:(1)操作简便,手术时间短,一般仅需3~5 min即可完成。(2)创伤小,几乎无出血,对血流动力学无影响。(3) 不易损伤腹内脏器,经过体外循环心脏手术的新生儿,术后出现急性肾功能衰竭等并发症时,由于血管渗漏等原因,腹腔内均有不同程度的腹腔积液,对腹内脏器具有一定保护作用。建议在操作前进行腹部彩超术检查,目的就是明确穿刺部位有无肿大的脏器、严重胀气的肠道以及腹腔积液。此外,在穿刺过程中进针动作轻柔缓慢,即使针尖触及肠管,肠道亦会反应性地收缩,自动躲避针尖,不易刺破肠管。(4) 置管过程中,静脉导管在腹壁内潜行1 cm,相当于埋置在皮下隧道中。整个穿刺过程无需开放腹腔,减少腹腔感染机会。(5)置管过程中,采用类似 “迷路”进针的方式逐层进入腹腔,而且由于新生儿皮肤弹性大,置管过程无需扩张皮肤及皮下组织即可将导管顺利置入腹腔,腹壁皮肤及皮下组织与静脉导管结合紧密,不易出现腹透液渗漏。(6)静脉导管相对Tenckhoff导管材质更软,长期置管也不会导致肠穿孔。(7)拔管容易,无需再次缝合伤口,避免损伤肠道或术后形成腹壁疝的可能。由此可见,与传统的腹膜透析相比,应用静脉导管进行腹膜透析,更符合新生儿的实际情况,出血、肠穿孔、透析液渗漏、腹腔感染、腹膜炎等传统腹膜透析术并发症[8, 15, 16, 17]的发生率更低,安全性更高。本组患儿在腹膜透析期间未发生腹膜透析液渗漏、穿刺点感染及腹腔感染,证实了改良腹膜透析的并发症发生率低。
应用14G单腔静脉导管代替Tenckhoff管进行腹膜透析,最大的顾虑主要是担心静脉导管管腔太小,易发生堵管及引流效果欠佳,影响腹膜透析疗效。我们在临床上,发现管道不畅时,应用注射器抽取肝素液进行管道冲洗,绝大部分静脉导管会再通;少部分可以向静脉导管内置入穿刺导丝疏通,穿刺导丝前端是柔软、可弯曲的,只要动作轻柔,一般不会损伤腔内器官;实在无法疏通的,则考虑拔除导管,重新置入新的静脉导管。至于静脉导管引流效果的问题,已经有大量的研究证实,应用14G单腔静脉导管进行腹腔积液引流效果好,安全有效[5, 7, 18]。本研究也证实,应用14G单腔静脉导管代替Tenckhoff管进行腹膜透析后,患儿心肺功能明显改善,尿量、血肌酐、血钾、血乳酸恢复正常,内环境酸碱平衡紊乱被纠正,肾功能恢复,均顺利康复,说明改良腹膜透析治疗是治疗新生儿心脏病手术后急性肾功能衰竭的一种安全、有效的手段。
综上所述,采用Seldinger穿刺置管技术,应用14G单腔静脉导管代替Tenckhoff管的改良腹膜透析术治疗新生儿心脏术后急性肾功能衰竭安全有效,操作简便、并发症少,值得在临床上推广应用。
| [1] | Sasser WC, Robert SM, Askenazi DJ, et al. Peritoneal dialysis: an alternative modality of fluid removal in neonates requiring extracorporeal membrane oxygenation after cardiac surgery[J]. J Extra Corpor Technol, 2014, 46(2): 157-161. |
| [2] | Mishra J, Dent C, Tarabishi R, et al. Neutrophil gelatinase-associated lipocalin (NGAL) as a biomarker for acute renal injury after cardiac surgery[J]. Lancet, 2005, 365(9466): 1231-1238. |
| [3] | 蔡及明, 史珍英, 周燕萍, 等. 腹膜透析在小儿心脏手术后急性肾功能不全中的应用[J]. 中华胸心血管外科杂志, 2007, 23(4): 224-227. |
| [4] | Kaddourah A, Goldstein SL. Renal replacement therapy in neonates[J]. Clin Perinatol, 2014, 41(3): 517-527. |
| [5] | Madenci AL, Stoffan AP, Rajagopal SK, et al. Factors associated with survival in patients who undergo peritoneal dialysis catheter placement following cardiac surgery[J]. J Pediatr Surg, 2013, 48(6): 1269-1276. |
| [6] | Agah S, Tavakoli S, Nikbakht H, et al. Central venous pressure catheter for large-volume paracentesis in refractory ascites[J]. Indian J Gastroenterol, 2014, 33(4): 310-315. |
| [7] | 聂晚年, 沈平, 刘彩霞, 等. 新型腹膜透析装置在抢救新生儿高钾血症中的应用[J]. 中国当代儿科杂志, 2015, 17(7):744-746. |
| [8] | Hakan N, Aydin M, Zenciroglu A, et al. Acute peritoneal dialysis in the newborn period: a 7-year single-center experience at tertiary neonatal intensive care unit in Turkey[J]. Am J Perinatol, 2014, 31(4): 335-338. |
| [9] | Goldstein SL. Advances in pediatric renal replacement therapy for acute kidney injury[J]. Semin Dial, 2011, 24(2): 187-191. |
| [10] | Stojanovic V, Bukarica S, Doronjski A, et al. Peritoneal dialysis in neonates with extremely low body weight at birth: new modality of using IV cannula for peritoneal access[J]. Iran J Pediatr, 2013, 23(6): 718-720. |
| [11] | Sasser WC, Dabal RJ, Askenazi DJ, et al. Prophylactic peritoneal dialysis following cardiopulmonary bypass in children is associated with decreased inflammation and improved clinical outcomes[J]. Congenit Heart Dis, 2014, 9(2): 106-115. |
| [12] | Ozker E, Saritas B, Vuran C, et al. Early initiation of peritoneal dialysis after arterial switch operations in newborn patients[J]. Ren Fail, 2013, 35(2): 204-209. |
| [13] | 邱梅冰, 陈平洋, 谢宗德. 新生儿先天性心脏病术后急性肾衰腹膜透析1例[J]. 中国当代儿科杂志, 2007, 9(1): 84. |
| [14] | Bojan M, Gioanni S, Vouhe PR, et al. Early initiation of peritoneal dialysis in neonates and infants with acute kidney injury following cardiac surgery is associated with a significant decrease in mortality[J]. Kidney Int, 2012, 82(4): 474-481. |
| [15] | Ricci Z, Di NM, Iacoella C, et al. Pediatric RIFLE for acute kidney injury diagnosis and prognosis for children undergoing cardiac surgery: a single-center prospective observational study[J]. Pediatr Cardiol, 2013, 34(6): 1404-1408. |
| [16] | Teitelbaum I. Peritoneal dialysis after cardiothoracic surgery: do it[J]. Perit Dial Int, 2012, 32(2): 131-133. |
| [17] | Santos CR, Branco PQ, Gaspar A, et al. Use of peritoneal dialysis after surgery for congenital heart disease in children[J]. Perit Dial Int, 2012, 32(3): 273-279. |
| [18] | Mercadante S, Intravaia G, Ferrera P, et al. Peritoneal catheter for continuous drainage of ascites in advanced cancer patients[J]. Support Care Cancer, 2008, 16(8): 975-978. |
 2015, Vol. 17
2015, Vol. 17