随着新生儿重症技术水平的快速发展,国内外学者关注的重点不仅在于如何提高早产儿生存率,而且更注重于存活早产儿的生存质量,而多项研究表明早产儿,尤其是宫内发育迟缓(IUGR)早产儿,出现脑瘫、学习与记忆能力降低、认知障碍和心理行为异常等神经系统不良预后的几率远高于健康足月儿[1, 2],故在早产不可避免的情况下,如何减少其后遗症显得尤为重要。有国外学者指出足月儿生后4 周内良好的体重增长对其学龄前期的智商发育有促进作用[3];同样,在早产儿中,生后良好的追赶性生长对其认知功能及神经系统发育也至关重要[4, 5]。但这些研究多定位于远期神经发育评估,关于早产儿生后早期的生长发育对其早期的神经发育是否同样具有影响尚不明确。本研究通过对比IUGR 早产儿与早产适于胎龄儿(AGA)生后前半年的体格发育和神经发育,探讨IUGR 早产儿生后早期生长迟缓对其早期神经发育的影响。 1 资料与方法 1.1 研究对象
研究对象为2008 年5 月至2012 年5 月在我院出生并在新生儿重症监护中心(NICU)住院治疗,且出院后能定期在高危儿门诊定期随访至校正胎龄6 个月的早产儿。
入选标准:(1)生后24 h 内入院;(2)胎龄不足37 周;(3)排除可影响生长发育的先天性代谢病及畸形;(4)排除死亡病例;(5)出院后能定期随访至校正胎龄6 个月的早产儿。
分组标准:根据早产儿出生体重和胎龄,依照中国15 城市不同胎龄新生儿出生体重值及IUGR 诊断标准[6],将患儿分为AGA 和IUGR 两组。 1.2 随访
出院后2 d 患儿回高危儿门诊复诊,建立高危儿档案,前半年每月随访1 次。随访内容包括:常规体格发育及神经运动发育监测、营养评估及指导、疾病防治、早期的干预指导。 1.3 生长迟缓的判断标准
体重或身长低于或等于该校正年龄该性别生长标准的第10 百分位(≤ P10)定义为生长迟缓。校正胎龄40 周时使用中国15 城市不同胎龄新生儿出生体重、身长标准[6],校正年龄3 个月、6 个月时使用中国城市0~18 岁男、女童体重、身长标准[7]。 1.4 神经发育评估
在校正胎龄3 个月、6 个月时采用Gesell 发育量表对小儿神经发育进行评估,内容包括大运动、精细动作、语言、适应性及个人社交5 项指标。 1.5 统计学分析
应用SPSS 20.0 统计软件对资料进行统计学分析。计量资料用均值± 标准差(x±s) 表示,两组间比较采用成组t检验,多组间比较采用方差分析。计数资料用例数和百分率表述,组间比较采用卡方检验。P<0.05 为差异有统计学意义。 2 结果 2.1 一般资料
符合入选标准的早产儿共有171 例,其中男108 例,女63 例。171 例早产儿中,IUGR 40例(23.4%),AGA 131 例(76.6%)。出生体重<1 500 g 的有38 例,1 500~1 999 g 的有37 例,2 000~2 499 g 的有67 例,≥ 2 500 g 的有29 例。
AGA 组的胎龄为28~36+3 周,出生体重为790~3 280 g。IUGR 组的胎龄为29+1~36+5 周,出生体重为730~2 400 g。至校正胎龄3 个月时,AGA组中共有112 例进行了Gesell 评估,IUGR 组中有34 例进行了Gesell 评估;至校正胎龄6 个月时,AGA 组中共有105 例进行了Gesell 评估,IUGR组中有30 例进行了Gesell 评估。校正胎龄6 个月时,体重追赶理想的AGA 和IUGR 组例数分别为120 例、31 例,其中进行Gesell 评估的例数分别为102 例、23 例。体重追赶理想组与非追赶理想组的出生体重、胎龄比较差异无统计学意义。 2.2 生长迟缓率
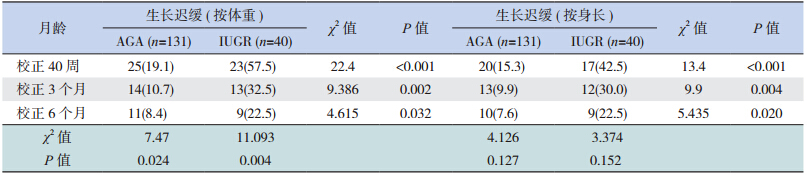
无论从体重、身长评价,IUGR 组生后3 个时间点(校正胎龄40 周、3 个月、6 个月)的生长迟缓率均高于AGA 组,差异有统计学意义;但是随着年龄的增长,IUGR 与AGA 两组之间的生长迟缓率差值逐渐缩小;按体重评价,两组的生长迟缓率随着年龄的增长也均逐渐下降,见表 1。
| 表 1 37 两组校正胎龄40 周、3 个月、6 个月的生长迟缓率 [n(%)] |
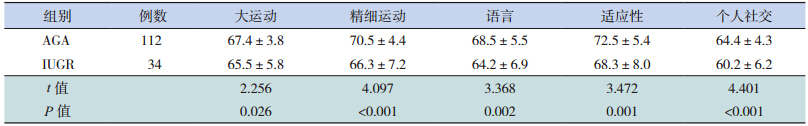
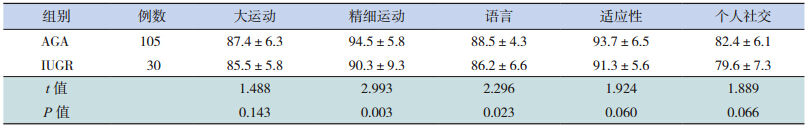
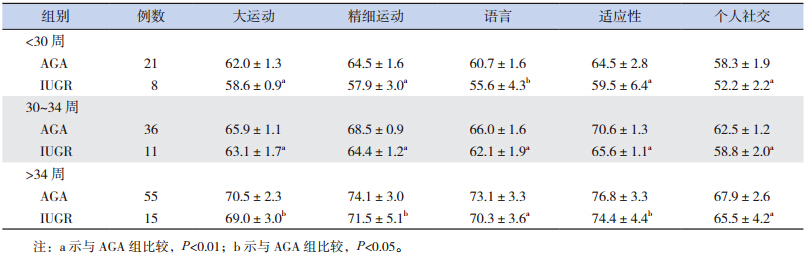
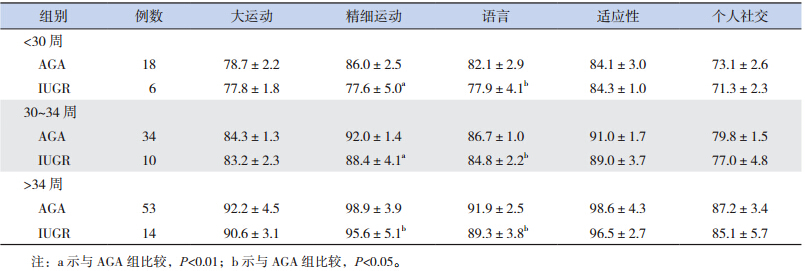
校正胎龄 3 个月时,IUGR 组 Gesell 发育量表中各项发育商均低于 AGA 组(P<0.05)。至校正胎龄 6 个月时,IUGR 组中各项发育商与 AGA 组差异较前减小,但精细运动及语言发育商两组之间比较差异仍有统计学意义(表 2~3)。对随访至校正胎龄 3、6 个月的早产儿进行胎龄分层分析显 示,在 <30 周、30~34 周 和 >34 周 3 个 胎 龄 段IUGR 组患儿 3 个月时 Gesell 发育量表中各项发育商均低于 AGA 组;至校正胎龄 6 个月时,其中精细运动及语言发育商仍低于 AGA 组(表 4~5)。
| 表 2 两组校正胎龄 3 个月时发育商评估(x±s) |
| 表 3 37 两组校正胎龄 6 个月时发育商评估(x±s) |
| 表 4 两组不同胎龄段校正胎龄 3 个月时发育商评估(x±s) |
| 表 5 两组不同胎龄段校正胎龄 6 个月时发育商评估(x±s) |
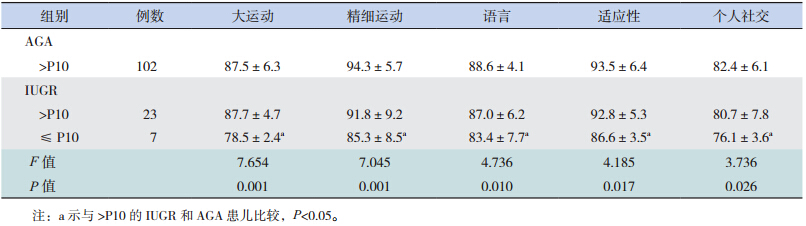
按体重评价,IUGR 组至校正胎龄6 个月时体重仍≤ P10 的患儿在Gesell 评估中各项发育商均低于追赶理想(>P10) 的IUGR 和AGA 患儿(P<0.05);且IUGR 组中追赶理想(>P10)的患儿与AGA 组(>P10)的发育商比较差异无统计学意义,见表 6。
| 表 6 追赶生长与发育商的关系(x±s) |
大量证据表明,早产儿,包括 AGA 和小于胎龄儿(SGA)在生后早期的生长直接关系到神经系统结局;与 AGA 相比,SGA,尤其是追赶性生长差的更容易导致神经系统不良结局 [8]。一项对极低出生体重儿的精神运动发育评估显示,那些出生时 SGA 随访至 2 岁时体重仍低于第 10 百分位的患儿与追赶性生长理想的 SGA 和 AGA 比较,其智力及运动发育分值均明显降低 [9]。Smic 等 [10] 指出 IUGR 儿在学龄前期的语言发育明显落后于正常同龄儿; 此 外,Heinonen 等 [11] 还 发 现 SGA 患注意缺陷多动综合征的风险是 AGA 的 3.6 倍,而且出生体重与注意缺陷多动综合征之间的关系密切,出生体重每降低一个标准差,注意缺陷多动综合征的病症评分就增加 0.38。由此可见,SGA,尤其是追赶性生长不足的患儿与远期认知功能、情感障碍等神经系统发育异常有关。那么,SGA早期的生长落后对其早期的神经发育是否同样具有不良影响,国内外研究较少,故本研究的重点主要是探讨早期两者之间的相关性,从结果中发现无论从体重或身长评价,IUGR 在校正胎龄 40周、3 个月、6 个月时生长迟缓率均明显高于 AGA组,与之相对应的是 IUGR 在校正胎龄 3 个月时的 Gesell 各项发育商分值均落后于 AGA 组,6 个月时精细运动及语言发育商低于 AGA 组,提示生长迟缓与低发育商之间存在一定的关系。随着年龄的增长及临床干预的进行,IUGR 与 AGA 的生长迟缓率均逐渐下降,两组之间的差值也逐渐缩小,体重迟缓率差值从 3 个月的 21.8% 下降至 6个月时的 14.1%,IUGR 组体重迟缓率也从 3 个月龄的 32.5% 下降至 6 个月龄的 22.5%;随着而来的是 IUGR 组 6 个月龄时各项发育商与 AGA 组之间的差异较 3 个月时缩小,其中,大运动、适应性及个人社交 3 项两组之间比较差异已无统计学意义。 本研究通过进一步对 3 个月、6 个月的胎龄分层结果分析,排除了不同胎龄对分析早期生长发育对早期神经系统的干扰。以上结果提示随着生长的追赶,达到追赶理想的患儿比例逐渐增加,其发育商随之也有明显的增长。不仅如此,本研究又进一步比较了 IUGR 组在校正胎龄 6 个月时体重仍≤ P10 的患儿与追赶生长理想(>P10)的那部分 IUGR 和 AGA 患儿之间的发育商,发现6 个月时追赶生长不理想的 IUGR 患儿各项发育商均落后于其余两组,说明了早期追赶生长落后可影响早期神经智能的发育,通过降低生长迟缓率,可改善这一现象。因此,如何避免 IUGR 的发生以及加快 IUGR 生后早期的追赶性生长显得尤为重要。IUGR 的发生是由于母体、胎盘和胎儿的各种病理因素导致胎儿在宫内的生长发育受到限制,未能发挥最佳的生长潜能;而对于生后的 IUGR 患儿,早期的营养管理对其追赶性生长至关重要。近年来,世界卫生组织、美国、欧洲等营养学会先后发布了关于早产 / 低出生体重儿营养管理的指南 [12],我国在 2013 年也更新了中国新生儿营养支持指南 [13]。而 IUGR 生后的营养策略与 AGA 不同,既要促进适度生长,保证良好的神经系统结局,又要避免过度喂养,降低远期代谢综合征的风险 [14]。对于 IUGR 患儿,母乳喂养是避免其发生神经系统不良结局的保护因素,母乳喂养的 IUGR患儿在 18 月龄的智力和运动发育指数分别高于人 工 喂 养 组 8.2 分(95%CI:5.0~11.4) 和 5.8 分(95%CI:2.8~8.7) [14]。因此,在综合考虑胎龄、出生体重及合并症等因素影响下,对于 IUGR 患儿生后应早期采用个体化的营养管理策略,达到满意的追赶性生长,以降低其早期神经发育落后的风险。
| [1] | 王晓凤, 刘敬. 宫内生长受限对患儿远期神经行为及心理发育的影响[J]. 中华全科医师杂志, 2012, 11(3): 202-204. |
| [2] | Rogne T, Engstrom AA, Jacobsen GW, et al. Fetal growth,cognitive function, and brain volumes in childhood andadolescence[J]. Obstet Gynecol, 2015, 125(3): 673-682. |
| [3] | Smithers LG, Lynch JW, Yang S, et al. Impact of neonatalgrowth on IQ and behavior at early school age[J]. Pediatrics,2013, 132(1): e53-e60. |
| [4] | Belfort MB, Rifas-Shiman SL, Sullivan T, et al. Infant growthbefore and after term: effects on neurodevelopment in preterminfants[J]. Pediatrics, 2011, 128(4): e899-906. |
| [5] | Franz AR, Pohlandt F, Bode H, et al. Intrauterine, early neonatal,and postdischarge growth and neurodevelopmental outcome at5.4 years in extremely preterm infants after intensive neonatalnutritional support[J]. Pediatrics, 2009, 123(1): e101-e109. |
| [6] | 邵肖梅, 叶鸿瑁, 丘小汕. 实用新生儿学[M]. 第4 版. 北京:人民卫生出版社, 2011: 954-955. |
| [7] | 胡亚美, 江载芳. 诸福棠实用儿科学[M]. 第7 版. 北京: 人民卫生出版社, 2002: 27-33; 103-177. |
| [8] | Tudehope D, Vento M, Bhutta Z, et al. Nutritional requirementsand feeding recommendations for small for gestational ageinfants[J]. J Pediatr, 2013, 162(3): S81-S89. |
| [9] | Rogers EE, Piecuch RE. Neurodevelopmental outcomes ofinfants who experience intrauterine growth restriction[J]. NeoReviews, 2009, 10(2): 100-112. |
| [10] | Smic Klaric A, Kolundzic Z, Galic S, et al. Languagedevelopment in preschool children born after asymmetricalintrauterine growth retardation[J]. Eur J Paediatr Neurol, 2012,16(2): 132-137. |
| [11] | Heinonen K, Raikkonen K, Pesonen AK, et a1. Behaviouralsymptoms of attention deficit /hyperactivity disorder in pretermand term children born small and appropriate for gestationalage: a longitudinal study[J]. BMC Pediatr, 2010,10(15): 91-94. |
| [12] | Agostoni C, Buonocore G, Carnielli VP. ESPGHAN Committeeon Nutrition, Nutrient Supply for Preterm Infants: CommentaryFrom the European Society for Pediatric Gastroenterology,Hepatology and Nutrition Committee on Nutrition[J]. J PediatGastroenterol Nutr, 2010, 50(1): 1-9. |
| [13] | 中华医学会肠外肠内营养学分会儿科学组, 中华医学会儿科学分会新生儿学组, 中华医学会小儿外科学分会新生儿外科学组. 中国新生儿营养支持临床应用指南[J]. 中华小儿外科杂志, 2013, 34(10): 782-787. |
| [14] | Lapillonne A, Griffin IJ. Feeding preterm infants today for latemetabolic and cardiovascular outcomes[J]. J Pediatr, 2013,162(3): S7-S16. |
 2015, Vol. 17
2015, Vol. 17