2. 天津医科大学医学检验学院, 天津 300203;
3. 天津市北洋医学检测仪器与技术研究所, 天津 300300;
4. 天津市儿童医院免疫科, 天津 300074
过敏性紫癜[1, 2](Henoch-Schönlein purpura,HSP)是儿童期最常见的一种由IgA 介导的血管变态反应性、出血性疾病。它是一种多系统疾病,通常累及皮肤、关节、胃肠道及肾脏,但其他器官也有可能受累。临床表现为黏膜或皮肤之下的瘀斑与瘀点,且伴有一定的腹痛、关节肿痛及蛋白尿等。目前HSP 的病因与发病机制尚不明确,文献报道[3] 称HSP 发病主要与感染、药物及食物等因素有关,经体液免疫、细胞免疫、细胞因子、免疫球蛋白等介质,导致机体诱发HSP,但是HSP 的发病机制还未完全清楚。目前,临床实验室辅助检测标志物缺乏统一标准,亟需筛选出实验辅助诊断指标,基于已经报道HSP 发病相关病理生理因素,本研究筛选反应急性感染指标[血清淀粉样蛋白A(SAA)、C 反应蛋白(CRP)、白细胞介素(IL)-6、白细胞(WBC)计数]、免疫标志物指标[免疫球蛋白(Ig)A、IgM、IgE、IgG、抗链球菌溶血素O(ASO)] 及血管透性相关标志物[补体(C3、C4)及血清铁蛋白(Fer)],对这些指标进行ROC 曲线分析,评价各项生物学标志物对辅助检查HSP 的价值,并同时确定其在辅助诊断HSP 时的敏感性、特异性及最佳临界值。 1 资料与方法 1.1 研究对象
选取2012 年4 月至2014 年3 月于天津市儿童医院就诊的127 例HSP 患儿为研究对象,其中男68 例,女59,年龄2~14 岁,中位年龄7.3 岁;另选取在本院体检的健康儿童127 例为对照组,其中男65 例,女62 例,年龄2~13 岁,中位年龄7.2 岁。所有患儿入选标准均符合《儿科学》第8 版HSP 的诊断标准[4]。 1.2 采集标本
两组儿童于清晨空腹采集静脉血2~3 mL,离心后取上层血清保存于-80℃统一进行测定。 1.3 方法
利用罗氏COBASE601 电化学发光检测仪(罗氏公司,德国)测定血清IL-6 和IgE,试剂盒购自罗氏诊断产品(上海)有限公司。利用贝克曼库尔特IMMAGE 800 特定蛋白分析系统(贝克曼库尔特有限公司,美国)测定IgA、IgM、IgG、补体(C3、C4)及ASO,试剂盒购自美国贝克曼库尔特有限公司。利用Unicel DXI 800 免疫分析系统(贝克曼库尔特有限公司,美国)检测Fer,试剂盒购自美国贝克曼库尔特有限公司。应用希森美康XS-800i 全自动五分类血液分析仪进行全血WBC 计数分析。利用Nycocard READER Ⅱ金标定量仪(挪威Axis-Shield PoC AS 公司)检测血清CRP,试剂盒购自Axis-Shield PoC AS 公司。采用ELISA 法测定SAA 含量,检测试剂盒购自上海鑫乐生物科技有限公司。检测步骤按照各试剂盒说明书进行。 1.4 统计学分析
应用SPSS 19.0 统计软件对数据进行统计学分析,计量资料以中位数(四分位间距)[M(P25,P75)] 表示,两组间比较采用Mann-Whitney U 检验。采用受试者工作特征曲线(ROC)分析筛选出的生物学指标对HSP 的诊断价值,当曲线下面积(AUC)在0.5 以下时无诊断价值,0.5~0.7 时有较低准确性,0.7~0.9 时有一定准确性,面积在0.9 以上时有较高准确性。P<0.05 为差异有统计学意义。 2 结果 2.1 两组血清各生物学标志物水平分析
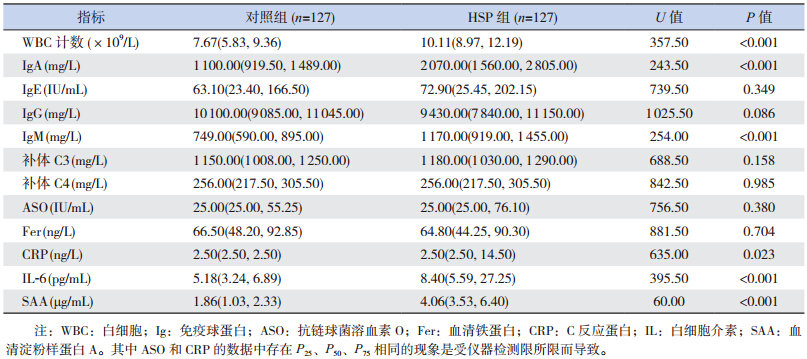
分析两组间12 项生物学标志物含量,结果发现HSP 组IL-6、SAA、IgA、IgM、CRP 和WBC 等6 项标志物含量明显高于对照组(P<0.05),而IgE、IgG、ASO、C3、C4 及Fer 等6 项指标水平与对照组比较差异均无统计学意义(P>0.05)。见表 1。
| 表 1 两组间各项生物标志物水平比较 [M(P25,P75)] |
ROC 曲线分析显示,HSP 患者SAA、IL-6、WBC、IgA 和IgM 的AUC 均>0.7,且差异具有统计学意义(P<0.05),对诊断HSP 有一定的临床价值。CRP 的AUC 为0.622,且差异无统计学意义(P>0.05),对HSP 的诊断价值较低。见图 1,表 2。
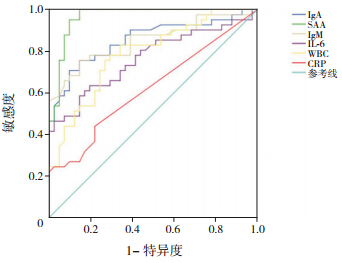 |
图 1 ROC 曲线分析各项生物学标志物对HSP 的诊断价值 |
| 表 2 ROC 曲线分析各项生物学标志物对HSP的诊断价值 |
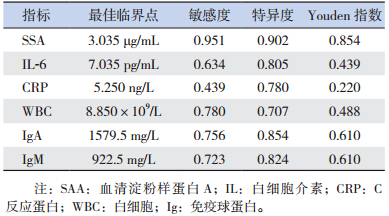
| 表 3 各项指标最佳临界值比较 |
据报道HSP 的主要临床表现为下肢和臀部皮疹;脚踝和膝盖关节发热、肿痛;65% 的患儿可出现腹部疼痛的症状;肾脏受累是HSP 最严重的后遗症。目前HSP 的诊断主要依靠临床表现和病史,缺乏有效的实验室检测指标。最近报道在组织损伤、感染和外伤等炎症性反应时,可刺激体内SAA 迅速上升1 000 倍[5],且SAA 在类风湿性关节炎患者血清中含量明显升高[6, 7]。本文旨在探讨HSP 患者体内SAA 及多项炎性标志物(CRP、IL-6、WBC)、免疫标志物(IgA、IgM、IgE、IgG、ASO)、血管透性相关标志物(补体C3、C4及铁蛋白)含量变化,发现SAA、IL-6、CRP、WBC、IgA 和IgM 等6 项标志物水平明显高于对照组。
ROC 曲线分析此6 项指标的诊断价值,发现SAA AUC 为0.964,诊断HSP 的价值在各单项指标中最高。以3.035 μg/mL 为诊断临界点时敏感度为95.1%,特异度为90.2%。He 等[8] 发现 SAA 水平与HSP 严重程度无关,与病程有关。而且SAA水平在胃肠道受累患者中更高,推测 SAA 水平与HSP 的病程和胃肠道症状有关,SAA 有可能作为临床筛查的指标之一。另外,有报道HSP 患者的小血管和毛细血管等处发生免疫复合物沉积,出现机体免疫紊乱现象[9]。测定患者IgA 和IgM 含量,结果明显高于对照组,其AUC 分别为0.855、0.849。以IgA 1 579.5 mg/L 为最佳临界点时,敏感度为75.6%,特异度为85.4%。以IgM 922.5 mg/L 为最佳临界点时,敏感度为72.3%,特异度为82.4%。其诊断效能仅次于SAA。
进一步分析血WBC 与CRP 水平结果明显高于对照组,这与之前报道相一致。ROC 曲线分析结果显示WBC 的曲线面积为0.787,在8.85×109/L的最佳临界点处的敏感度是78.0%,特异度是70.7%,其诊断HSP 效能方面尚可,可作为此疾病的筛查指标之一。CRP 的AUC 为0.622,对于诊断HSP 的准确性较低,虽然具有较高的特异度,但其敏感度较低。分析血清IL-6,结果显示明显高于对照组,ROC 曲线分析仅次于WBC,且在7.035 pg/mL 的临界点时,与WBC 相较具有较低的敏感度,较高的特异度,联合WBC 检测,可以作为实验室HSP 的指标。
综上所述,在辅助检查中SAA 价值最高,其次为IgA 和IgM,WBC 和IL-6,而CRP 不佳。
| [1] | Nalbantoglu S, Tabel Y, Mir S, et al. Association between RASgene polymorphisms (ACE I/D, AGT M235T) and Henoch-Sch?nlein purpura in a Turkish population[J]. Dis Markers,2013, 34(1): 23-32. |
| [2] | 余艳, 潘凯丽. 细胞因子在过敏性紫癜性肾炎发病机制中的作用[J]. 中国当代儿科杂志, 2009, 11(10): 869-872. |
| [3] | Kraft DM, Mckee D, Scott C. Henoch-Sch?nlein purpura: areview[J]. Am Fam Physician, 1998, 58(2): 405-408, 411. |
| [4] | 王卫平. 儿科学[M]. 第8 版. 北京: 人民卫生出版社, 2013:190-192. |
| [5] | 5Rho YH, Chung CP, Oeser A, et al. Inflammatory mediatorsand premature coronary atherosclerosis in rheumatoidarthritis[J]. Arthritis Rheum, 2009, 61(11): 1580-1585. |
| [6] | Targońska-St?pniak B, Majdan M. Serum amyloid A as a markerof persistent inflammation and an indicator of cardiovascularand renal involvement in patients with rheumatoid arthritis[J].Mediators Inflamm, 2014, 2014: 793628. |
| [7] | 穆云, 魏蔚, 张福江, 等. 血清淀粉样蛋白A 在类风湿关节炎患者体内表达的研究[J]. 中华风湿病学杂, 2011, 15(11):783-786. |
| [8] | He X, Zhao Y, Li Y, et al. Serum amyloid A levels associatedwith gastrointestinal manifestations in Henoch-Sch?nleinPurpura[J]. Inflammation, 2012, 35(4): 1251-1255. |
| [9] | Yuan LP, Bo Y, Ling L, et al. Expression of T-cellimmunoglobulin- and mucin-domain-containing molecule-3 onlymphocytes from Henoch-Schöenlein Purpura patients[J]. IranJ Pediatr, 2013, 23(3): 345-348. |
 2015, Vol. 17
2015, Vol. 17