2. 华中科技大学同济医学院附属同济医院儿科, 湖北 武汉 430030
婴儿捂热综合征(infant muggy syndrome,IMS)是冬春季节1 岁以下婴儿由于过度保暖或捂闷过久所致的以缺氧、高热、大汗、脱水、休克、抽搐、昏迷等为主要表现的征候群。多器官功能障碍综合征(multiple organ dysfunction syndrome,MODS)是其常见并发症,致死率及致残率均较高。血清降钙素原(procalcitonin,PCT)是降钙素前体,由116 个氨基酸组成的糖蛋白,相对分子质量13 kD,生理情况下由甲状腺细胞产生,由降钙素I(CALC-I)基因编码,正常人血清浓度<0.05 ng/mL[1]。研究表明,血清PCT 水平不仅可反映脓毒症合并MODS 时的严重程度及预后,且与其他非感染性因素诱发的MODS 亦有良好的相关性,如中暑、严重创伤、吸入性损伤、严重烧伤、重大手术和器官移植等[2, 3, 4, 5, 6, 7, 8]。这些感染性或非感染性因素引起的全身炎症反应(systemic inflammatoryresponse syndrome,SIRS)过程中,可释放多种细胞因子和炎症介质,其中包括PCT、白细胞介素、肿瘤坏死因子等,所有这些是导致MODS 的基础,其中PCT 较其他细胞因子产生更早,是MODS 早期独立预测因子[6, 7, 8]。但目前关于血清PCT 水平与IMS 及其严重程度相关性研究却鲜见报道,为此,本研究采取回顾性研究方法,探讨PCT 水平在评估IMS 病情严重程度及其并发MODS 可能性中的作用。 1 资料与方法 1.1 研究对象及分组
选取2011 年1 月至2014 年11 月于武汉市儿童医院重症监护病房收治的IMS 患儿71 例为研究对象,诊断标准参照《儿科急诊医学》[9]。纳入标准:(1)1 岁以内婴儿,既往身体健康;(2)发病24 h 内入院;(3)有明确的蒙被、衣被包裹过多、过紧、保暖过度病史;高热或体温不升,大汗淋漓,面色苍白或发绀;或伴有脑、肺、心、肝、肾、消化道、血液等脏器功能不全的表现。排除合并感染患儿(包括肺部感染、感染性腹泻病、泌尿系感染、血流感染以及中枢神经系统感染等)。最终有50 例符合标准的患儿纳入本研究,其中男18 例,女32 例,年龄29 d 至5 个月,平均年龄3.0±1.8 个月。所有病例进行以下分组:(1)根据患儿随访30 d 是否存活分为存活组(n=36)和死亡组(n=14);(2) 根据MODS 诊断标准[10]分为MODS 组(n=29)和非MODS 组(n=21)。 1.2 观察指标
记录患儿一般资料,包括姓名、性别、年龄、并发症及转归等;入院后24 h 内的体温、心率、血压、呼吸频率等生命体征;动脉血气分析、血常规、尿常规、凝血功能、肝肾功能、心肌酶谱、血电解质、C 反应蛋白(C-reactive protein,CRP)等生化指标;胸片、CT、MRI、B 超等影像资料。根据以上记录资料进行入院24 h 的小儿危重病例评分(pediatric critical illness score,PCIS)。 1.3 培养样本采集
所有患儿入院时即在上、下肢2 个部位采集静脉血分别送细菌、真菌培养;大便次数增加、性状改变时查大便培养;尿常规白细胞阳性时留取中段尿标本送细菌、真菌培养;表现抽搐、昏迷时行腰椎穿刺送脑脊液培养检查。 1.4 血清PCT 检测方法
所有患儿均在入院时、治疗前采集静脉血5 mL,半定量胶体金免疫结合法行床旁血清PCT水平测定。试剂盒由德国BRAHMS 公司提供,PCT ≥ 0.5 ng/mL 为阳性阈值。参照黄建宝等[11] 方法,将检验结果分5 组分段值:PCT ≤ 0.5 ng/mL、0.5 ng/mL<PCT#60;2.0 ng/mL、2.0 ng/mL ≤ PCT#60;10.0 ng/mL、10.0 ng/mL ≤ PCT#60;25.0 ng/mL、PCT ≥ 25.0 ng/mL,由低到高相应评分依次为1、2、3、4、5 分。 1.5 统计学分析
采用SPSS 16.0 统计软件对数据进行统计学分析。符合正态分布的计量资料以均数± 标准差(x±s)表示,两组间比较采用t 检验;非正态分布的计量资料以中位数(四分位数)[M(P25,P75)] 表示,两组间比较采用Mann-Whitney U 检验。计数资料以百分率(%)表示,两组间比较采用X2X 检验;血清PCT 水平与PCIS 评分的相关性采用线性回归分析,其预测MODS 发生的敏感性和特异性采用受试者工作特性(receiver operatorcharacteristic,ROC)曲线分析并计算曲线下面积(area under the curve,AUC)。P<0.05 为差异有统计学意义。 2 结果 2.1 血清PCT 检测结果
50 例患儿中,血清PCT 水平达阳性阈值(≥ 0.5 ng/mL)者有47 例,阳性率达94%(47/50)。 2.2 死亡组与存活组相关资料比较
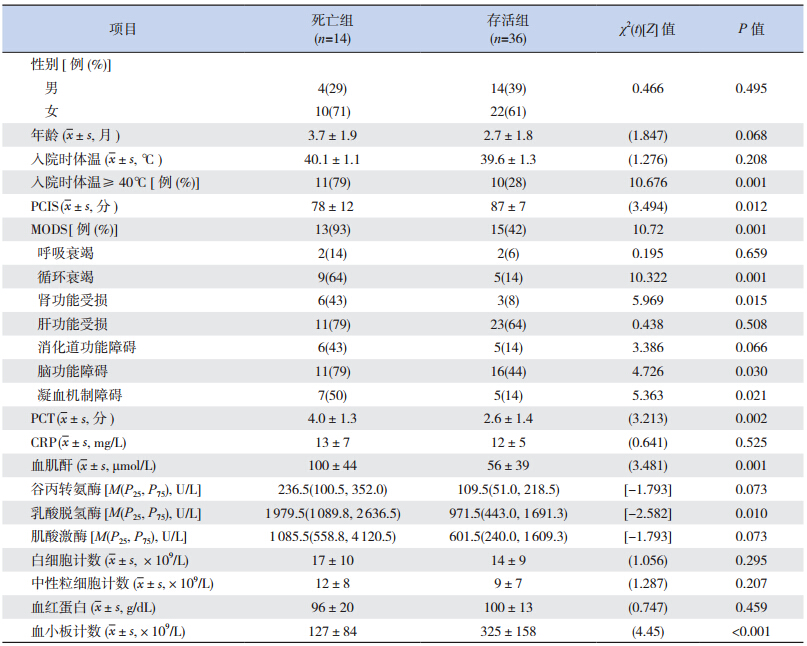
50 例IMS 患儿中,死亡14 例,病死率为28%(14/50),死亡原因均为多器官功能衰竭。死亡组中,入院时体温≥ 40℃患儿比例、血清PCT、血肌酐、乳酸脱氢酶水平及MODS 发生率明显高于存活组,PCIS 评分及血小板计数明显低于存活组(P<0.05)。MODS 以循环功能、脑功能、凝血机制障碍及肾功能受损发生差异最显著(P<0.05)。两组患儿血清CRP 水平、外周血白细胞(WBC)计数、中性粒细胞(NEU)计数等指标比较差异无统计学意义(P>0.05)。见表 1。
| 表 1 死亡组与存活组患儿相关临床资料比较 |
50 例IMS 患儿入院时血清PCT 水平与PCIS评分呈显著负相关(r=-0.84,P<0.05),见图 1。
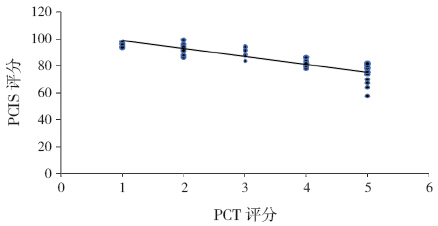 |
图 1 PCIS 评分与血清PCT 浓度相关曲线图 |
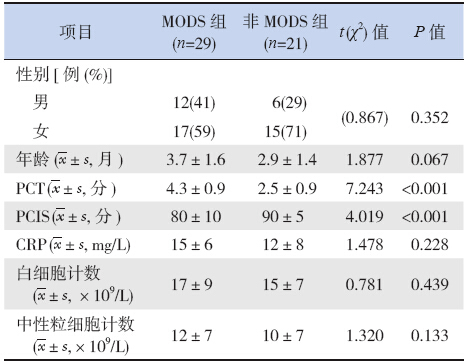
MODS 组患儿血清PCT 水平明显高于非MODS 组,PCIS 评分明显低于非MODS 组(P<0.01);两组间血清CRP 水平、外周血WBC及NEU 计数比较差异无统计学意义(P>0.05),见表 2。
| 表 2 MODS 组与非MODS 组患儿相关临床资料比较 |
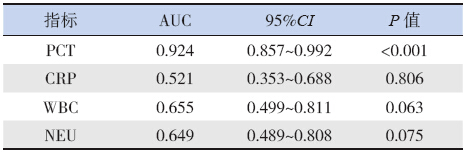
对预测IMS 患儿发生MODS 的血清PCT 值进行ROC 曲线分析显示:以发病24 h 血清PCT 值为10.6 ng/mL 作为截断点,预测MODS 发生的敏感度和特异度分别79.3% 和90.5%,AUC 为0.924(95%CI:0.857~0.992,P<0.001)。血清CRP、外周血WBC 及NEU 计数对早期预测MODS 发生没有价值。见图 2、表 3。
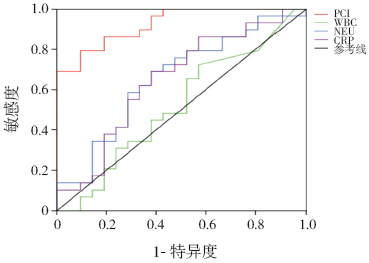 |
图 2 血清PCT、CRP、外周血WBC 及NEU 计数预测MODS 发生的ROC 曲线图 |
| 表 3 血清PCT、CRP、外周血WBC 及NEU 计数对IMS发生MODS 的预测价值 |
IMS 是寒冷季节小婴儿较常发生的一种严重意外伤害性疾病,起病急,发展迅速,预后差。由于捂热或蒙被造成的缺氧以及因高热、大汗导致的有效循环血量减少、组织低灌注和微循环障碍、细胞线粒体功能障碍、溶酶体破坏,使全身组织细胞呈缺血缺氧性损伤,继而导致脑、心肌、肝脏、肾脏、消化道、血液等MODS 的发生甚至死亡[12]。本研究中,IMS 患儿病死率高达28%(14/50),与国内报道相近[13];在死亡组中,入院时体温超过40℃患儿比例及MODS 发生率明显高于存活组,说明超高热及MODS 的发生是导致IMS 患儿死亡的重要原因。小婴儿运动功能发育尚未完善,包裹过严时,因无力挣脱捂热及缺氧环境,造成捂热时间持续过长,体温持续升高。而过高的温度可直接损伤细胞膜及细胞器,使心、肺、脑等重要脏器的细胞产生不可逆性的损害,最终导致MODS 发生甚至死亡。
在脓毒症合并MODS 时,肝脏中的巨噬细胞、单核细胞,肺与肠道组织的淋巴细胞和神经内分泌细胞均能合成及分泌PCT,导致血清中水平升高[7],且升高程度可以反映脓毒症的严重程度及预后[2, 3, 4, 5, 14]。现有研究表明,除了感染外,血清PCT与其他非感染性因素诱发的MODS 亦有良好的相关性[6, 7, 8]。Hausfater 等[6] 研究表明,中暑患者在入院初血清PCT 水平明显升高,且与患者病情严重程度密切相关;另一研究获得类似结论,同时还发现血清PCT 水平可预测中暑患者的预后[7]。以上感染性或非感染性因素引起的SIRS 过程中,可释放多种细胞因子和炎症介质,其中包括PCT、白细胞介素、肿瘤坏死因子等,所有这些是导致MODS 的基础,其中PCT 较其他细胞因子产生更早,在SIRS 早期(2~3 h)即可升高,6~12 h 明显超过正常,12~24 h 达高峰,是MODS 早期独立预测因子,且与疾病的严重程度呈正比,对临床早期诊断具有重要意义[15]。本次研究中,94% IMS 患儿发病24 h 内血清PCT 水平均已升高,而且发生MODS较未发生MODS 患儿的PCT 水平更高。进一步采用ROC 曲线评价血清PCT 水平与预测MODS 发生之间的关系,结果显示以10.6 ng/mL 为截断点,其敏感性和特异性分别为79.3% 和90.5%,且具有较高的准确性,因此,可将其作为IMS 发生MODS的一种早期生物学标记。
目前,临床评估危重患儿病情严重程度主要采用PCIS,包括心率、呼吸、血压、动脉氧分压、pH、血钠、血钾等10 项生理指标,反映了患儿全身各系统的状态,危重评分越低,病情越重,预后越差[16]。本组研究中,死亡组患儿PCIS 明显低于存活组,MODS 患儿PCIS 亦明显低于非MODS患儿;另外,本研究结果显示,死亡组患儿血清PCT 水平明显高于存活组,而且PCT 水平与PCIS评分呈显著负相关,说明血清PCT 水平越高,患儿病情越严重,PCT 水平与IMS 病情严重性密切相关。
外周血WBC、NEU 计数和CRP 是儿科临床常用的炎性指标。一般认为,当机体遭受感染性或非感染性炎症刺激后会产生大量NEU 趋化因子,白细胞在短期内激活、骤增,并在MODS 发病机制中发挥重要作用。但也有研究者发现,该指标在MODS 患者中假阳性率过高(达37.9%)[17];而对于IMS 患儿,因缺氧、高热刺激以及大汗导致血液浓缩,发病早期外周血WBC 及NEU 计数均可增高。本研究显示,与非MODS 组及存活组比较,MODS 组以及死亡组患儿外周血WBC 及NEU计数并无显著增高。CRP 属急相蛋白,由细胞因子和炎性介质刺激肝细胞合成和分泌,是急相反应中变化最显著的一种蛋白质,在多数SIRS 中均可非特异性升高,但CRP 在炎症过程开始8~12 h后才能从血清中检测出,达高峰时间需36~50 h,明显迟于PCT 水平的升高。本研究结果显示,尽管IMS 患儿血清CRP 水平亦升高,但在MODS 和非MODS 组以及存活组与死亡组之间其水平无明显差异。ROC 曲线分析提示外周WBC、NEU 计数和CRP 均与IMS 合并MODS 的早期预测无关。
综上所述,PCT 作为一项炎症指标,能及时床旁检测,技术操作简单易行、方便快捷。其血清水平与IMS 患儿病情严重程度密切相关,对早期发生MODS 有预测价值。
| [1] | Reinhart K, Meisner M. Biomarkers in the critically ill patient:procalcitonin[J]. Crit Care Clin, 2011, 27(2): 253-263. |
| [2] | Mathew B, Roy DD, Kumar TV. The use of procalcitonin as amarker of sepsis in children[J]. J Clin Diagn Res, 2013, 7(2):305-307. |
| [3] | Jekarl DW, Lee SY, Lee J, et al. Procalcitonin as a diagnosticmarker and IL-6 as a prognostic marker for sepsis[J]. DiagnMicrobiol Infect Dis, 2013, 75(4): 342-347. |
| [4] | Azevedo JR, Torres OJ, Czeczko NG, et al. Procalcitonin as aprognostic biomarker of severe sepsis and septic shock[J]. RevCol Bras Cir, 2012, 39(6): 456-461. |
| [5] | 刘少锋, 杨健, 刘敏. 降钙素原与创伤的研究进展 [J]. 华西医学, 2012, 27(5): 789-793. |
| [6] | Hausfater P, Hurtado M, Pease S, et al. Is procalcitonin a markerof critical illness in heatstroke[J]? Intensive Care Med, 2008,34(8): 1377-1383. |
| [7] | Tong HS, Liu YS, Wen Q, et al. Serum procalcitonin predictingmortality in exertional heatstroke[J]. Emerg Med J, 2012, 29(2):113-117. |
| [8] | 王赤, 任天成, 戚晓庄, 等. 血清降钙素原变化在严重创伤致 MODS 早期诊断中的临床意义 [J]. 山东医药, 2010, 50(5):57-58. |
| [9] | 赵祥文. 儿科急诊医学 [M]. 第 3 版. 北京 : 人民卫生出版社,2010: 815-817. |
| [10] | Goldstein B, Giroir B, Randolph A, et al. International pediatricsepsis consensus conference: definitions for sepsis and organdysfunction in pediatrics[J]. Pediatr Crit Care Med, 2005, 6(1):2-8. |
| [11] | 黄建宝, 卢秀兰, 祝益民, 等. 降钙素原在全身炎症反应综合征诊断及预后判断中的作用 [J]. 中国小儿急救医学, 2008,15(2): 148-149. |
| [12] | 蔡小芳, 孙继民, 李文斌. 高氧液对捂热综合征患儿多脏器缺血 - 再灌注损伤的保护作用 [J]. 实用儿科临床杂志, 2009,24(18): 1406-1408. |
| [13] | 李莺, 徐仑. 婴儿捂热综合征死亡的危险因素 [J]. 实用儿科临床杂志, 2007, 22(24): 1880-1881. |
| [14] | 齐英征. 降钙素原与小儿危重病例评分对脓毒症患儿预后的影响 [J]. 中国当代儿科杂志, 2014, 16(2): 190-193. |
| [15] | Reinhart K, Meisner M. Biomarkers in the critically ill patient:procalcitonin[J]. Crit Care Clin, 2011, 27(2): 253-263. |
| [16] | 任晓旭, 宋国维. 第 3 代小儿死亡危险评分和小儿危重病例评分的应用 [J]. 实用儿科临床杂志, 2006, 21(6): 382-384. |
| [17] | Barati M, Alinejad F, Bahar MA, et al. Comparison of WBC,ESR, CRP and PCT serum levels in septic and non-septic burncases[J]. Burns, 2008, 34(6): 770-774. |
 2015, Vol. 17
2015, Vol. 17