2. 苏州大学附属儿童医院检验科, 江苏 苏州 215003
肺炎支原体肺炎(Mycoplasma pneumoniaepneumonia,MPP)是最为常见的儿童社区获得性肺炎。肺炎支原体(Mycoplasma pneumoniae,MP)是儿童呼吸道感染最常见的病原之一[1]。近年来,MP 在儿童呼吸道感染中有逐年上升趋势,每3~5 年可发生一次大流行[2]。MP 培养是诊断MP 感染的金标准,但由于MP 培养要求高且耗时,因此临床上多采用血清特异性抗体检测或PCR 检测MP感染[3]。MP-IgM 阳性是诊断MP 感染的主要实验室指标,但MP-IgM 一般在发病1 周后才能检出,且在免疫系统缺陷或发育不完善的患儿中假阴性率高;荧光定量PCR 检测方法具有灵敏度高,特异性强和检测时间短等优点,对MPP 的早期诊断起到了很大的作用,与普通PCR 相比,减少了扩增产物污染的机会,提高了检测特异性[4]。目前临床普遍采用鼻咽抽吸物(nasopharyngeal aspirates,NPA)行MP-DNA 检测,其结果目前尚存在争议。近年来随着支气管镜术在儿科的逐渐开展,经支气管镜行支气管肺泡灌洗,从支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)中获得病原微生物检测结果,被认为具有直接、可靠、敏感的优点,对指导MPP 患儿的诊疗价值备受关注[5]。
目前对NPA 与BALF 的MP-DNA PCR 检测在MPP 中的诊断价值的研究资料尚少。本研究对2013 年4 月至2014 年3 月间在我院呼吸科住院治疗的164 例肺炎患儿,在采集NPA 的同时因诊治需要采集BALF,并将NPA 和BALF 行MPDNAPCR 检测,并将检测结果与血清学比较,求证NPA 和BALF 的MP-DNA 检测对MPP 诊疗的临床意义。 1 资料与方法 1.1 研究对象
选取2013 年4 月至2014 年3 月期间于我院呼吸科就诊的164 例MPP 患儿为研究对象,其中男98 例(59.8%),女66 例(40.2%); 年龄2 个月至14 岁,平均年龄4.6±2.0 岁,其中<1 岁24 例(14.6%),1 岁~ 34 例(20.7%),3 岁~63 例(38.4%),≥ 7 岁43 例(26.2%);支气管肺炎60 例(36.6%),大叶性肺炎104 例(63.4%)。164 例患儿中,发病至入院采集标本病程≤ 1 周有55 例,~2 周有51 例,~4 周有26 例,病程>4 周有32 例。
研究对象纳入标准:(1)年龄在1 个月至14 岁;(2)因呼吸道感染入院,临床疾病诊断标准依据《诸福棠实用儿科学》第7 版[6];(3)入院24 h 内及出院前因诊治需要行血清MP-IgM 检测;(4)经门诊治疗或住院治疗5~7 d,临床症状、体征或/ 和影像学检查无明显改善或反复咳喘时间较长而行电子支气管镜检查及肺泡灌洗术治疗的患儿;(5)住院期间同一天采集NPA 和 BALF。
本研究获得医院医学伦理委员会批准;每位患儿采集NPA 及BALF 标本时均告知家属,并签署知情同意书。 1.2 标本采集
入院24 h 内用一次性吸痰管送入患儿鼻腔7~8 cm,利用负压吸取NPA 1~2 mL;BALF 收集方法为在电子支气管镜到达病变局部时进行灌洗,灌洗部位都选择病变重的肺段,0.9% 氯化钠溶液(体重≤ 20 kg 者每次灌洗量1 mL/kg,体重>20 kg 者每次灌洗量2 mL/kg)进行支气管肺泡灌洗,以负压10~15 mm Hg 进行抽吸以获取BALF。入院24 h 内及治疗7~10 d 病情好转时采集所有患儿静脉血。 1.3 实时荧光定量PCR 法检测NPA及BALF中MP-DNA
取NPA 及BALF 标本,经震荡、离心、去上清,再加入裂解液提取DNA,进行PCR 扩增,引物及探针来自广州中山大学达安基因股份有限公司。探针结合序列位于上游引物与下游引物之间。在特异性杂交荧光探针的5'端结合荧光发光基团,在3' 端结合荧光吸收基团。将样品(标本和质控品)上清液2 μL 或阳性定量参考品直接加入反应管中,12 000 r/min 离心5 min,放人仪器样品槽。PCR 反应条件:93℃预变性2 min;93℃变性45 s,55℃退火60 s,10 个循环;93 ℃ 变性30 s,55 ℃ 退火45 s,30 个循环。荧光采集点设置为55℃退火45 s 阶段。荧光定量PCR 的结果以Ct 值显示,反应结束电脑自动分析结果。结果判定:(1)Ct 值≥ 39,实验结果为阴性;(2)Ct 值<38,实验结果为阳性;(3)Ct 值在38~<39 时,进行重复测定。仪器为美国BIO-RAD 公司的Icycleriq 荧光定量PCR 仪。 1.4 ELISA 法检测血清MP-IgM
试剂盒购自德国欧蒙医学实验诊断股份有限公司。取患儿外周血1~2 mL,常规离心,取血清10 μL,用样本缓冲液1 : 101 稀释,充分混匀后加入抗原包被的微孔板上的微量孔中,同样把标准血清和对照血清各100 μL 加入微量孔中,室温(18~25℃)下温育30 min;清洗缓冲液洗涤3 遍后加入100 μL 过氧化物酶标记的羊抗人IgM 抗体,室温温育30 min;倒掉微孔板内液体,洗涤3 遍后,滴加100 μL 色原/ 底物液至每一微孔,避光温育15 min。以与加色原/ 底物液相同的速度和顺序滴加100 μL 终止液至每一微孔。终止后酶标仪450 nm 波长处测吸光度D 值。计算样本和标准品D 值的比值,通过比值半定量判断MP-IgM 结果。比值>1.1 为阳性,0.8~1.1 为可疑,<0.8 为阴性。对出院时复查的血清MP-IgM 较入院时第一次检测的血清MP-IgM 值增高1.5 倍或以上诊断为MP 急性感染[7]。 1.5 统计学分析
采用SPSS 18.0 统计软件包对数据进行统计学分析,计量资料以中位数(范围)表示,两组间比较采用Wilcoxon 秩和检验。计数资料采用百分率(%)表示,各组阳性率比较采用卡方检验或Fisher 确切概率法。一致性比较采用四格表X2 检验,以血清MP 抗体检测结果为标准计算Kappa 值。Kappa 值越大说明一致性越好,Kappa 值>0.75 表示两者一致性好;Kappa 值在0.40~0.75 间表示一致性中等;Kappa 值<0.40 表示一致性较差。P<0.05 为差异有统计学意义。 2 结果 2.1 MP 检出情况
164 例患儿中,双份血清MP-IgM 检出阳性104 例(63.4%),NPA 的MP-DNA 检出阳性85例(51.8%),BALF 的MP-DNA 检出阳性117 例(71.3%)。其中,三者均为阳性的78 例(47.6%),三者均为阴性的34 例(20.7%)。
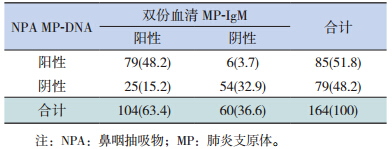
双份血清MP-IgM 和NPA MP-DNA 同时阳性79 例(48.2%),两者检出一致性中等(Kappa=0.618,P<0.001),两者阳性检出率差异有统计学意义(X2=4.507,P=0.044)。见表 1。
| 表 1 双份血清 MP-IgM 及NPA MP-DNA检出结果比较 [n=164,n(%)] |
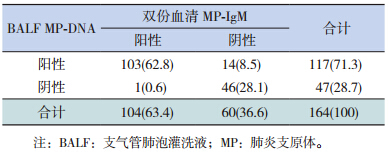
双份血清MP-IgM 和BALF MP-DNA 同时阳性103 例(62.8%),两者检出一致性好(Kappa=0.793,P<0.001),两者阳性检出率差异无统计学意义(X2=2.344,P>0.05)。见表 2。
| 表 2 双份血清 MP-IgM 及 BALF MP-DNA 检出结果比较 [n=164,n(%)] |
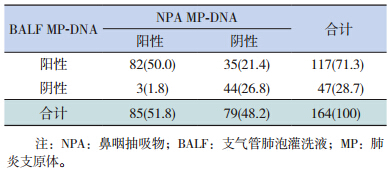
NPA 和BALF MP-DNA 同时阳性82 例(50.0%),两者检出一致性中等(Kappa=0.529,P<0.001),两者检出阳性率差异有统计学意义(X2=54.500,P<0.001)。见表 3。
| 表 3 NPA MP-DNA 及 BALF MP-DNA 检出结果比较[n=164,n(%)] |
164 例肺炎患儿中,NPA 的MP-DNA 中位拷贝数为1.27×105(0~2.50×107),BALF 的MP-DNA中位拷贝数为3.29×106(3.29×103~2.50×107),两者比较差异有统计学意义(Z=3.155,P=0.002)。 2.3 不同病程患儿NPA 和BALF 中MP 检出率比较
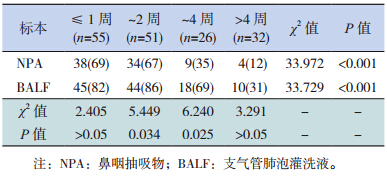
NPA 和BALF MP-DNA 的检出率在不同病程患儿中差异有统计学意义(P<0.05),且均随着病程延长有下降趋势;其中NPA MP-DNA 检出率在病程2 周以上的患儿中较病程在2 周及以下的患儿明显下降(X2=31.100,P<0.001)。
病程≤ 1 周和>4 周患儿中,BALF 中MPDNA的检出率和NPA 中MP-DNA 的检出率比较差异均无统计学意义(均P>0.05);病程在~2 周和~4 周患儿中,BALF 中MP-DNA 的检出率均高于NPA 中MP-DNA 的检出率(均P<0.05)。见表 4。
| 表 4 不同病程患儿 NPA 和 BALF MP-DNA 阳性检出比较[n(%)] |
MP 是一种介于病毒与细菌之间,可以独立存活的微生物,其通过飞沫进行传播,是引起儿童呼吸道感染的重要的病原体之一[3]。MPP 可占儿童肺炎的1.3%~50% 不等[8],尤其以婴幼儿以及学龄期儿童多见[3]。MPP 临床表现多样,且病情轻重不同,具有病程长、易反复等特点,且容易发生肺外并发症,对其进行早期诊断有着重要的临床意义[9, 10]。传统的分离培养以及抗体检测是实验室诊断MPP 的金标准[11],但MP 培养条件要求严格,且阳性率低;而特异性抗体受患儿免疫功能影响,且高峰出现较晚,如果第一份血清采集过早,可能导致假阴性,不利于早期诊断[12]。PCR 诊断技术自1985 年问世以来,已广泛应用于医学及生物学的各个领域。非MP 感染患者咽部极少带有该病原体,为该检测的准确性提供了保证。荧光定量PCR 具有检测快、灵敏度高等优点,更能够对病原体进行准确定量,有助于临床早期诊断,弥补了MP-IgM 高峰出现时间晚等不足,且不受患儿免疫功能影响[1]。
研究结果显示,BALF 中MP 检出阳性率为71.3%,双份血清MP 特异性抗体阳性率为63.4%,均高于NPA 中MP 阳性率51.8%。以双份血清MP 特异性抗体滴度4 倍升高作为金标准,双份血清MP 检出阳性率明显高于NPA 中MP 的检出率,两者的一致性中等。既往有研究报道双份血清MP 特异性抗体阳性率均高于NPA MP-DNAPCR,与此研究结果相一致[2, 3]。因而,若临床上单纯以NPA-MP 检测结果作为参考,可能会引起MPP 的漏诊,从而不利于MPP 的及时治疗。而与双份血清抗体检出率相比,BALF 中MP 检出率与之相比并无明显差异,且两者的一致性较好。但BALF MP-DNA PCR 可早期诊断MP 感染,便于MPP 患儿早期治疗,因而优于双份血清MP 特异性抗体的检测,临床上检测BALF 中MP 非常有必要[13]。而对于MP-DNA PCR,以BALF 为标本与NPA 相比,两者检出一致性中等,但BALF 中检出率明显高于NPA,这与Xu 等[14] 研究结果有所不同,但与研究组既往研究结果相一致,可能原因是存在于上呼吸道中的MP 较下呼吸道中MP 更容易清除,但具体原因有待于研究进一步证实。
本研究中BALF 中的MP 拷贝数较NPA 中更高,可能原因为下呼吸道的局部微环境更适合MP的生存,也支持自身防御系统或抗MP 药物更容易将上呼吸道中MP 清除。既往已有研究证实高拷贝数的MP 是支持MP 感染临床诊断的依据[4, 15],因而BALF 中高拷贝数的MP 更支持MP 感染。
研究显示NPA 中病程在≤ 1 周、~2 周、~4 周、超过4 周MP 的检出率分别为69%、67%、35%、12%,随着病程的推移,MP 检出率逐渐下降。黄淑媛等[12] 研究认为MP-DNA 在发病初期的阳性率较高,随着治疗和病情的转归,阳性率迅速下降转阴,表明MP-DNA 可以直观地反映MP 在体内感染和复制的情况,与此研究结果一致。Kashyap 等[16] 研究也认为MP-DNA 动态变化,可以为临床动态观察治疗效果提供依据。在病程≤ 1 周患儿的BALF 中MP 检出率与NPA 检出率比较差异无统计学意义,而病程~2 周与~4 周的患儿BALF 中MP检出率仍高达86%、69%,BALF 中MP 检出率均明显高于NPA,但当病程超过4 周时,两者检出率差异也并不明显。提示在起病初期(≤ 1 周),患儿机体自身防御系统或抗MP 药物尚未完全对MP 清除,因而BALF 与NPA 中MP 检出的敏感性相同,而随着时间的推移,患儿上呼吸道中MP逐渐被清除,而下呼吸道中MP 依然存在,因而BALF 中MP 的检出率要明显高于NPA,范丽萍等[17] 一项研究结果也证实在病程8~60 d 时BALF 中仍可检出MP 的存在,也进一步支持此次实验研究结果。当病程超过4 周时,患儿上下呼吸道中MP均逐渐被清除,因而BALF 与NPA 中MP 检出率比较并无明显差异。
研究结果显示BALF MP-DNA PCR 检出率与双份血清MP 特异性抗体滴度4 倍升高相比,一致性好,检出率无明显差异,但较双份血清相比,BALF MP-DNA PCR 可早期诊断MP 感染,较双份血清特异性抗体检测具有优势。而NPA MP-DNAPCR 检出率与双份血清特异性抗体相比,一致性中等,且低于双份血清特异性抗体的检出率,易引起漏诊。对于病程较长的患儿,以BALF 为标本行MP-DNA PCR 检测更具有优势。
虽然BALF 较NPA 的MP-DNA PCR 检出率高,但临床上BALF 获取较NPA 困难,故NPA-MP 检测仍然是诊断MPP 的重要循证医学依据;BALFMP-DNA PCR 检出率及拷贝数均明显高于NPA,故对于临床上行支气管镜检查的患儿,收集BALF检测MP 非常有必要,尤其是NPA-MP 及第一份血清MP 特异性抗体检出阴性者,BALF MP-DNA 检测可帮助临床诊治。
| [1] | 朱中梁, 马娟, 汪洪良. 两种方法检测肺炎支原体的对比研究[J]. 临床肺科杂志, 2013, 18(5): 886-888. |
| [2] | 赵茹, 黄莉, 季伟. 双份血清 MP 抗体及痰 MP-PCR 检测在儿童肺炎支原体感染诊断中的价值[J]. 江苏医药, 2008, 34(12): 1282-1283. |
| [3] | 季伟, 陈正荣, 张爱丽, 等. 荧光 PCR 和定量 ELISA 在呼吸道肺炎支原体感染诊断中的应用[J]. 临床儿科杂志, 2009, 27(7): 625-628. |
| [4] | 张晓波, 陆爱珍, 王立波, 等. 肺炎支原体荧光定量聚合酶链反应在肺炎支原体感染中的诊断评价[J]. 中华儿科杂志, 2008, 46(6): 442-445. |
| [5] | 刘玺诚. 努力发展和推广儿科支气管镜术[J]. 临床儿科杂志, 2009, 27(1): 7-11. |
| [6] | 胡亚美, 江载芳, 主编. 诸福棠实用儿科学[M]. 第7版, 北京人民卫生版社, 2002: 1167-1175. |
| [7] | Guo Q, Li HY, Zhou YP, et al. Associations of radiological features in Mycoplasma pneumoniae pneumonia[J]. Arch Med Sci, 2014, 10(4): 725-732. |
| [8] | Liu FC, Chen PY, Huang F, et al. Rapid diagnosis of Mycoplasma pneumoniae infection in children by polymerase chain reaction[J]. J Microbiol Immunol Infect, 2007, 40(6): 507- 512. |
| [9] | 高炳杰, 孙志荣, 张玉芹, 等. 小儿喘息性疾病与肺炎支原体感染关系的研究[J]. 中国当代儿科杂志, 2001, 3(3): 325- 326. |
| [10] | Akihiro T, Kousaku M, Takayuki T, et al. Methylprednisolone pulse therapy for refractory mycoplasma pneumoniae pneumonia in children[J]. J Infect, 2008, 57(3): 223-228. |
| [11] | Waites KB, Balish MF, Atkinson TP. New insights into the pathogenesis and detection of Mycoplasma pneumoniae infection[J]. Future Microbiol, 2008, 3(6): 635-648. |
| [12] | 黄淑媛, 覃川平, 黎伟霞, 等. MP-DNA、MP-IgM 及 MP-IgG在儿童肺炎支原体感染中的动态变化[J]. 中国当代医药, 2014, 21(4): 95-97. |
| [13] | 成云改, 李淑娴, 李雪静, 等. 肺炎支原体肺炎患儿肺泡灌洗液病菌量与临床特征相关性研究[J]. 中华儿科杂志, 2013, 51(10): 736-740. |
| [14] | Xu D, Li SX, Chen ZM, et al. Detection of Mycoplasma pneumoniae in different respiratory specimens[J]. Eur J Pediatr, 2011, 170(7): 851-858. |
| [15] | 张永峰, 王永芹. 荧光定量 PCR 对儿童肺炎支原体感染早期诊断和临床意义[J]. 山东医药, 2011, 51(35): 78-79. |
| [16] | Kashyap B, Kumar S, Sethi GR, et al. Comparison of PCR, culture & serological tests for the diagnosis of Mycoplasma pneumoniae in counity acquired lower respiratory tract infections in children[J]. Indian J Med Res, 2008, 128(2): 134- 139. |
| [17] | 范丽萍, 孙惠泉, 黄莉, 等. 儿童支原体肺炎肺泡灌洗液检测与临床关系探讨[J]. 临床肺科杂志, 2013, 18(10): 1755- 1757. |
 2015, Vol. 17
2015, Vol. 17