脓毒症是儿童急性肺损伤最常见的诱因,也是造成危重症患儿死亡的主要原因之一[1],因此寻找到能准确预测患儿病情并评估其预后的指标,具有重要的临床意义。近年来,研究发现了一种新的T细胞亚群(Th17细胞),其分泌的IL-17在炎症调控网络过程中发挥着重要的作用[2]。Th17细胞在机体外周血及组织中广泛存在,通过上调炎症反应,参与了疾病的发生发展过程[3]。研究证实Th17细胞与哮喘及慢性阻塞性肺疾病的预后具有密切的相关性[4, 5]。同时有研究显示脓毒症患者外周血Th17细胞比例明显升高,证实了Th17细胞参与了脓毒症的发生发展过程[6],但Th17细胞与脓毒症肺损伤的相关性及预后的关系如何,目前尚不完全清楚。本研究拟通过检测脓毒症急性肺损伤患儿肺泡灌洗液中Th17细胞比例及其与小儿危重病例评分(PCIS)的相关分析,以期探讨Th17细胞在预测脓毒症急性肺损伤的病情严重程度及预后评价的临床价值。
1 资料与方法 1.1 研究对象选取2012年8月至2014年8月在我院儿科重症监护病房收治住院的脓毒症肺损伤患儿50例。所有患儿均符合儿童脓毒症诊断标准,同时伴有急性呼吸窘迫综合征的表现。其中男26例、女24例,平均年龄27±25个月。原发疾病主要包括中毒性细菌痢疾11例、颅内感染5例、重症肺炎19例、皮肤感染4例、感染性心内膜炎7例及中毒(煤气/食物)4例。
脓毒症诊断标准:依据《2012国际严重脓毒症和脓毒症休克治疗指南》[7],包括具有以下临床表现两项:体温>38℃或< 36℃;心率>90次/min;呼吸急促,频率>20次/min,或过度通气,PaCO2<32 mm Hg;外周血白细胞计数>12×109/L或< 4×109/L,或未成熟中性粒细胞比例>10%。
急性肺损伤诊断标准:有相应的原发病或诱因和危险因素;急性起病,出现呼吸困难或窘迫;低氧血症,氧合指数(PaO2/FiO2)< 300;胸片显示双肺浸润,肺动脉楔压< 18 mm Hg,无左心房高压表现[8]。排除标准:排除免疫缺陷疾病、自身免疫性疾病、肿瘤、肝炎及近期使用免疫抑制剂治疗的患儿。
支气管肺泡灌洗指征:诊断不明的肺部感染;有发热及肺部罗音;进行性的呼吸困难;胸片显示双肺浸润性炎性改变[9]。
PCIS评分:依据中华医学会儿科学分会制定的PCIS标准对患儿进行评分。>80分为非危重组;71~80分为危重组;< 70分为极危重组。本研究获得了我院伦理委员会的批准及家长书面知情同意。
1.2 临床资料收集记录患儿入院24 h内常规检查指标的检测结果,包括血常规、电解质、肝肾功能、血气分析、X线胸片及痰培养等,以及支气管肺泡灌洗液中Th17细胞检测结果。
1.3 支气管肺泡灌洗液采集患儿行支气管镜检查前均禁食12 h,术前60 min肌注阿托品0.02 mg/kg以减少呼吸道分泌物,术前10 min静脉推注咪达唑仑0.2 mg/kg镇静。行支气管镜检查时,首先进入健侧支气管检查,再进入患侧进行灌洗,灌洗液采用37℃生理盐水,按10 mL/kg流量,每次注入5~10 mL。负压吸取灌洗液,1 000 r/min,离心5 min,取上清,测量细胞浓度。
1.4 流式细胞技术检测肺泡灌洗液Th17细胞比例将上清液移入EP管内,在避光条件下加入CD4抗体20 μL,孵育20 min;再加入抗IL-17抗体20 μL,孵育15 min,加入染色固定液1 mL,震荡混匀后上机检测。
1.5 统计学分析采用SPSS 17.0统计软件进行分析,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两组间比较采用成组t检验;计数资料用率(%)表示,组间比较采用χ2检验,相关分析采用Spearman相关法,P< 0.05为差异有统计学意义。
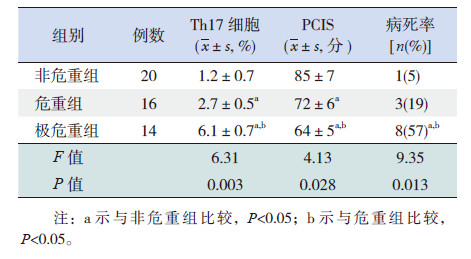
2 结果 2.1 不同危重组间Th17细胞比例水平的比较极危重组、危重组及非危重组间肺泡灌洗液中Th17细胞比例的差异有统计学意义(P< 0.05),其中极危重组Th17细胞比例最高,危重组次之,非危重组最低(P< 0.05),见图 1、表 1。3组间PCIS评分及病死率差异也具有统计学意义,其中极危重组患儿病死率最高,危重组次之,非危重组最低,见表 1。
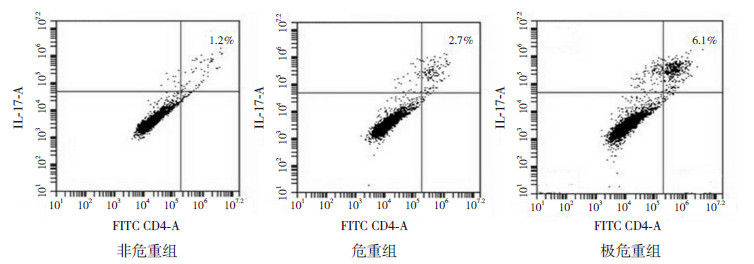 |
图 1 流式细胞仪检测各组间Th17 细胞比例 |
| 表 1 不同危重组患儿Th17 细胞比例、PCIS 评分及病死率比较 |
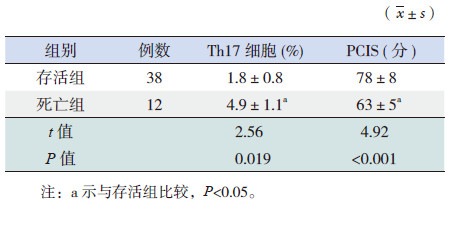
死亡组肺泡灌洗液中Th17细胞比例明显高于存活组;同时,PCIS评分也明显低于存活组,差异有统计学意义(P< 0.05),见表 2。将Th17细胞比例与患儿病死率进行相关分析,结果显示两者呈正相关(r=0.36,P< 0.001)。2.3 Th17细胞比例与PCIS评分的相关性分析脓毒症肺损伤患儿肺泡灌洗液Th17细胞比例与PCIS评分呈显著负相关,Th17细胞比例越高,PCIS评分越低,病情越危重(r=-0.853,P< 0.001),见图 2。
| 表 2 不同预后组患儿Th17 细胞亚群水平及PCIS 比较 |
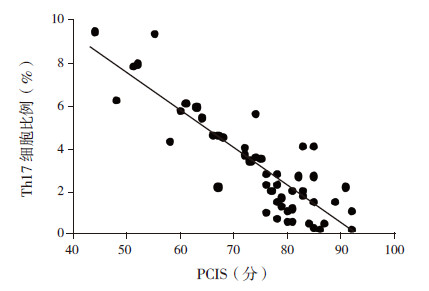 |
图 2 Th17 细胞水平与PCIS 评分的相关性 |
脓毒症是由不同感染因素导致机体发生失控性炎症反应,进一步引起全身多器官功能障碍,其中急性肺损伤是重症监护病房脓毒症患者死亡的主要原因[10]。目前,脓毒症急性肺损伤的早期临床诊断及预后仍缺乏特异性的指标。降钙素原、C反应蛋白及抗凝血酶Ⅲ等作为传统的炎症指标,对于诊断脓毒症急性肺损伤有一定的参考价值,但也并不能很好地反映脓毒症急性肺损伤的严重程度及预后[11]。因此,寻找一种能准确预测脓毒症急性肺损伤病情及预后的指标,具有重要的临床意义。
随着脓毒症急性肺损伤相关研究的不断深入,大量研究证实机体免疫功能在脓毒症急性肺损伤的发生发展过程中起着重要的作用[12]。T淋巴细胞亚群维持着人体正常的细胞免疫功能,其比例的变化参与了炎症性疾病的发生过程。Th17细胞主要由原始T细胞分化,以分泌IL-17为主,参与上调炎症反应[2]。相关研究显示,Th17细胞比例可以反映哮喘、类风湿性关节炎及支气管炎等疾病的严重程度及预后[3, 13]。本研究发现肺泡灌洗液中Th17细胞与病情严重程度有显著相关性,即Th17与PCIS评分呈负相关,提示在脓毒症急性肺损伤患儿中,病情越危重,其肺泡灌洗液中Th17细胞水平越高,相应的预后也越差。同时本研究结果显示,脓毒症急性肺损伤的死亡患儿肺泡灌洗液Th17细胞水平显著高于存活患儿,PCIS评分也明显低于存活患儿,且随着病情严重程度的增加,Th17细胞水平越高,病死率也越高,提示肺泡灌洗液Th17细胞水平可反映脓毒症肺损伤的病情严重程度及预后。
相关研究显示,全身炎症反应综合征患者体内Th17细胞呈现高水平,在机体炎症反应及免疫功能方面具有重要作用[14]。Th17细胞能分泌IL-17,有效动员中性粒细胞,促进炎症反应的进一步放大。进一步研究证实,抑制体内Th17细胞及其分泌的IL-17水平,可以明显降低炎症反应,改善炎症性疾病患者预后[15]。针对脓毒症急性肺损伤患者,通过检测肺泡灌洗液Th17细胞水平,不仅可作为评判病情严重程度及预后的有效指标,还可能为其治疗提供新的靶点。
综上,脓毒症急性肺损伤患儿体内Th17细胞水平随着病情的发展,呈明显升高趋势,能有效地反映病情的严重程度,同时对预后评估也有一定的参考价值。
| [1] | 刑柏, 曾琦, 谭世峰, 等. 呼吸指数对严重脓毒症患者预后 的评估价值[J]. 中国全科医学, 2013, 16(7B):2398-2400. |
| [2] | Ganjalikhani Hakemi M, Ghaedi K, Homayouni V, et al. Positive and negative regulation of Th17 cell differentiation:evaluating the impact of RORC2[J]. Cell J, 2014, 16(3):343-352. |
| [3] | 姚斌, 李敏, 庞英. 草分枝杆菌对哮喘小鼠CD4+CD25+ 调节 性T 细胞和Th17 细胞平衡的影响[J]. 中国当代儿科杂志, 2013, 15(11):1018-1022. |
| [4] | Irvin C, Zafar I, Good J, et al. Increased frequency of dualpositive TH2/TH17 cells in bronchoalveolar lavage fluid characterizes a population of patients with severe asthma[J]. J Allergy Clin Immunol, 2014, 134(5):1175-1186. |
| [5] | 马丽, 霍建民. Th17+ T 细胞吸烟与慢性阻塞性肺疾病的相 关性研究进展[J]. 中华临床医师杂志(电子版), 2013, 7(12):5561-5563. |
| [6] | Brunialti MK, Santos MC, Rigato O, et al. Increased percentages of T helper cells producing IL-17 and monocytes expressing markers of alternative activation in patients with sepsis[J]. PLoS One, 2012, 7(5):e37393. |
| [7] | Dellinger RP, Levy MM, Rhodes A, et al. Surviving sepsis campaign:international guidelines for management of severe sepsis and septic shock:2012[J]. Crit Care Med, 2013, 41(2):580-637. |
| [8] | 马晓春, 王辰, 方强, 等. 急性肺损伤/急性呼吸窘迫综合 征诊断和治疗指南(2006) [J]. 中国危重病急救医学, 2006, 18(12):706-710. |
| [9] | Adamzik M, Broll J, Steinmann J, et al. An increased alveolar CD4+ CD25+ Foxp3+ T-regulatory cell ratio in acute respiratory distress syndrome is associated with increased 30-day mortality[J]. Intensive Care Med, 2013, 39(10):1743-1751. |
| [10] | 齐英征. 降钙素原与小儿危重病例评分对脓毒症患儿预后的 影响[J]. 中国当代儿科杂志, 2014, 16(2):190-193. |
| [11] | 周光耀, 张明, 金玲湘, 等. 前降钙素原和C 反应蛋白对脓 毒症早期诊断及预后评估的临床价值[J]. 中华医院感染学杂 志, 2014, 24(4):1027-1029. |
| [12] | 张育才. 儿科脓毒症的定义及诊断[J]. 中国实用儿科杂志, 2011, 26(12):883-884. |
| [13] | Lubberts E. Role of T lymphocytes in the development of rheumatoid arthritis. implications for treatment[J]. Curr Pharm Des, 2014, 21(2):142-146. |
| [14] | Akinosoglou K, Alexopoulos D. Use of antiplatelet agents in sepsis:a glimpse into the future[J]. Thromb Res, 2014, 133(2):131-138. |
| [15] | Lin CW, Lo S, Hsu C, et al. T-cell autophagy deficiency increases mortality and suppresses immune responses after sepsis[J]. PLoS One, 2014, 9(7):e102066.[1] 刑柏, 曾琦, 谭世峰, 等. 呼吸指数对严重脓毒症患者预后 的评估价值[J]. 中国全科医学, 2013, 16(7B):2398-2400. |
 2015, Vol. 17
2015, Vol. 17