脓毒性休克通常是由感染引起的患者组织或器官灌注不足,进而导致一个或多个器官衰竭后的一种休克状态[1]。脓毒性休克是除心脏病外,重症危重病房患者死亡的主要原因[2]。脓毒症发病的分子机理主要是体内的大量炎性介质,如细胞因子、血管活性因子、生物活性脂质、血纤维蛋白相关产物等过度释放导致的全身性多器官的损伤,其中白细胞介素-6(interleukin-6,IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、内毒素等引起的免疫炎性反应目前研究的较为清楚[3]。血液滤过是利用机械泵使病人血液流经体外回路中的过滤装置,通过滤过压及滤过膜吸附作用将病人体内的血液溶质滤出(即超滤液),同时补充与人体血液成分相似的置换液,从而使血液得到净化的一种技术。血液滤过通过吸附、对流作用和跨膜压能高效地清除患者血液中的大中小分子溶质如IL-6、TNF-α等细胞因子和内毒素等。血液滤过对溶质的清除效率主要取决于超滤量及滤过膜的孔径系数。血液滤过由于其能有效清除体内的炎性介质,近几年开始用于脓毒症治疗[4],但高容量血液滤过(high-volume hemofiltration,HVHF)用于脓毒症患者的治疗一直存在争议[5],本研究通过比较高容量血液滤过和常规容量血液滤过(standard-volume hemofiltration,SVHF)对脓毒性休克患儿的血液动力学、血管活性物质及内皮细胞的通透性的影响,探讨HVHF对小儿脓毒性休克患者早期治疗的脏器保护作用。
1 资料与方法 1.1 研究对象选取2013年1月至2014年9月于本院收治的小儿脓毒性休克患者36例为研究对象,其中男21例,女15例,体重5.5~20.6 kg,年龄范围1个月至6岁,平均年龄3.6±2.3岁。所有病例的纳入标准和排除标准均严格依照参考文献[6, 7],脓毒症患者存在以下临床表现时诊断为脓毒性休克:(1)意识改变,烦躁不安或萎靡,表情淡漠;意识模糊,甚至昏迷、惊厥。(2)皮肤改变,面色苍白发灰,唇周、指趾紫绀,皮肤花纹,四肢凉;如面色潮红,四肢温暖,皮肤干燥为暖休克。(3)外周动脉搏动细弱,心率、脉搏加快。(4)毛细血管再充盈时间>2 s。(5)每小时尿量< 1 mL/kg。(6)乳酸升高;(7)1~12个月年龄段患者收缩压<70 mm Hg,1~10岁患儿<70 mm Hg+2×年龄(岁)。本研究获得本院医学伦理委员会批准及受试对象监护人的知情同意,并签署了临床研究知情同意书。
1.2 方法将36例患者按入院顺序编号后用电脑随机分为对照组和观察组(n=18)。对照组患儿进行SVHF治疗,观察组进行HVHF治疗。依据参考文献[8]处理患者原发病和支持治疗主要脏器,根据患儿病情行颈内静脉或股静脉穿刺置管,100%前置换方式建立血管通路。肝素抗凝,有活动性出血或出血倾向明显者给予无肝素治疗,无出血倾向或出血倾向不明显者给予全身肝素化抗凝,滤器每24 h更换一次,治疗过程中一旦出现凝血立刻更换滤器。置换液配方采用我院自行配制的血液滤过配方,SVHF组置换液流量是每小时35 mL/kg,血流量为50 mL/min;HVHF组置换液流量是每小时100 mL/kg,血流量为50 mL/min。超滤量依据患儿个体治疗量、中心静脉压以及生理需要量决定。所有患者给予SVHF或HVHF连续治疗24 h。HVHF治疗过程中有2例有体温降低(35~36℃)的不良反应,治疗过程中密切关注患者体温变化情况,一旦出现低体温现象,立即予以保暖以使患者恢复至正常体温;SVHF和HVHF治疗过程中一旦发现出血等症状,下调肝素钠使激活凝血时间维持在160~180 s,改善出血情况;低血压时予以去甲肾上腺素处理维持血压。
1.3 观察指标(1)记录所有患儿的一般资料:包括性别、年龄、体重、血常规生化指标、器官衰竭数目等。(2)分析两组患儿治疗前和连续治疗24 h后的心率、平均动脉压以及血氧饱和度等血流动力学因素的变化情况。(3) ELISA法检测治疗前和连续治疗24 h后患儿血液中血管活性因子的水平,其中血栓素B2(TXB2)和6-酮-前列腺素F1α(6-keto-PGF1α)采用美国Cayman公司的ELISA试剂盒,可溶性E-选择素(sE-selectin)和血管内皮舒张因子(EDRF)采用美国R&D公司的ELISA试剂盒检测,检测步骤依据试剂盒说明书进行。(4)检测连续治疗24 h后的超滤液对血管内皮细胞通透性的影响:在0.4 μm的transwell小室中接种血管内皮细胞,transwell小室放置于含有超滤液的24孔板中。待细胞长满后在小室中加入异硫氰酸荧光素(fluorescein isothiocyanate,FITC)标记的葡聚糖,6 h后通过酶标仪检测小室下面培养孔里的荧光强度,通过电阻仪测量跨细胞电阻(transepithelium electrical resistant,TEER)的变化。
1.4 统计学分析采用SPSS 19.0统计软件对数据进行分析。计量资料采用均数±标准差( x±s)表示,两组比较采用t检验;计数资料采用百分率(%)表示,两组比较采用χ2检验。P<0.05为差异有统计学意义。
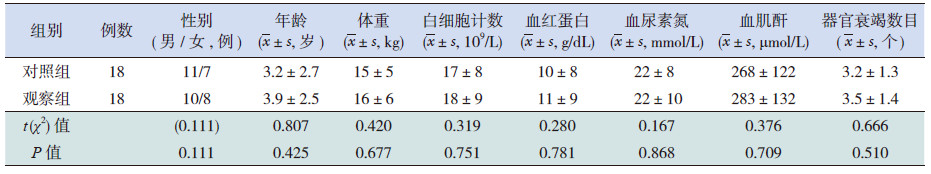
2 结果 2.1 治疗前两组患儿的一般情况分析治疗前,两组在性别、年龄、体重、白细胞计数、血红蛋白、血尿素氮、血肌酐以及衰竭脏器数量上比较差异均无统计学意义(P>0.05),这表明两组患儿之间具有可比性。见表 1。
| 表 1 两组患儿治疗前的一般资料比较 |
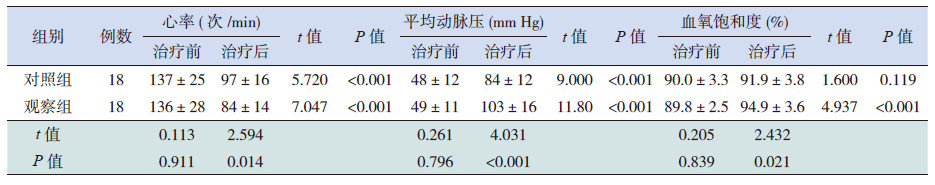
治疗后两组患儿的心率、平均动脉压和观察组的血氧饱和度均较治疗前好转(P<0.05)。治疗前,两组患儿的心率、平均动脉压和血氧饱和度比较差异均无统计学意义(P>0.05);治疗后,观察组的心率显著低于对照组,平均动脉压和血氧饱和度显著高于对照组(P<0.05)。见表 2。
| 表 2 两组患者治疗前后血流动力学的比较 |
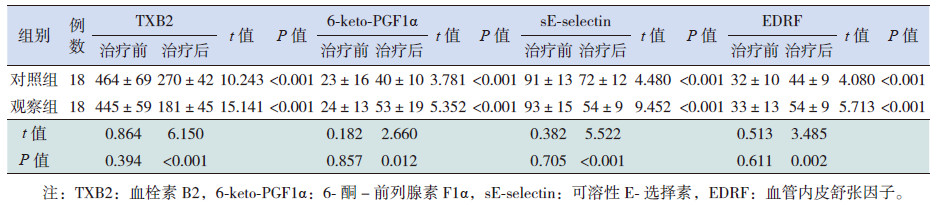
两组患儿治疗后的TXB2、6-keto-PGF1α、sEselectin及EDRF水平均较治疗前好转(P<0.05)。治疗前,两组患儿的TXB2、6-keto-PGF1α、sEselectin及EDRF水平比较差异均无统计学意义(P>0.05);治疗后,观察组患儿血浆中TXB2和sE-selectin水平均比对照组显著降低,6-keto-PGF1α和EDRF水平比对照组显著上升(P<0.05)。见表 3。
| 表 3 两组患者治疗前后血管活性因子的比较 |
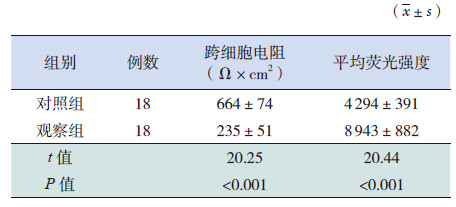
治疗后,用观察组的超滤液处理内皮细胞,其跨细胞电阻显著低于对照组,且transwell小室培养液中的FITC-dextan荧光强度明显强于对照组(P<0.05),见表 4。
| 表 4 两组患者治疗后超滤液对血管内皮细胞通透性的影响 |
脓毒性休克是严重脓毒症的一种特殊类型,表现为一种持续的低灌注状态,即微循环功能障碍,进一步会导致组织灌注不足及器官衰竭和坏死的发生[9]。微循环功能障碍主要与血管内皮的损伤及异常活化相关,血管内皮损伤时毛细血管的通透性增加,内皮细胞的屏障功能丧失,导致毛细血管内的液体分布到毛细血管外间隙,造成有效的循环血量下降,其中大量的炎症介质如TNF-α的释放是内皮屏障功能丧失的一个重要原因。此外,内皮细胞损伤时血管舒张因子,例如内皮素与舒血管因子的平衡失调是血管张力改变及微循环障碍的另一个重要因素[10]。本实验中检测了HVHF和SVHF对小儿脓毒性休克患者血液中的血管活性因子的清除情况,以及治疗后患者的超滤液对血管内皮细胞通透性的影响,从血管内皮功能的角度来分析这两种治疗方法可能对脓毒性休克患儿脏器的保护作用。
内皮细胞分泌血管舒张因子、前列环素(PGI2)、一氧化氮(NO)、内皮素等调节动脉系统的张力和血压[11];此外,血小板分泌血栓素A2(TXA2)促进血小板的聚集及生理性止血。正常生理条件下PGI2/TXA2处于一种平衡状态,控制着体内血管张力的维持[12]。但是,由于PGI2和TXA2在体内很不稳定,因此本研究中通过检测其代谢产物TXB2和6-keto-PGF1α的量来衡量血液中TXA2和PGI2的水平。有研究表明TXA2和PGI2的水平与脓毒症患者的器官功能障碍密切相关,当组织缺血缺氧时,血小板合成的TXA2增多,TXA2合成过程中产生的氧自由基也相应增加,导致组织损害的加剧,而组织损害则通过正反馈途径诱导TXA2的大量合成,引起血管的收缩及局部组织的灌注量减少,导致器官的衰竭及坏死的发生。组织缺血坏死还会使内皮细胞的功能受损,合成PGI2的能力下降,致使PGI2/TXA2的严重失衡,导致血管舒张不足,加剧血栓形成[13]。本研究表明HVHF治疗能显著降低脓毒性休克患者血液中TXB2,同时升高6-keto-PGF1α,这意味着HVHF治疗能调整体内的PGI2/TXA2至抑制血小板聚集和血栓形成的水平,维持血管的张力,从而增加脏器的血液灌注量并改善脏器功能。
内皮细胞合成分泌的EDRF和PGI2在体内相辅相成,共同调节血小板的活化及血管的舒张。EDRF通过可溶性鸟苷酸环化醇(cGMP)信号通路参与血管的自身调节机制,EDRF使细胞内的cGMP水平升高,从而抑制蛋白激酶C的磷酸化,导致细胞内的钙离子浓度下降,继而引起血管的舒张[14]。EDRF控制着体内各处血管壁的静息张力,增加冠脉血流量、肾血液量等局部的血流量,降低全身血管的平均动脉压。sE-selectin是内皮细胞活化的一个标志,在脓毒败血症患者中sE-selectin的水平显著升高,并且sE-selectin水平持续升高与疾病严重程度及预后关系密切[15]。本研究结果显示HVHF治疗24 h后,患者血液中EDRF升高,sE-selectin下降,这意味着HVHF能降低内皮损伤,恢复脓毒性休克患者体内的内皮细胞功能,增加血液灌注量,改善脏器功能。同时,内皮细胞通透性实验也表明:HVHF治疗后的超滤液显著增加了内皮细胞的通透性,降低了内皮的屏障功能;反过来说,HVHF治疗能有效滤除血液中的影响内皮通透性的炎性因子,保护内皮的完整性,从而保护内皮的屏障功能。而且HVHF治疗能显著改善小儿脓毒性休克患者的血流动力学,这些结果表明:相较于SVHF,HVHF治疗能显著改善小儿脓毒性休克患者血液中的血管活性因子和内皮细胞的功能,改善血流动力学,这对于脓毒性休克患儿的脏器保护有着重要的意义。
| [1] | Ramírez M. Multiple organ dysfunction syndrome[J]. Curr Probl Pediatr Adolesc Health Care, 2013, 43(10):273-277. |
| [2] | Stegmayr B, Abdel-Rahman EM, Balogun RA. Septic shock with multiorgan failure:from conventional apheresis to adsorption therapies[J]. Semin Dial, 2012, 25(2):171-175. |
| [3] | 吴鸿雁, 张诺芳, 王雪芹. 脓毒症患儿采用连续血液净化 技术治疗对患儿外周血细胞因子的影响[J]. 中国医学工程, 2014, 22(1):124-125. |
| [4] | 袁远宏, 肖政辉, 张慧, 等. 连续血液净化对严重脓毒症患 儿T 细胞亚群的影响[J]. 中国当代儿科杂志, 2014, 16(2):194-197. |
| [5] | Joannes-Boyau O, Honoré PM, Perez P, et al. High-volume versus standard-volume haemofiltration for septic shock patients with acute kidney injury (IVOIRE study):a multicentre randomized controlled trial[J]. Intensive Care Med, 2013, 39(9):1535-1546. |
| [6] | Dellinger RP, Levy MM, Rhodes A, et al. Surviving sepsis campaign:international guidelines for management of severe sepsis and septic shock:2012[J]. Critical Care Med, 2013, 41(2):580-637. |
| [7] | Guidelines for developing admission and discharge policies for the pediatric intensive care unit. Pediatric Section Task Force on Admission and Discharge Criteria, Society of Critical Care Medicine in conjunction with the American College of Critical Care Medicine and the Committee on Hospital Care of the American Academy of Pediatrics[J]. Crit Care Med, 1999, 27(4):843-845. |
| [8] | Dellinger RP, Levy MM, Carlet JM, et al. Surviving Sepsis Campaign:International guidelines for management of severe sepsis and septic shock:2008[J]. Critical Care Med, 2008, 36(1):296-327. |
| [9] | 隆彩霞, 朱之尧, 胥志跃, 等. 儿童脓毒症发生毛细血管渗 漏综合征的临床危险因素分析[J]. 中国当代儿科杂志, 2013, 15(3):219-222. |
| [10] | 陈朝红, 刘志红, 余晨. 连续性血液净化治疗对全身炎症反 应综合征及脓毒症患者内皮细胞功能的影响[J]. 肾脏病与透 析肾移植杂志, 2003, 12(5):401-406. |
| [11] | Coletta C, Módis K, Oláh G, et al. Endothelial dysfunction is a potential contributor to multiple organ failure and mortality in aged mice subjected to septic shock:preclinical studies in a murine model of cecal ligation and puncture[J]. Crit Care, 2014, 18(5):511. |
| [12] | 杨丰, 方国恩, 毕建威, 等. 高容量血液滤过防治多器官功 能障碍中血管内皮细胞功能的变化[J]. 第二军医大学学报, 2009, 30(6):731-733. |
| [13] | Jesmok G, Gundel R. Thromboxane-blocked swine as an experimental model of severe intravascular inflammation and septic shock[J]. Shock, 1995, 4(5):379-383. |
| [14] | Lübbe AS, Garrison RN, Cryer HM, et al. EDRF as a possible mediator of sepsis-induced arteriolar dilation in skeletal muscle[J]. Am J Physiol, 1992, 262(3 Pt 2):H880-H887. |
| [15] | 陈颖, 陈雯, 许国根, 等. 全身炎症反应综合征患者血浆E-选择素变化及意义[J]. 中国急救医学, 2005, 25(2):89-91. |
 2015, Vol. 17
2015, Vol. 17