咖啡因属于甲基黄嘌呤类药物,临床上广泛用于治疗早产儿呼吸暂停已达40余年[1]。临床试验研究显示,咖啡因不仅可以治疗早产儿呼吸暂停,提高撤机成功率,而且可以降低支气管肺发育不良的发生率。还有研究表明,咖啡因在早产儿纠正胎龄18~21个月时,可减少神经系统后遗症的发生率,减轻认知障碍[2]。与安慰剂组对比,咖啡因治疗组患儿脑白质发育更为成熟[3]。远期随访至5岁时,Doyle等[4]发现咖啡因干预治疗后,患儿动作协调障碍发生率明显降低。动物实验研究发现咖啡因可减轻新生大鼠缺氧缺血后神经细胞的凋亡[5]、突触递质转移的抑制[6]、改善大鼠神经解剖学损伤及远期行为学缺陷[7],由此可见,咖啡因早期应用在未成熟脑组织缺氧缺血性损伤中有一定的保护作用[8]。目前国内治疗早产儿呼吸暂停多选用枸橼酸咖啡因,20 mg枸橼酸咖啡因相当于10 mg咖啡因,进入体内后枸橼酸迅速代谢,因此在治疗中起作用的为咖啡因。咖啡因作为非选择性腺苷受体拮抗剂,可透过血脑屏障作用于脑组织,通过拮抗腺苷受体发挥药理作用。围生期缺氧缺血是导致新生儿死亡和儿童致残的重要原因,给家庭和社会带来沉重的负担。新生儿缺氧缺血性脑病常伴有脑白质损伤(white matter damage,WMD),导致反应性星形细胞胶质化、髓鞘损害和轴突病变等病理学改变,而这些病变是脑瘫发生的最重要的危险因素,表现为发育障碍、认知及行为异常等神经系统后遗症[9]。枸橼酸咖啡因对缺氧缺血后脑白质损伤的影响文献报道较少,这种影响是否与腺苷受体有关,目前国内仍无相关报道。本文将通过研究枸橼酸咖啡因对缺氧缺血性脑损伤(HIBD)新生大鼠脑白质髓鞘碱性蛋白(myelin basic protein,MBP)的影响,并探讨可能的相关机制,即在转录水平上测定脑组织内腺苷A1受体(adenosine 1 receptors,A1R)及A2a受体(adenosine 2a receptors,A2aR)的表达,进一步阐明枸橼酸咖啡因对未成熟脑组织缺氧缺血性损伤的影响,为枸橼酸咖啡因的临床应用进一步提供理论依据。
1 材料与方法 1.1 实验动物分组及模型制备48只清洁级7日龄(P7) Sprague-Dawley (SD)新生大鼠[许可证号:SCXK (豫)2010-0002]由河南省实验动物中心提供,雌雄不限,体重12~18 g。在光照-黑暗各交替12 h条件下,由母鼠自由喂养,采用随机数字表法随机分成假手术组、HIBD组和枸橼酸咖啡因干预组(简称干预组),每组16只。参照Rice等[10]的方法制作新生大鼠HIBD模型,新生大鼠无水乙醚吸入麻醉后,结扎左侧颈总动脉,术后放回母鼠身边恢复1 h,再置于37℃恒温的密闭容器中,通入80 mL/L氧气和920 mL/L氮气的混合气体行缺氧处理2 h;假手术组仅分离左侧颈总动脉,不结扎,亦不做缺氧处理;干预组于缺氧缺血前、缺氧缺血后0、24、48、72 h分别给予枸橼酸咖啡因(20 mg/kg)腹腔注射,HIBD组于相同时间分别给予等量的生理盐水行替代腹腔注射。
1.2 主要试剂及设备兔抗大鼠MBP多克隆抗体、两步法免疫组化试剂盒(SV002)均购于北京博奥森生物技术有限公司,DAB显色剂购自北京中杉金桥生物技术有限公司,Ultrapure RNA Kit购于北京康为世纪生物科技有限公司、THUNDERBIRD SYBRR qPCR Mix、ReverTra Ace qPCR RT Master Mix with gDNA Renmover购自东洋纺绩株式会社,引物由金斯瑞生物科技有限公司合成,枸橼酸咖啡因(规格:20 mg/mL)由意大利凯西公司提供。
1.3 标本制作至12日龄时,每组随机选取8只大鼠,进行乙醚麻醉,将麻醉好的新生大鼠,取仰卧位,充分暴露心脏。将连有头皮针的注射器刺入左心室后,右心耳处剪口;生理盐水灌注出全身血液,再用4%多聚甲醛灌注至躯体变硬苍白,尾巴僵直,快速剥取脑组织,然后多聚甲醛固定、梯度酒精脱水和二甲苯透明,石蜡包埋。以海马部位为标志,冠状位连续切片,切片厚度为5 μm,烤片后备用。
1.4 苏木精-伊红染色石蜡切片脱蜡,梯度酒精水化,苏木精液染色2 min;蒸馏水洗1 min,盐酸酒精分化,蒸馏水洗2~3 s,滴加伊红溶液染色2 min;脱水、透明、封片。
1.5 免疫组织化学法石蜡切片常规二甲苯脱蜡,梯度酒精水化,枸橼酸钠抗原修复液微波加热修复,3%过氧化氢室温避光孵育30 min,山羊血清封闭后,分别滴加一抗(兔抗大鼠MBP,1:100),4℃过夜。滴加相应生物素化二抗37℃孵育30 min,DAB显色,苏木素复染,盐酸酒精分化,自来水冲洗,常规脱水、透明、中性树胶封片,镜检。每个标本随机选取5张切片,100倍光学显微镜下每张切片随机选取5个视野(MBP选皮层下白质),应用Biosens Digital Imaging Systems V1.6分析系统测定每个视野内阳性表达区域平均积分光密度值(IOD值),取其均值作为MBP的表达值(IOD均值与蛋白表达信号呈正比)。
1.6 Real time PCR检测各组另取8只大鼠于12日龄断头处死,取其左侧皮层、海马区和皮层下白质,放在无RNAse的Eppendorf中于-80℃保存备用。用Ultrapure RNA Kit进行总RNA提取,逆转录为cDNA后,以β-actin为内参引物,进行Real time PCR检测,PCR引物序列见表1。PCR反应体系(20 μL):cDNA 1 μL,上、下游引物各0.6 μL,2×SYBR green PCR mix 10 μL,50×ROX referenece dye 0.4 μL,RNase-Free Water补足体积至20 μL。PCR反应条件:95℃预变性1 min;95℃变性15 s,60℃退火1 min,72℃延伸30 s,共40个循环。应用美国ABI Step One TM Software v2.1分析荧光检测结果,计算各组2-△△ CT值得出其相对表达量。
| 表 1 PCR引物序列 |
釆用SPSS 17.0统计学软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,多组间计量资料比较采用单因素方差分析,组间两两比较采用SNK-q检验,P < 0.05为差异有统计学意义。
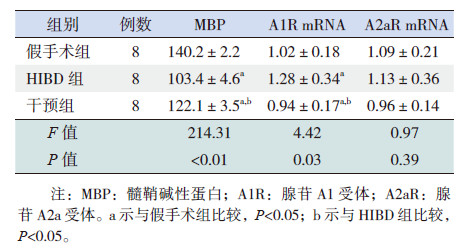
2 结果 2.1 各组新生大鼠左侧脑组织病理改变假手术组大鼠左侧脑组织海马结构完整、细胞层次清晰,排列紧凑;HIBD组大鼠脑组织出现不同程度的病理学改变,表现为细胞边界不清、排列紊乱,细胞周围间隙增宽;干预组较HIBD组细胞层次相对清晰,排列整齐。见图1。
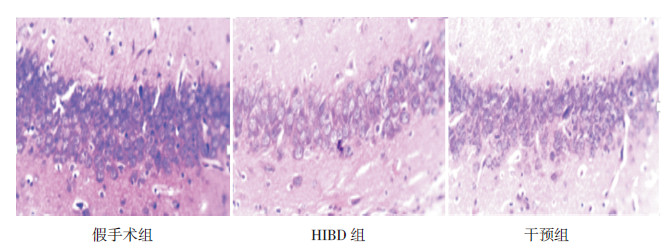 |
图 1 各组新生大鼠左侧脑海马CA1区苏木精- 伊红染色(×400) 假手术组大鼠左侧脑组织海马结构完整、细胞层次清晰;HIBD组细胞边界不清、排列紊乱;干预组较HIBD组细胞层次相对清晰,排列整齐。 |
MBP在皮层下白质呈棕黄色纤维条索状分布(图2)。HIBD组新生大鼠MBP表达较假手术组表达明显减少(P < 0.05);干预组MBP表达水平较HIBD组增多,但仍低于对照组(P < 0.05)。见表2。
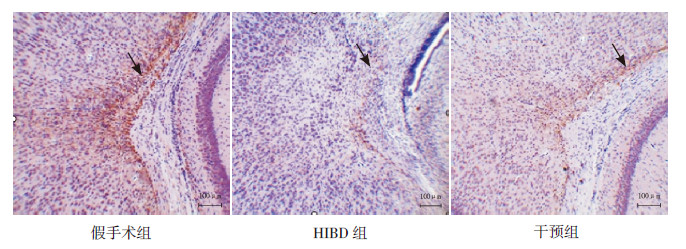 |
图 2 各组新生大鼠左侧脑组织皮层下MBP 表达(×100) 干预组大鼠皮层下MBP较假手术组明显减少,但较HIBD 组明显增多,MBP 为棕黄色纤维条索状分布(黑色箭头所示)。 |
| 表 2 各组新生大鼠脑组织MBP、A1R mRNA 和A2aRmRNA 表达水平比较 |
Real time PCR检测发现HIBD组脑组织A1R mRNA、A2aR mRNA有不同程度的升高,以A1R mRNA升高为主(P < 0.05),A2aR mRNA升高不明显(P>0.05);给予枸橼酸咖啡因干预后,A1R mRNA较HIBD组明显下降(P < 0.05),而A2aR mRNA下降不明显(P>0.05)。见表2。
3 讨论近些年来,随着枸橼酸咖啡因在早产儿呼吸暂停治疗中的广泛使用,其对未成熟脑发育的影响也逐步受到关注。临床研究显示,咖啡因能改善早产儿脑白质结构[3]。Back等[11]利用处于低氧状态的日龄为3~12 d的新生大鼠进行动物实验,发现咖啡因可增加未成熟少突胶质细胞比例,促进白质髓鞘化形成,减轻脑室扩张度,并且发现这一保护作用可能与抑制A1R表达有关。高剂量咖啡因也未表现出对未成熟脑组织白质明显的不利作用[12]。
MBP是髓鞘形成的主要蛋白质,在中枢神经系统的发育过程中起重要作用。缺氧缺血后,新生大鼠脑白质损伤具有选择缺血易损性,可以造成少突胶质成熟障碍和髓鞘发育延迟[13]。本研究发现缺氧缺血后皮层下白质MBP表达量最少,而给予枸橼酸咖啡因治疗后,MBP的表达量明显增加,提示枸橼酸咖啡因对缺氧缺血后髓鞘损伤有一定的保护作用,即咖啡因可以改善围生期脑白质损伤,这与Back等[11]认为咖啡因可减轻低氧造成的新生大鼠髓鞘化脱失及继发性脑室扩张观点假手术组HIBD组干预组图2 各组新生大鼠左侧脑组织皮层下MBP表达(×100) 干预组大鼠皮层下MBP较假手术组明显减少,但较HIBD组明显增多,MBP为棕黄色纤维条索状分布(黑色箭头所示)。一致。本课题组既往实验结果显示咖啡因还可减轻新生大鼠缺氧缺血后神经细胞凋亡,提高远期认知功能[14]。
腺苷受体分为4种:A1R、A2aR、A2bR、A3R,咖啡因的生物学效应是通过作用于脑区神经元和胶质细胞不同的腺苷受体亚型,前两者受体在脑中表达量相对较高[15],也是咖啡因作用的主要靶点,A2bR和A3R在脑内的表达很难检测到[16, 17]。缺氧缺血后脑内腺苷浓度迅速上升,极重度缺氧缺血时可升高达100倍。
咖啡因对脑白质损伤的保护作用,其机制目前不完全明确,目前多数观点认为与A1R的表达有关。A1R早在胚胎期第12天就有表达,至孕晚期表达量虽低于成年期,但仍可检测到A1R[18]。A1R的一个显著特点就是其在白质区域也有分布,事实上,海马区和大脑皮层白质区分布的A1R配体结合力比灰质还要高[19]。腺苷A1R活化在成熟脑组织中表现出保护作用[20],而研究表明给予A1R激动剂模拟体内高浓度腺苷水平,可以降低新生大鼠少突胶质细胞前体的比例,导致新生大鼠髓鞘化减少、继发性脑室扩张,抑制神经元和轴索发育及下调皮层和海马神经元细胞数目[21],诱导未成熟脑组织损伤。腺苷高表达还可以促进细胞凋亡活性的表达,导致自由基和凋亡蛋白酶的升高[22]及诱发电位突触抑制,这显示A1R活化可以抑制轴索生长和脑白质形成,而咖啡因的应用可以改善脑白质损伤。A2aR主要存在于纹状体,毛细血管中也有表达。A2aR活化时导致血管加重缺氧缺血性损伤,这也可以解释为什么咖啡因可以减轻脑室内出血的发生率[23]。除此之外,用于治疗早产儿呼吸暂停剂量的咖啡因血浆浓度还与抗炎机制有关,如下调IL-6和TNF-α的表达,促进IL-10的表达;减轻LPS诱导的脑损伤[24]。
本实验结果显示缺氧缺血后脑组织A1R mRNA显著升高,咖啡因干预后A1R mRNA表达水平下调,而A2aR mRNA虽有升高趋势,干预治疗后有下降趋势,但整体幅度不大。缺氧缺血后脑组织腺苷浓度升高,以A1R升高为主,干预治疗后A1R下调,与MBP的表达刚好相反,从转录水平说明A1R的高表达可能会加重大鼠髓鞘化损伤,A1R表达水平下调可能减轻髓鞘化损伤,而A2aR水平虽整体变化不明显,但也是缺氧缺血后升高,干预治疗后有下降趋势,一定程度上提示咖啡因可以通过阻断腺苷受体水平对脑组织起正向作用。Kumral等[25]将非选择性腺苷受体拮抗剂作用于间断缺氧新生大鼠后,发现A1R水平较缺氧后下降,而A2a水平整体变化不大,这与本研究结果相一致。缺氧缺血后咖啡因干预治疗脑组织腺苷水平较假手术组低,而MBP的表达水平未较假手术组增高,这可能与蛋白表达的转录水平与翻译水平并不总是一致有关。
综上所述,枸橼酸咖啡因能够减轻新生大鼠缺氧缺血后脑白质损伤,这种保护作用可能与下调腺苷A1R表达有关。
| [1] | Kreutzer K, Bassler D. Caffeine for apnea of prematurity:a neonatal success story[J]. Neonatology, 2014, 105(4):332-336. |
| [2] | Schmidt B, Roberts RS, Davis P, et al. Long-term effects of caffeine therapy for apnea of prematurity[J]. N Engl J Med, 2007, 357(19):1893-1902. |
| [3] | Doyle LW, Cheong J, Hunt RW, et al. Caffeine and brain development in very preterm infants[J]. Ann Neurol, 2010, 68(5):734-742. |
| [4] | Doyle LW, Schmidt B, Anderson PJ, et al. Reduction in developmental coordination disorder with neonatal caffeine therapy[J]. Pediatrics, 2014, 165(2):356-359. |
| [5] | Kilicdag H, Daglioglu YK, Erdogan S, et al. Effects of caffeine on neuronal apoptosis in neonatal hypoxicischemic brain injury[J]. J Matern Fetal Neonatal Med, 2014, 27(14):1470-1475. |
| [6] | Gervitz LM, Lutherer LO, Davies DG, et al. Adenine induces initial hypoxic-ischemic depression of synaptic transmission in the rat hippocampus in vivo[J]. Am J Physiol Regul Integr Comp Physiol, 2001, 280(3):R639-R645. |
| [7] | Alexander M, Smith AL, Rosenkrantz TS, et al. Therapeutic effect of caffeine treatment immediately following neonatal hypoxic-ischemic injury on spatial memory in male rats[J]. Brain Sci, 2013, 3(1):177-190. |
| [8] | Favrais G, Tourneux P, Lopez E, et al. Impact of common treatments given in the perinatal period on the developing brain[J]. Neonatology, 2014, 106(3):163-172. |
| [9] | Gieron-Korthals M, Colon J. Hypoxic-ischemic encephalopathy ininfants:new challenges[J]. Fetal Pediatr Pathol, 2005, 24(2):105-120. |
| [10] | Rice JE 3rd, Vannucci RC, Brierley JB. The influence of immaturity on hypoxic-ischemic brain damage in the rat[J]. Ann Neurol, 1981, 9(2):131-141. |
| [11] | Back SA, Craig A, Luo NL, et al. Protective effects of caffeine on chronic hypoxia-induced perinatal white matter injury[J]. Ann Neurol, 2006, 60(6):696-705. |
| [12] | Atik A, Cheong J, Harding R, et al. Impact of daily high-dose caffeine exposure on developing white matter of the immature ovine brain[J]. Pediatr Res, 2014, 76(1):54-63. |
| [13] | Albertsson AM, Bi D, Duan L, et al. The immune response after hypoxia-ischemia in a mouse model of preterm brain injury[J]. J Neuroinflammation, 2014, 11:153. |
| [14] | 徐发林, 王彩红, 张彦华, 等. 枸橼酸咖啡因对新生大鼠缺氧缺血性脑损伤后神经细胞增生和凋亡及远期学习记忆能力的影响[J]. 临床儿科杂志, 2015, 33(4):368-372. |
| [15] | Solinas M, Ferre S, Antoniou K, et al. Involvement of adenosine A1 receptors in the discriminative-stimulus effects of caffeine in rats[J]. Psychopharmacology (Berl), 2005, 179(3):576-586. |
| [16] | Rivkees SA, Thevananther S, Hao H. Are A3 adenosine receptors expressed in the brain?[J]. Neuroreport, 2000, 11(5):1025-1030. |
| [17] | Stehle JH, Rivkees SA, Lee JJ, et al. Molecular cloning and expression of the cDNA for a novel A2-adenosine receptor subtype[J]. Mol Endocrinol, 1992, 6(3):384-393. |
| [18] | Rivkees SA. The ontogeny of cardiac and neural A1 adenosine receptor expression in rats[J]. Brain Res Dev Brain Res, 1995, 89(2):202-213. |
| [19] | Swanson TH, Drazba JA, Rivkees SA. Adenosine A1 receptors are located predominantly on axons in the rat hippocampal formation[J]. J Comp Neurol, 1995, 363(4):517-531. |
| [20] | Fredholm BB. Adenosine and neuroprotection[J]. Int Rev Neurobiol, 1997, 40:259-280. |
| [21] | Turner CP, Yan H, Schwartz M, et al. A1 Adenosine receptor activation induces ventrilomegaly and white matter loss[J]. Neuroreport, 2002, 13(9):1199-1204. |
| [22] | Cunha RA. Neuroprotection by adenosine in the brain:From A(1) receptor activation to A (2A) receptor blockade[J]. Purinergic Signal, 2005, 1(2):111-134. |
| [23] | Rivkees SA, Zhao Z, Porter G, et al. Influences of adenosine on the fetus and newborn[J]. Mol Genet Metab, 2001, 74(1-2):160-171. |
| [24] | Chavez Valdez R, Ahlawat R, Wills-Karp M, et al. Correlation between serum caffeine levels and changes in cytokine profile in a cohort of preterm infants[J]. J Pediatr, 2011, 158(1):57-64. |
| [25] | Kumral A, Yesilirmak DC, Aykan S, et al. Protective effects of methylxanthines on hypoxia-induced apoptotic neurodegeneration and long-term cognitivefunctions in the developing rat brain[J]. Neonatology, 2010, 98(2):128-136. |
 2015, Vol. 17
2015, Vol. 17