白血病是造血系统常见的恶性肿瘤,是严重危害人类健康的恶性疾病之一。目前,化疗是治疗白血病的主要手段。传统的化疗药物在杀伤白血病细胞的同时对人体正常细胞产生较强毒副作用,且易出现多药耐药,容易导致化疗失败。中药治疗白血病毒性低、疗效高,且能与其他化疗药物配伍使用,具有广阔的应用前景[1, 2, 3]。从中药红花中提取的红花注射液的主要成分为红花黄色素,具有活血通经、化瘀止痛、杀菌及解毒的功效[4]。近年来,研究发现红花注射液可抑制宫颈癌、胃癌、肝癌等实体肿瘤细胞的生长[5, 6, 7],其抗肿瘤作用也逐渐引起人们的关注。红花注射液是否具有抗白血病的功效,目前尚不明确。本实验旨在体外观察红花注射液对人白血病细胞株HEL增殖与凋亡的影响,并在分子水平探讨其相关作用机制,为白血病的治疗提供理论依据。
1 材料与方法 1.1 材料与试剂人红白血病细胞株HEL (江苏省血液研究所惠赠),红花注射液(20 mL:1 g,亚宝药业集团股份有限公司);RPMI1640培养基、胎牛血清(美国Hyclone公司);RNAiso Plus总RNA提取试剂盒、PCR反应试剂盒(日本TAKARA公司);逆转录试剂盒(Fermentas公司);MTT细胞增殖及细胞毒性检测试剂盒(碧云天生物技术有限公司);细胞周期检测试剂盒、FITC-PI双染细胞凋亡检测试剂盒(南京凯基生物公司);二甲基亚砜(DMSO,美国Sigma公司);PCR引物(生工生物工程上海有限公司),其余试剂均为国产分析纯。
1.2 细胞培养及分组将人白血病HEL细胞株置于含10%胎牛血清及青霉素(浓度为100 U/mL)、链霉素(浓度为0.1 mg/mL)双抗的RPMI1640培养基中,在37℃、5% CO2培养箱中培养,2~3 d传代一次。HEL细胞随机用或不用红花注射液处理,不用红花注射液处理者为对照组。
1.3 MTT法检测细胞增殖能力取对数生长期HEL细胞,调整细胞密度为1.5×105个/mL,按100 μL/孔接种于96孔板上。红花注射液组分别加入红花注射液100 μL,使其终浓度分别为10、20、30、40、50 mg/mL,对照组加入等量培养基100 μL,设空白对照,置于37℃、5% CO2培养箱中分别培养24、48及72 h后,每孔加入20 μL (5 mg/mL) MTT,继续培养4 h,离心后弃去培养基,加入DMSO 150 μL溶解结晶,酶标仪测定各孔在490 nm处的吸光度值(A490),各组取平均值计算细胞增殖抑制率(inhibitory rate,IR),重复3次(n=5)。IR=(1-实验组A490/对照组A490)×100%。
1.4 细胞周期的检测取对数生长期HEL细胞接种于6孔板上,调整细胞密度为2×105个/孔,培养基终体积2.5 mL。红花注射液组应用浓度分别为10、20、30 mg/mL的红花注射液处理细胞48 h后收集各组细胞,同时设对照组。收集细胞后用0.01 MPBS洗涤细胞1次,弃上清,加入500 μL 70%冷乙醇(-20℃)固定,于4℃过夜;次日,用PBS洗涤细胞1次,加入100 μL RNase A 37℃水浴30 min,再加入400 μL PI染色混匀,4℃避光30 min后流式细胞仪检测各组细胞的凋亡情况,记录激发波长488 nm处红色荧光。实验重复3次(n=5)。
1.5 细胞凋亡的检测采用Annexin V-FITC/PI双染色法FCM检测细胞凋亡。取对数生长期HEL细胞接种于6孔板上,调整细胞密度为2×105个/孔,培养基终体积2.5 mL。红花注射液各组于红花注射液处理细胞48 h后(780 g离心5 min)收集细胞。收集细胞后用0.01 M PBS洗涤2次(780 g离心5 min)后弃上清,依次加入500 μL Binding Buffer悬浮细胞、5 μL Annexin V-FITC、5 μL PI混匀,室温避光反应15 min,1 h内上流式细胞仪检测。实验重复3次(n=5)。
1.6 RT-PCR法检测HOXB3 mRNA的表达取对数生长期HEL细胞接种于6孔板上,调整细胞密度为2×105个/孔,加入红花注射液,终浓度为30 mg/mL。分别于加药0 h、12 h、24 h、48 h后收集细胞,并提取细胞总RNA,测定RNA纯度,吸光度A260/A280在1.8~2.0之间,测定RNA浓度,RT-PCR两步法检测HOXB3 mRNA的表达情况,β-actin为内参,引物序列为:正义链5'-TCAGGGATGGTGAGAGATCC-3',反义链5'-GAATGGGCAAACCTTCAGTC-3',扩增长度为120 bp。β-actin正义链5'-CTCCATCCTGGCCTCGCTGT-3',反义链5'-GCTGTCACCTTCACCGTTCC-3',扩增长度为268 bp。按下列条件进行RT-PCR反应:95℃预变性5 min;95℃变性30 s,55℃退火45 s,72℃延伸30 s,共进行35个循环;最后72℃延伸10 min。PCR产物经1%琼脂糖凝胶电泳鉴定,Tanon-2500凝胶成像系统拍照,并采用Tanon Gel凝胶图像分析软件检测HOXB3基因与β-actin的灰度值,二者比值为目的基因的相对表达量。实验重复3次(n=5)。
1.7 统计学分析采用SPSS 16.0统计软件对数据进行统计学分析,计量资料用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较时采用SNK-q检验,P < 0.05为差异有统计学意义。
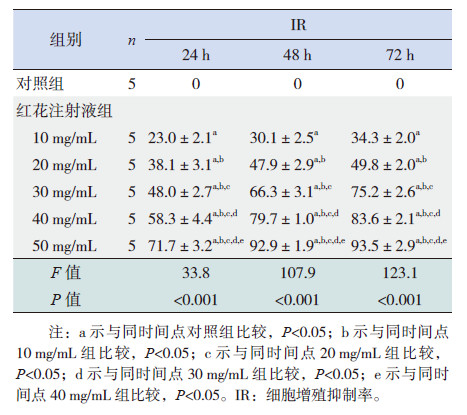
2 结果 2.1 红花注射液对HEL细胞增殖的影响HEL细胞经10、20、30、40、50 mg/mL的红花注射液处理24、48及72 h后,与对照组比较,细胞增殖均不同程度地受抑制,在相同作用时间不同浓度间细胞增殖比较差异有统计学意义(P < 0.05),呈剂量依赖性(表1、图1);在相同浓度不同作用时间比较差异无统计学意义。
| 表 1 不同浓度红花注射液作用不同时间对HEL 细胞增殖的影响 |
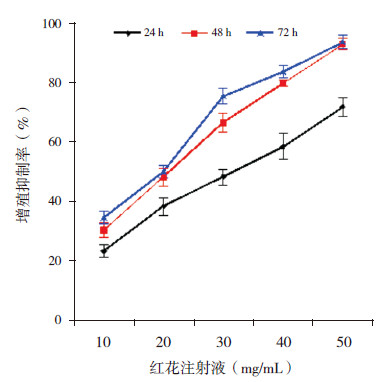 |
图 1 不同浓度红花注射液作用于HEL 细胞的浓度-抑制率曲线(n=5) |
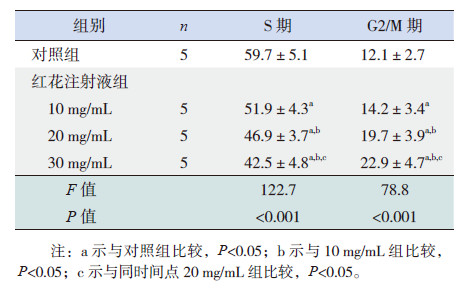
不同浓度红花注射液(10、20、30 mg/L)作用HEL细胞48 h后,细胞的周期分布发生改变,与对照组相比G2/M期细胞数显著增多,S期细胞数显著减少(P < 0.05),且呈剂量依赖性(表2、图2)。
| 表 2 不同浓度红花注射液作用48 h 对HEL 细胞周期的影响 |
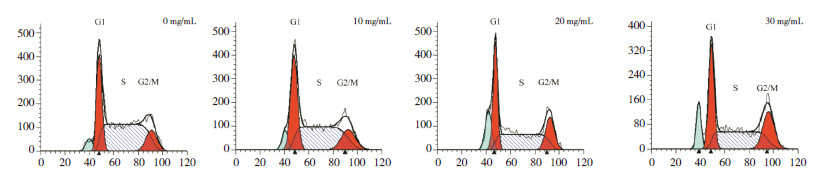 |
图 2 不同浓度红花注射液作用48 h 对HEL 细胞周期的影响 横坐标为DNA 量,纵坐标为单位体积细胞数。可见随着红花注射液浓度的增加,G2/M 期细胞数增多,S 期细胞数减少。 |
对照组和不同浓度红花注射液(10、20、30 mg/L)作用HEL细胞48 h后,Annexin V-FITC/PI染色双法检测细胞凋亡,凋亡率分别为(1.7±0.6)%、(6.9±1.9)%、(12.8±2.1)%、(23.3±3.4)%,不同浓度红花注射液促进HEL细胞凋亡作用随着药物浓度的增加而逐渐增强,差异有统计学意义(F=61.1,P < 0.0001)(图3)。
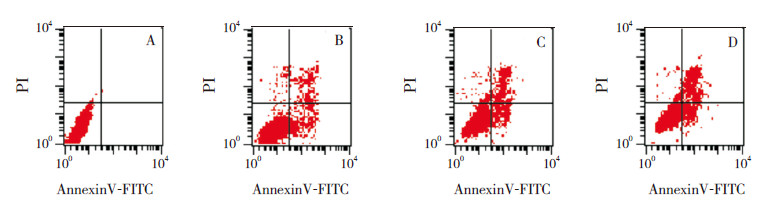 |
图 3 不同浓度红花注射液作用48 h 对HEL 细胞凋亡的影响 A 为对照组,B 为10 mg/mL 组,C 为20 mg/mL组,D 为30 mg/mL 组。 随着红花注射液浓度的增加,HEL 细胞凋亡率增加。右上象限+ 右下象限为凋亡细胞。 |
2.4 红花注射液对HEL细胞HOXB3基因表达的影响RT-PCR法检测HOXB3 mRNA的表达结果显示,对照组和不同浓度的红花注射液(10、20、30 mg/mL)处理HEL细胞48 h后,各组HOXB3 mRNA相对表达量分别为(59.2±5.0)%,(41.8±3.0)%、(23.4±4.1)%、(11.3±3.0)%,各组间比较差异均具有统计学意义(F=131.1,P=0.007)(图4)。
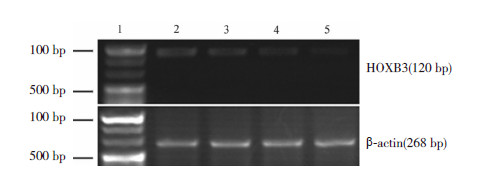 |
图 4 不同浓度红花注射液作用48 h 对HEL 细胞HOXB3 基因表达的影响 1 为DNA marker,2 为对照组,3为10 mg/mL 组,4 为20 mg/mL 组,5 为30 mg/mL 组。随着红花注射液浓度增加,HEL 细胞中HOXB3 mRNA 表达水平逐渐下降。 |
近年来白血病的治疗及预后有了极大改观,但仍有部分患者治疗效果差,且多药耐药(multidrug resistance,MDR)的产生常导致化疗失败和复发。因此,寻找高效低毒的抗癌策略是治疗白血病的必然趋势,针对白血病细胞增殖、凋亡及耐药等复杂过程,寻找新靶标成为白血病基因治疗的热点。红花是菊科植物红花的干燥管状花,是临床常用的具有活血化瘀功效的中药,近年来,研究发现红花注射液对宫颈癌、胃癌、肝癌等实体肿瘤细胞具有抑制作用,其抗肿瘤作用逐渐被重视。但其是否具有抗白血病作用尚不明确。本研究结果显示,HEL细胞经浓度为10、20、30、40、50 mg/mL的红花注射液处理24、48及72 h后,与对照组比较,细胞增殖均不同程度地受抑制,呈现显著的剂量依赖性。不同浓度红花注射液(10、20、30 mg/L)作用HEL细胞48 h后,细胞的周期分布发生改变,与对照组相比G2/M期细胞数明显增多,S期细胞数明显减少,且呈剂量依赖性,提示红花注射液使HEL细胞阻滞于G2/M期,影响细胞有丝分裂,最终抑制细胞生长。Annexin V-FITC/PI双染色法检测HEL细胞凋亡结果显示,随着红花注射液浓度的增加,细胞凋亡率增加,表明红花注射液以浓度依赖的方式诱导细胞凋亡。提示红花注射液能通过抑制HEL细胞增殖、诱导细胞凋亡发挥抗白血病的作用,但红花注射液抗白血病的分子作用机制仍不明确。
白血病是造血系统恶性增殖性疾病,多种基因参与其发生和发展。同源盒(homeobox,HOX)基因在胚胎发育过程中控制细胞的增殖、分化,其表达失调在白血病的发生中具有重要作用。HOX基因目前分为A、B、C、D四簇,HOXA簇基因过表达与白血病发生、发展及预后的关系目前国内外研究较多,HOXB家族共包括10个基因,即B1-9,B13,主要在原始的造血细胞中表达,随着细胞向成熟阶段分化其表达逐渐下调,直至消失,其各亚型在不同造血系中的表达具有差异性,并在造血的不同阶段发挥各自的重要的调控作用。HOXB3参与髓系祖细胞的生成,国外有研究表明,HOXB3在正常骨髓不表达,但在急性髓细胞性白血病(acute myeloid leukemia,AML)患者(尤其是M4、M5型)及HEL、U937髓系白血病细胞株中高表达[8, 9]。Fischbach等[10]通过动物实验研究发现HOXB3过表达能促进细胞增殖、抑制细胞凋亡,诱使小鼠在210 d左右发生AML。Starkova等[11]研究表明HOXB3过度表达能导致白血病的发生,沉默HOXB3基因的表达能够显著抑制白血病细胞的增殖、促进其凋亡,HOXB3是形成白血病的关键基因之一。本实验通过RT-PCR法检测HOXB3 mRNA的表达,结果显示,不同浓度的红花注射液(10、20、30 mg/mL)处理HEL细胞48 h后,随着红花注射液浓度增加,HEL细胞中HOXB3 mRNA表达水平逐渐下降,提示红花注射液可能通过下调HOXB3基因的表达,发挥其抗白血病作用,其治疗作用是否与HOXB3基因有关有待于进一步研究。本次体外实验证实了红花注射液的抗白血病作用,为临床应用红花注射液治疗白血病奠定了实验基础。红花注射液对抗白血病化疗药物有无减毒增效作用及其抗白血病在信号转导通路方面的具体作用机制有待进一步研究。
总之,红花注射液能显著抑制HEL细胞增殖并诱导其凋亡,相关机制可能与下调HOXB3基因的表达有关。
| [1] | 贾秀红,尹宝慧,李建厂.黄芪注射液对U937细胞增殖与凋亡的影响及相关机制的探讨[J].中国当代儿科杂志, 2013, 15(12):1128-1133. |
| [2] | 刘笑梦,曹娇玲,臧玉柱.人参皂苷对人白血病-60细胞凋亡的影响[J].中国当代儿科杂志, 2012, 14(10):792-795. |
| [3] | 陈菲莉,柳约坚,李蓉蔚,等.雷公腾内酯与多柔比星诱导耐药白血病细胞凋亡协同作用及其机制的探讨[J].中华肿瘤防治杂志, 2014, 12(10):728-731. |
| [4] | 刘倩,陈晨,戴忠,等.红花注射液有效成分的确定及不同厂家中量效关系的比较[J].药物分析杂志, 2012, 32(7):1158-1161. |
| [5] | 靳祎,石少慧,王恩军,等.红花注射液对人宫颈癌细胞株 Hela体外增殖的影响[J].军医进修学院学报, 2007, 28(6):448-449. |
| [6] | 奚胜艳,张前,刘朝阳,等.羟基红花黄色素A对裸鼠人胃腺癌BGC-823移植瘤抑制作用的研究[J].北京中医药大学学报, 2009, 32(5):331-335. |
| [7] | 李福娟,石学魁,李玉婷,等.红花注射液对HepG-2细胞 Bcl-2和Survivin表达的影响[J].中国实验方剂学杂志, 2013, 19(21):218-222. |
| [8] | Merenlender-Wagner A, Shemer Z, Touloumi O, et al. New horizons in schizophrenia treatment:autophagy protection is coupled with behavioral improvements in a mouse model of schizophrenia[J]. Autophagy, 2014, 10(2):2324-2332. |
| [9] | Eklund E. The role of Hox proteins in leukemogenesis:insights into key regulatory events in hematopoiesis[J]. Crit Rev Oncog, 2011, 16(1-2):65-76. |
| [10] | Fischbach NA, Rozenfeld S, Shen W. HOXB6 overexpression in murine bone marrow immortalizes a myelomonocytic precursor in vitro and causes hematopoietic stem cell expansion and acute myeloid leukemia in vivo[J]. Blood, 2005, 105(4):1456-1466. |
| [11] | Starkova J, Zamostna B, Mejstrikova E, et al. HOX gene expression in phenotypic and genotypic subgroups and low HOXA gene expression as an adverse prognostic factor in pediatric ALL[J]. Pediatr Blood Cancer, 2010, 55(6):1072-1082. |
 2015, Vol. 17
2015, Vol. 17