全球支气管哮喘(哮喘)的发病率和病死率逐年增加[1]。数据显示[2]目前大约有3亿哮喘患者,其中儿童哮喘发病率在3.3%~29%。最新流调资料显示中国儿童哮喘累计患病率为3.02%[3],十年间平均上升了52.8%,所以对哮喘发病机制的研究仍势在必行。
气道炎症及气道重塑是哮喘主要的病理学特征,Halwani等[4]及Bergeron等[5]研究表明气道重塑是哮喘的核心病理改变,也是哮喘不易控制及反复发作的原因,其严重程度与哮喘的严重程度密切相关。但目前哮喘的治疗药物主要集中在控制哮喘炎症,而不能有效逆转气道重塑的程度,亦无实验室指标可以反映哮喘气道重塑的程度,所以继续研究哮喘发病机制特别是气道重塑发生的机制是有必要的。
哮喘的发病机制尚不清楚,免疫异常是哮喘发病的核心。Valentin等[6]认为T淋巴细胞的活化是免疫反应的关键,是呼吸道发生炎性反应的直接因素。既往人们认为Th1/Th2细胞的平衡理论是哮喘发病的核心[7],但随研究进展发现单纯的Th1/Th2细胞的平衡理论并不能解释哮喘发生的所有现象[8, 9]。近年研究发现CD4+效应细胞存在新型的T细胞亚群-调节性T细胞(Treg)和Th17细胞,两者免疫功能紊乱是哮喘发生的主要免疫学机制之一[10]。本课题组前期实验也已经证明在哮喘小鼠体内存在CD4+CD25+Treg细胞、Th17细胞的表达异常,提示哮喘发病的机制之一可能为CD4+CD25+Treg细胞及Th17细胞功能及数量表达异常[11]。既往研究表明Th17细胞主要依靠分泌的IL-17A在哮喘的发生发展中发挥重要作用,其可以促进哮喘炎症的发生,同时亦可以通过动员、募集及活化中性粒细胞参与气道重塑的发生,国内外研究发现CD4+CD25+Treg细胞可以通过分泌IL-10减轻哮喘气道炎症、气道高反应性及气道重塑的发生。但是CD4+CD25+Treg细胞、Th17细胞含量的高低是否与哮喘气道重塑程度相关,是否可以通过测定CD4+CD25+Treg细胞、Th17细胞含量判断哮喘的严重程度,目前国内外尚无研究,因此本研究使用卵清蛋白(OVA)制备哮喘小鼠气道重塑模型,依据不同的激发时间,从时间尺度反映哮喘小鼠气道重塑是动态变化的过程;同时测定CD4+CD25+Treg细胞及Th17细胞动态变化的过程;从而推测CD4+CD25+Treg细胞、Th17细胞的变化情况及其与气道重塑的关系,为临床研究提供实验室依据。
1 材料与方法 1.1 实验动物4~6周龄SPF级Balb/c雌性小鼠48只,体重14±2 g,由成都达硕生物有限公司提供(质量合格证NO-0016815),饲养于四川省人民医院动物房,SPF级环境,给予喂养不含过敏原的无菌食物,专用动物饮水。
1.2 主要实验仪器及试剂主要实验仪器Apex雾化器(台湾雅博股份有限公司);离心机(科大创新股份有限公司),SW-CJ-2FD超净工作台(苏州净化设备厂);CYTOMICSFC500流式细胞仪(美国BACK MAN COULTER公司);数码三目摄像显微摄像系统(麦克奥迪实业集团有限公司);Image-Pro Plus 6.0图像分析系统(美国MediaCybernetics公司)。主要实验试剂OVA (美国Sigma公司);离子霉素(美国Sigma公司);兔抗鼠CD4单克隆抗体(FITC标记)、兔抗鼠CD25单克隆抗体(PE标记)、兔抗鼠IL-17单克隆抗体(PE标记)均购自美国Biolegend公司。
1.3 动物模型的制备依据王绍斌等[12]和Temelkovski等[13]方案加以调整制备哮喘小鼠气道重塑模型,利用OVA被动致敏并激发制作哮喘气道重塑模型。按随机数字表法将48只小鼠随机分为空白对照组及哮喘模型组,每组24只。模型组在实验的第0、14天每只小鼠给予0.2 mL致敏混悬液(含20 μg OVA和100 μg氢氧化铝)腹腔注射致敏;从实验的第21天起将每组小鼠置于自制的不完全密闭的透明容器内用压力雾化器给予2.5% OVA雾化吸入激发,隔天1次,每次约30 min;空白对照组以等量生理盐水行腹腔注射和雾化吸入。两组分别在激发阶段第2、4、8周最后1次激发后的24 h内随机各处死小鼠8只并留取标本。
1.4 取材小鼠应用颈部脱臼法处死,无菌状态下快速取出脾脏(避免直接接触到脾脏),放于盛有PRMI1640培养液的培养皿中冲洗;用10%多聚甲醛灌洗肺组织,取左肺组织固定于10%多聚甲醛备用,至少固定72 h。
1.5 Th17细胞及CD4+CD25+Treg细胞检测取各组小鼠脾脏,剪成1~2 mm大小的小块置于不锈钢细胞筛上研磨、过滤,加入小鼠淋巴细胞分离液,以密度梯度离心法分离制备脾组织单个核细胞悬液。流式细胞仪检测各组CD4+CD25+Treg细胞以及Th17细胞占CD4+T细胞的百分率。
1.6 肺组织病理切片的制备肺组织固定于10%多聚甲醛至少72 h后,清水清洗肺组织常规由低到高梯度乙醇溶液脱水、氯仿透明、石蜡包埋,最后制备成5 μm厚的肺组织切片。每个标本随机选取3张切片,常规苏木精-伊红(HE)染色观察肺组织形态结构及炎症情况,每张切片先于100倍下观察全部组织病理变化,再根据组织大小及表达情况分别选取3个区域200倍采集图像;图像分析应用Image-pro 6.0图像分析软件,测定支气管基底周径(Pbm)、总管壁面积(Wat)、内壁面积(Wai)、平滑肌面积(Wam),并用Pbm将测量值标准化,若每张切片采集多个图像,则取平均值,进行统计分析。
1.7 统计学分析采用SPSS 19.0统计学软件对数据进行统计学分析,符合正态性分布计量资料用均数±标准差(x±s)表示,两组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验。采用Pearson相关分析对双变量间进行相关性分析。P < 0.05为差异有统计学意义。
2 结果 2.1 哮喘发作时表现小鼠腹腔注射OVA和氢氧化铝混悬液致敏及应用OVA雾化激发后小鼠会出现烦躁或少动、搔鼻子、呼吸急促或呼吸困难、口唇青紫、毛发竖起、腹部肌肉痉挛、点头呼吸、反应迟钝、二便失禁等急性哮喘发作的症状。
2.2 小鼠肺组织病理学改变对照组小鼠气道周围的组织病理学变化不明显,无炎性细胞浸润,无杯状细胞的异常增生及黏液分泌,平滑肌层均匀;2周哮喘模型组可见支气管壁及血管周围有大量炎性细胞浸润,部分细支气管可见上皮细胞的脱落不全,气道平滑肌增生,杯状细胞增生伴黏液高分泌,基底膜增厚;4周哮喘模型组比2周哮喘模型组气道平滑肌细胞增殖更明显,气道壁增厚更为明显,8周哮喘模型组与4周哮喘模型组相比,气道平滑肌明显增厚,管腔狭窄。见图1。
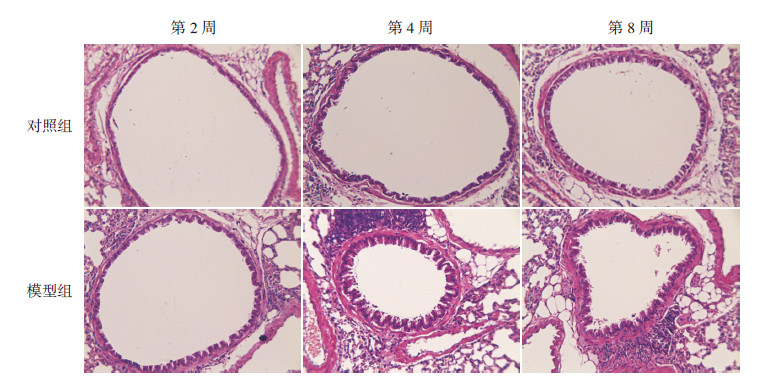 |
图 1 各组肺组织病理切片(苏木精- 伊红染色,×100) 对照组气道未见气道炎症改变;2 周哮喘模型组可见支气管壁及血管周围有大量炎性细胞浸润,部分细支气管可见上皮细胞的脱落不全,气道平滑肌增生,杯状细胞增生伴黏液高分泌, 基底膜增厚;4 周哮喘模型组比2 周哮喘模型组气道平滑肌细胞增殖更明显,气道壁增厚更为明显;8 周哮喘模型组与4 周哮喘模型组相比,气道平滑肌明显增厚,管腔狭窄。 |
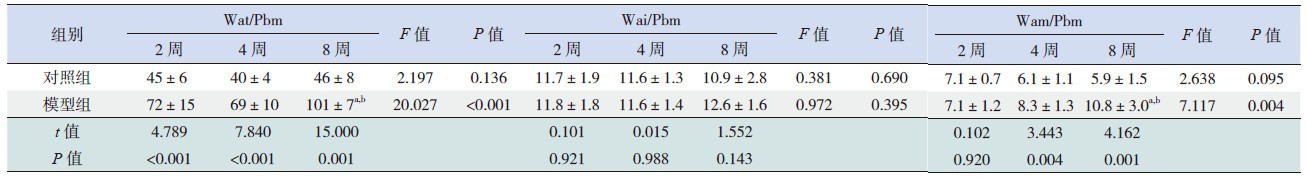
应用Image-pro 6.0图像分析系统分析肺组织HE染色结果显示,激发2周后模型组支气管Wat/Pbm及Wam/Pbm开始逐渐增厚(P < 0.01);8周组增厚最为显著(P < 0.01)。见表1。
| 表 1 小鼠肺组织气道重塑情况 |
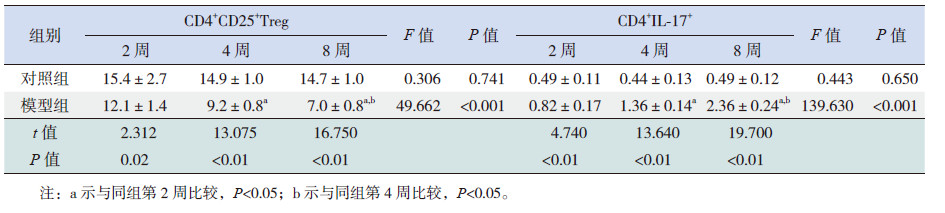
实验结果显示,随着激发时间的延长,哮喘模型组CD4+CD25+Treg细胞占CD4+T细胞的百分比逐渐降低(P < 0.01),即CD4+CD25+Treg细胞数逐渐降低;Th17细胞占CD4+T细胞的百分比逐渐增高(P < 0.01),即Th17细胞数逐渐增高;而对照组改变不明显;各模型组与对照组比较差异均有统计学意义(P < 0.05)。提示哮喘小鼠确实存在CD4+CD25+Treg细胞、Th17细胞的表达异常,且随着激发时间的延长,这种改变逐渐加重。见表2,图2~3。
| 表 2 各组小鼠脾组织中CD4+CD25+Treg 和CD4+IL-17+ 的表达比较 |
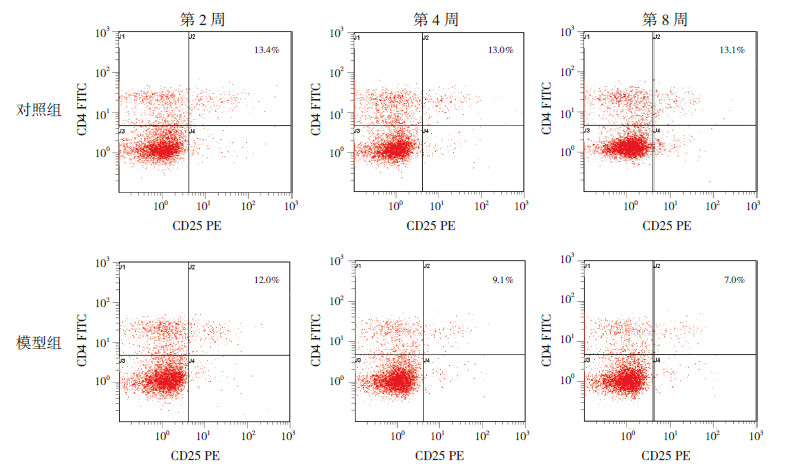 |
图 2 各组小鼠脾脏单核细胞CD4+CD25+Treg 细胞流式细胞仪分析图 随着激发时间的延长,哮喘模型组CD4+CD25+Treg 细胞占CD4+T细胞的百分比逐渐降低;对照组改变不明显。 |
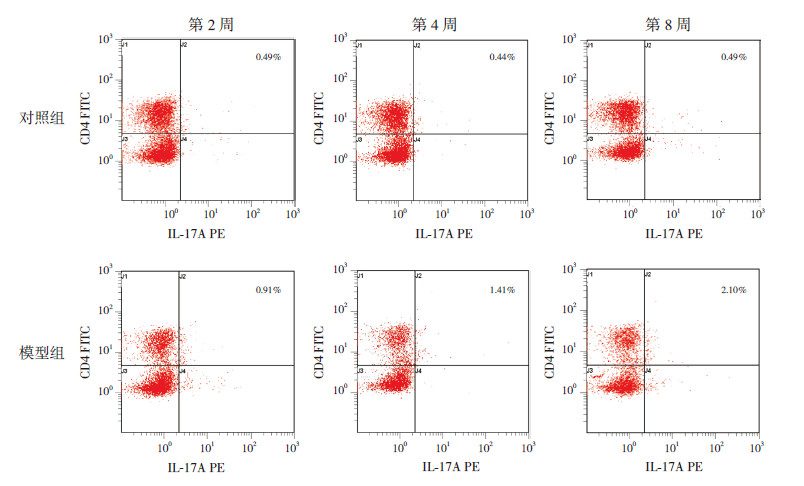 |
图 3 各组小鼠脾脏单核细胞Th17 细胞流式细胞仪分析图 随着激发时间的延长,哮喘模型组Th17 细胞占CD4+T 细胞的百分比逐渐增高;对照组改变不明显。 |
将哮喘组小鼠每组数据进行相关性分析发现:2周、4周、8周哮喘模型组小鼠脾组织悬液中Th17细胞数与气道Wat呈正相关(分别r=0.965、0.931、0.952,P < 0.001);与气道Wam呈正相关(分别r=0.927、0.996、0.895,P < 0.001)。2周、4周、8周哮喘模型组CD4+CD25+Treg细胞与气道Wat呈负相关(分别r=-0.943、-0.790、-0.891,P < 0.001);与气道Wam呈负相关(分别r=-0.984、-0.891、-0.912,P < 0.001)。
3 讨论近年研究发现CD4+效应细胞存在新型的T细胞亚群-包括Th17细胞(Th17)和CD4+CD25+Treg细胞,它们与哮喘的发生发展密切相关[10]。T淋巴细胞主要来源于脾脏及胸腺,脾脏作为全身最大的周围淋巴器官,其结构和功能复杂,占全身淋巴组织总量的25%,含有大量的淋巴细胞和巨嗜细胞,可以通过T细胞介导的细胞免疫和B细胞介导的体液免疫完成机体的特异性免疫功能,而气道局部免疫器官含量极少,本实验为了更便于收集免疫细胞减少实验误差,故选用脾脏组织作为免疫细胞采集的器官。CD4+CD25+Treg细胞是抑炎因子,具有免疫抑制和免疫无能;IL-17细胞是促炎因子,在机体发生免疫应答的过程中存在动态平衡,它们的发现为哮喘免疫学机制的研究提供了新的方向,CD4+CD25+Treg细胞可以通过细胞间直接接触或者分泌IL-10和TGF-β,表达CTLA-4、GITR等表面分子及FOXP3细胞发挥作用,其可以下调机体对自身抗原或非自身抗原的免疫反应,维持免疫耐受性。目前大多研究认为哮喘患者体内CD4+CD25+Treg细胞功能及其数量的异常表达可能是哮喘发病机制之一[14, 15, 16, 17, 18]。有研究表明Th17细胞主要依靠分泌的IL-17A在哮喘的发生发展中发挥着重要作用,IL-17A为促炎因子,能通过促进炎症的发生从而促进哮喘的发展,同时还可以通过动员、募集及活化中性粒细胞参与气道重塑的发生[19, 20, 21]。由此可以推测Th17细胞分泌的炎性因子可以促进气道重塑的发生。Kearley等[22, 23]研究发现CD4+CD25+Treg细胞可以通过分泌IL-10减轻哮喘气道炎症、气道高反应性及气道重塑的发生,Lauren等[24]研究认为FoxP3+的表达可以与IL-10调节气道重塑有关。Donaldson等[25]发现应用一种大肠杆菌肠毒素B亚单位(EtxB)治疗哮喘可以增加CD4+CD25+Treg细胞肺部及全身的表达,从而抑制肺部病理学的改变。黄花荣等[26]的研究证明CD4+CD25+Treg细胞数目的多少与哮喘疾病的严重程度存在一定的相关性,CD4+CD25+Treg细胞数目越少哮喘患者病情越严重。本实验发现模型组各时间点CD4+CD25+Treg细胞数目较对照组显著降低,气道总管壁面积及平滑肌面积明显增厚;随着激发时间的延长哮喘小鼠体内CD4+CD25+Treg细胞数与气道总管壁面积及平滑肌面积呈现负相关关系,即随着刺激激发时间的延长,气道重塑越明显、CD4+CD25+Treg细胞数越低,气道总管壁面积及平滑肌面积增厚越明显。提示哮喘小鼠体内确实存在CD4+CD25+Treg细胞水平表达异常,并影响着气道重塑的程度。
Bulek等[27]研究表明Th17细胞的生物学效应主要是IL-17通过IL-17受体(IL-17RA和IL-17RC)实现的,国外大量实验研究表明IL-17可以通过上调一系列气道重塑因子(IL-6、IL-ll、IL-8和Gro-a)的表达从而促进粘液腺分泌,平滑肌细胞的增殖及上皮下纤维化,与哮喘气道重塑的发生相关[28, 29]。Wang等[30]研究提示哮喘慢性期应用抗IL-17的单克隆抗体可以降低气道上皮细胞的异常增生,减少粘液腺的分泌及气道平滑肌细胞的异常增殖从而延缓气道重塑的发生。Zhao等[31]研究也认为中性粒细胞及由Th17细胞分泌的IL-17在慢性持续期小鼠体内发挥作用。应用Th17基因缺失的小鼠发现Th17细胞诱导的气道重塑有可能是通过Th2发挥作用的。本实验发现模型组各时间点Th17细胞数目较对照组显著升高,气道总管壁面积及平滑肌面积明显增厚;随着激发时间的延长哮喘小鼠体内Th17细胞数与气道总管壁面积及平滑肌面积呈现正相关关系,即随着激发时间的延长,气道重塑越明显、Th17细胞数越高,气道总管壁面积及平滑肌面积越厚。提示哮喘小鼠同时确实存在Th17细胞水平表达异常,并影响着气道重塑的程度。
总之,哮喘小鼠气道重塑的改变是动态改变过程,激发的时间越长,哮喘气道重塑越严重,Th17细胞表达升高越明显,CD4+CD25+Treg细胞数目降低越明显,Th17细胞与气道重塑程度呈现正相关,而CD4+CD25+Treg细胞与气道重塑程度呈现负相关,两者间免疫失衡可能是哮喘气道重塑发生的重要因素之一,所以临床工作中早期纠正哮喘患者免疫功能成为治疗哮喘的重要发展方向,同时也为临床上评估哮喘患者预后提供了方向及实验室依据。
| [1] | Gershon AS, Guan J, Wang C, et al. Describing and quantifying asthma comorbidity:a population study[J]. PLoS One, 2012, 7(5):e34967. |
| [2] | 陈欣,林江涛.我国支气管哮喘防治现状[J].内科急危重症杂志, 2008, 14(5):225-226. |
| [3] | 全国儿科哮喘协作组.第三次中国城市儿童哮喘流行病学调查[J].中华儿科杂志, 2013, 51(10):729-735. |
| [4] | Halwani R, Al-Muhsen S, Hamid Q. Airway remodeling in asthma[J]. Curr Opin Pharmacol, 2010, 10(3):236-245. |
| [5] | Bergeron C, Al-Ramli W, Hamid Q. Remodeling in asthma[J]. Proc Am Thorac Soc, 2009, 6(3):301-305. |
| [6] | Valentin ED, Crahay C, GarbackiN, et al. New asthma biomarkers:lessons from murine models of acute and chronic asthma[J]. Physiol Lung Cell M olPhysiol, 2009, 296(2):185-197. |
| [7] | Kay AB. Allergy and allergic diseases[J]. N Eng I J Med, 2001, 344(1):30-37. |
| [8] | Van Oosterhout AJ, Motta AC. Th1/Th2 paradigm:not seeing the forest for the trees?[J]. Eur Respir J, 2005, 25(4):591-593. |
| [9] | Choi IS. Immune tolerance by induced regulatory T cells in asthma[J]. Allergy Asthma Immunol Res[J]. 2012, 4(3):113-115. |
| [10] | Veldhoen M, Hocking RJ, Atkins CJ, et al. TGF-β in the context of an inflammatory cytokine milieu supports de novo differentiation of IL-17-producing T cells[J]. Immunity, 2006, 24(2):179-189. |
| [11] | 姚斌,李敏,庞英.草分枝杆菌对哮喘小鼠CD4+CD25+调节性T细胞和Th17细胞平衡的影响[J].中国当代儿科学杂志, 2013, 15(11):1018-1022. |
| [12] | 王绍斌,沈华浩.支气管哮喘小鼠气道重塑过程的动态观察[C].济南:中华医学会第七次全国呼吸病学术会议, 2006. |
| [13] | Temelkovski J, Hogan SP, Shepherd DP, et al. An improved murine model of asthma:selective airway inflammation, epithelial lesions and increased methacholine responsiveness following chronic exposure to aerosolised allergen[J]. Thorax, 1998, 53(10):849-856. |
| [14] | 陈跃华,朱华芳,范婷婷.哮喘患儿CD4+CD25+ T细胞Foxp3表达的意义[J].实用儿科临床杂志, 2007, 22(9):657-658. |
| [15] | Xue K, Zhou Y, Xiong S, et al. Analysis of CD4+ CD25+ regulatory T cells and Foxp3 mRNA in the peripheral blood of patients with asthma[J]. J Huazhong Univ Sci Technolog, 2007, 27(1):31-33. |
| [16] | Zu Y, Li CR, Zheng YJ, et al. The role of CD4+CD25+ regulatory T cells in the pathogenesis of asthma in children[J]. Zhonghua Yi Xue Za Zhi, 2006, 86(1):35-38. |
| [17] | 李敏,宋丽,张剑波,等.哮喘患儿CD4+ CD25+ Treg细胞及 IL-10和TGF-β1的变化[J].中国当代儿科杂志, 2009, 11(10):829-832. |
| [18] | 庞英,李敏,张剑波,等.糖皮质激素对CD4+ CD25+调节性T细胞和TLR4表达的影响[J].实用医院临床杂志, 2012, 1(9):60-62. |
| [19] | Jones CE, Chan K. Interleukin-17 in sputum correlates with airway hyperresponsiveness to methacholine[J]. Am J Respir Cell Mol Biol, 2002, 26(6):748-753. |
| [20] | Oboki K, Ohno T, Saito H, et al. Th17 and allergy[J]. Allergol Int, 2008, 57(2):121-34. |
| [21] | Barczyk A, Pierzchala W, Sozanska E. Interleukin-17 in sputum correlates with airway hyperresponsiveness to methacholine[J]. Respir Med, 2003, 97(6):726-733. |
| [22] | Kearley J, Barker JE, Robinson DS, et al. Resolution of airway inflammation and hyperreactivity after in vivo transfer ofCD4+CD25+ regulatory T cells is interleukin 10 dependent[J]. ExpMed, 2005, 202(11):1539-1547. |
| [23] | Kearley J, Robinson DS, Lloyd CM. CD4+CD25+ regulatory T cells reverse established allergic airway inflammation and prevent airway remodeling[J]. Allergy Clin Immunol, 2008, 122(3):617-624. |
| [24] | Lauren EM, Ammon-Treiber S, Mothes B, et al. Modified Foxp3 mRNA protects against asthma through an IL-10-dependent mechanism[J]. J Clin Invest, 2013, 123(3):1216-1228. |
| [25] | Donaldson DS, Apostolaki M, Bone HK, et al. The Escherichia coli heat-labile enterotoxin B subunit protects from allergic airway disease development by inducing CD4+ regulatory T cells[J]. Mucosal Immunol, 2013, 6(3):535-546. |
| [26] | 黄花荣,刘甜甜,麦贤弟,等.哮喘患儿外周血CD4+CD25+调节性T细胞的变化及其与哮喘病情的关系[J].新医学, 2009, 40(4):221-223. |
| [27] | Bulek K, Caini Liu, Swaidani S, et al. The inducible kinase IKKi is required for interleukin 17-dependent signaling associated with neutrophilia and pulmonary inflammation[J]. Nat Immunol, 2011, 12(9):844-852. |
| [28] | Molet S, Hamid Q, Davoine F, et al. IL-17 is increased in asthmatic airways and induces human bronchial fibroblasts to produce cytokines[J]. J Allergy Clin Immunol, 2001, 108(3):430-438. |
| [29] | Molet SM, Hamid QA, Hamilos DL. IL-11 and IL-17 expression in nasal polyps:relation ship to collagen deposition and suppression by intranasal fluticasone propionate[J]. Laryngoscope, 2003, 113(10):1803-1812. |
| [30] | Wang Q, Li H, Yao Y, et al. The overexpression of heparinbinding epidermal growth factor is responsible for Th17-induced airway remodeling in an experimental asthma model[J]. J Immunol, 2010, 185(2):834-841. |
| [31] | Zhao J, Lloyd CM, Noble A. Th17 responses in chronic allergic airway inflammation abrogate regulatory T-cell-mediated tolerance and contribute to airway remodeling[J]. Mucosal Immunol, 2013, 6(2):335-346. |
 2015, Vol. 17
2015, Vol. 17