呼吸窘迫综合征( respiratory distress syndrome, RDS)是早产儿常见的呼吸道疾病之一,主要由于肺泡表面活性物质缺乏或失活所致,具有发病率高、病情重和病死率高等特点[1, 2]。近年来,随着早产儿数量的增加,RDS及其相关并发症的治疗成为研究热点[3]。早产儿RDS患儿通常需要一定程度的呼吸支持,特别是重度RDS往往需要机械通气,然而长时间的机械通气可导致肺损伤(包括支气管肺发育不良)等多种并发症,因此无创呼吸支持技术在早产儿RDS的应用越来越受临床重视[4]。经鼻持续气道正压通气(nasal continuous positive airway pressure, nCPAP)是早产儿无创呼吸支持的常用技术,但是研究显示在预防插管/拔管后再插管有较高的失败率[5]。而近年报道经鼻间歇正压通气(nasal intermittent positive pressure ventilation, nIPPV)较nCPAP能减少重新插管率,减少了插管/再插管后使用机械通气比例,但可能增加胃肠道反应等并发症[6]。经鼻同步间歇指令通气(nasal synchronous intermittent mandatory ventilation, nSIMV)是一种特殊nIPPV,能与患儿呼吸同步,减少呼吸做功,在早产儿呼吸暂停、早产儿RDS中被广泛应用[7]。但关于早产儿重度RDS患儿撤机后行nSIMV与nCPAP的临床疗效及副反应国内文献报道较少。因此,本研究回顾性分析2013年1月至2015年5月我科早产儿重度RDS在撤机后行nCPAP呼吸支持与行nSIMV的临床资料,比较两种呼吸支持的临床疗效及副反应,为早产儿重度RDS撤机后呼吸支持治疗提供理论依据。
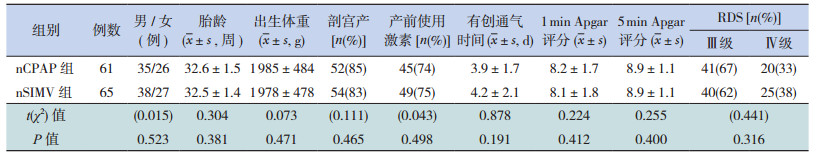
1 资料与方法 1.1 研究对象研究对象为2013年1月至2015年5月在第三军医大学西南医院新生儿重症监护病房住院的126例重度RDS早产儿。2013年1月至2014年3月撤机后行nCPAP呼吸支持患儿61例(nCPAP组),其中男35例,女26例;胎龄32.6±1.5周;2014年4月至2015年5月撤机后行nSIMV呼吸支持患儿65例(nSIMV组),其中男38例,女27例;胎龄32.5±1.4周。两组患儿在性别、胎龄、出生体重、剖宫产比例、产前使用激素比例、有创通气时间、1 min Apgar评分、5 min Apgar评分和RDS病情程度方面比较差异无统计学意义(表 1)。两组患儿的治疗方式充分告知家属,并签署知情同意书。
| 表 1 nSIMV 组和 nCPAP 组患儿一般资料的比较 |
纳入标准:(1)胎龄<36 周;(2) 所有患儿均符合重度RDS 的诊断标准[8];(3)机械通气时间大于24 h。排除标准:(1)伴随严重心、肺、肝、肾等脏器并发症;(2)严重感染、贫血; (3)先天性畸形。
1.2 方法所有患儿给予肺表面活性剂(珂立苏,华润双鹤药业股份有限公司)100 mg/kg气管插管内滴入后,连接呼吸机,根据病情采用SIMV或A/C模式,根据血气结果和临床表现调整呼吸机各参数。有创呼吸机撤机指标为气道峰压(PIP)<16~18 cm H2O,呼气末正压(PEEP)<3 cm H2O,氧浓度(FiO2)<0.4,呼吸频率(R)<20 次/min,患儿呼吸平稳,无吸气性三凹征及呻吟,血氧饱和度(SaO2)>88%。然后拔除气管插管,并分别采用nCPAP 或nSIMV无创呼吸支持。
nCPAP 装置为小儿CPAP系列持续正压通气系统(STEPHAN CPAP B Plus)。初调参数:吸气流速(Flow)4~8 L/min,CPAP压力4~6 cm H2O,FiO2 0.21~0.5。当参数CPAP压力降至2~3 cm H2O, FiO2<0.4 时停用nCPAP。
nSIMV 装置采用具有SIMV 功能的呼吸机(STEPHAN小儿呼吸机Christina型),连接鼻塞。初调呼吸机参数:R 25~30次/min,PIP 15~ 20 cm H2O,PEEP 4~6 cm H2O,FiO2 0.21~0.5。当参数平均气道压降至<8 cm H2O,FiO2<0.4,PEEP≤3 cm H2O时停用nSIMV。
根据患儿血气结果和临床表现调节呼吸机参数,以维持PaO2 60~80 mm Hg,PaCO2 40~50 mm Hg, 经皮血氧饱和度(TcSaO2)88%~92%。撤机失败的指标:(1)撤机72 h 内采用无创呼吸支持模式不能满足患儿TcSaO2 88%~92%;(2)反复发生呼吸暂停(24 h内>4次,一次呼吸暂停时间>20 s,或<20 s,但心率每分钟<100次,青紫、血氧饱和度下降和肌张力低下);(3)血气分析提示pH<7.20、PaO2 <50 mm Hg和PaCO2 >60 mm Hg。
1.3 观察指标比较nSIMV组和nCPAP组患儿治疗前和治疗后4 h 血气指标(pH值、PaCO2、PaO2、SaO2和OI)变化情况;观察两组患儿撤机失败率,并分析撤机失败原因(低氧血症、高碳酸血症和呼吸暂停);比较两组患儿呼吸机支持时间、全肠道喂养时间、恢复出生体重时间和总住院时间的差异;观察两组患儿治疗后并发症,如腹胀、喂养不耐受、坏死性小肠结肠炎(NEC)、脑室内出血(IVH)、早产儿视网膜病变(ROP)和支气管肺发育不良(BPD)的发生情况。
1.4 统计学分析所有数据采用SPSS 21.0统计软件进行统计学分析,对计数资料采用χ2检验,对计量资料采用两独立样本的t检验,治疗前后的比较采用配对t检验,P<0.05为差异性有统计学意义。
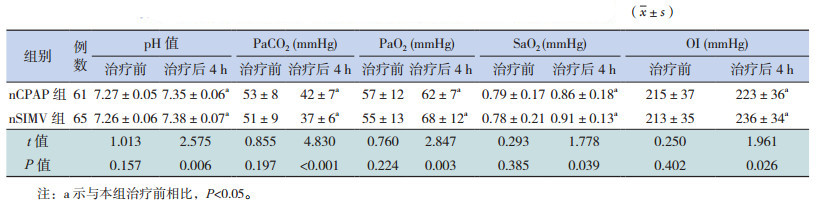
2 结果 2.1 两组患儿治疗前和治疗后4 h血气分析指标比较治疗前,nSIMV组和nCPAP组患儿在pH值、PaCO2、PaO2、SaO2和氧合指数(OI)方面进行比较,差异无统计学意义(P>0.05);两组患儿治疗后4 h和治疗前相比,pH值、PaO2、SaO2和OI均明显升高(P<0.05),PaCO2明显降低(P<0.05)。在治疗4 h后,nSIMV组pH值、PaO2、SaO2和OI均高于nCPAP组(P<0.05),nSIMV组PaCO2低于nCPAP组(P<0.05)(表 2)。
| 表 2 nSIMV 组和 nCPAP 组患儿治疗前和治疗后 4 h 血气分析指标比较 |
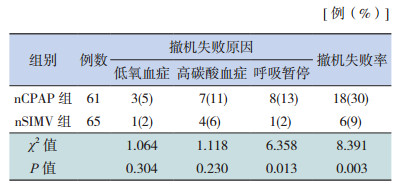
nSIMV组撤机失败率低于nCPAP组,差异有统计学意义(表 3)。两组撤机失败的原因主要包括低氧血症、高碳酸血症和呼吸暂停,其中nSIMV组呼吸暂停发生率低于nCPAP组(表 3)。
| 表 3 nSIMV 组和 nCPAP 组撤机失败率及原因的比较 |
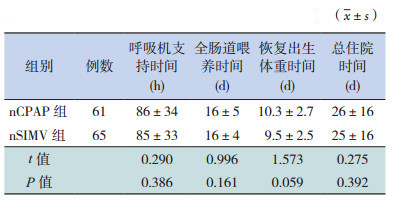
两组患儿在呼吸机支持时间、全肠道喂养时间、恢复出生体重时间和总住院时间上比较差异无统计学意义(P>0.05),见表 4。
| 表 4 nSIMV 组和 nCPAP 组治疗临床疗效比较 |
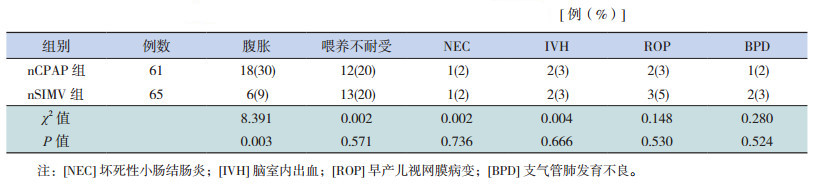
nSIMV组治疗后腹胀发生率明显低于nCPAP组(P<0.05);而两组喂养不耐受、坏死性小肠结肠炎(NEC)、脑室内出血(IVH)、早产儿视网膜病变(ROP)和支气管肺发育不良(BPD)的发生率两组比较差异无统计学意义(表 5)。
| 表 5 nSIMV 组和 nCPAP 组患儿治疗后并发症的比较 |
RDS是早产儿常见的呼吸道疾病,也是早产儿死亡的主要原因[9]。目前已证实产前激素和出生后肺表面活性物质的治疗有明显效果[10]。然而,在RDS治疗的另外一个重要手段是改善通气,促进氧合作用,特别是早产儿重度RDS,多需行气管插管呼吸机来辅助通气。研究证实,经气管插管的常规机械通气容易造成呼吸机相关肺损伤,以及致呼吸机相关性肺炎、肺出血、持续肺动脉高压、BPD等多种并发症[11]。因此,关于如何减少机械通气时间和避免再次上机显得尤其重要。
常规机械通气撤机后多采用nCPAP 辅助通气进行过渡,nCPAP能够使具有自主呼吸的患儿增加功能残气量,防止肺泡萎陷,减少呼吸暂停,改善通气。然而,依旧有25%~40%的患儿因频繁出现呼吸暂停或严重的CO2潴留不能继续使用nCPAP,需要再次进行插管机械通气[12]。Chang等[5]
研究显示nSIMV 能够通过非侵入性途径给早产儿呼吸支持提供稳定的压力,同时同步正压通气可以减少患儿呼吸阻力,在维持有效通气的同时减少了机械通气并发症。nSIMV在nCPAP基础上增加了一定频率的同步间歇正压,较nCPAP具有更强的呼吸支持,其允许患儿存在自主呼吸,并可由患儿的自主呼吸触发呼吸机,给予同步正压通气,可使自主呼吸与机械通气相结合,大大提高了通气量、潮气量和通气效率。nSIMV 可设定一定的呼吸支持频率,在患儿严重呼吸暂停时仍能给予设定的呼吸频率进行通气支持。而患儿自主呼吸的吸气负压可触发呼吸机给予同步正压通气,以非侵入性的方式提供稳定的PIP和PEEP,可有效防止肺泡萎陷、扩张小气道和减少呼吸功。Pantalitschka 等[13]把nSIMV应用于早产儿呼吸暂停中发现,nSIMV较nCPAP能降低呼吸暂停的发生,提高疗效,并减少并发症。
本研究结果显示nSIMV组和nCPAP组两组患儿治疗后,血气均得到了改善,说明两种呼吸支持之后,患儿的通气情况均明显好转。为进一步比较两组间的治疗效果,研究结果显示两组患儿在治疗4 h后,nSIMV组pH值、PaO2、SaO2和OI均高于nCPAP组,nSIMV组PaCO2低于nCPAP组,说明nSIMV相比nCPAP更能改善通气,促进氧合。国外Greenough等[14]研究表明nSIMV在新生儿通气支持上更能够保持血气稳定性,本研究结果与之相似。
本研究结果显示nSIMV组撤机失败率(9%),明显低于nCPAP组撤机失败率(30%)。分析各自撤机失败的原因,nSIMV组撤机失败主要由于高碳酸血症,而nCPAP组撤机失败主要在于呼吸暂停和高碳酸血症,其中nSIMV组呼吸暂停发生率显著低于nCPAP组。提示nSIMV在频繁出现呼吸暂停的患儿中治疗效果更佳。分析其原因,可能是nSIMV能够改善患儿呼吸协调性,扩张气道,减少呼吸阻力,增强气体交换,从而减少呼吸性酸中毒和呼吸暂停。
本研究结果表明治疗后nSIMV组腹胀发生率明显低于nCPAP组,这可能和nSIMV同步正压通气减少患儿腹部异常运动有关。国内学者研究结果也表明nSIMV在治疗早产儿呼吸暂停中能够减少腹胀[15]。同时,两组患儿喂养不耐受、NEC、IVH、ROP和BPD等并发症的发生率差异无统计学意义,提示nSIMV治疗后胃肠道副反应小,且不增加并发症的发生率。
综上所述,对于早产儿重度RDS撤机后采用nSIMV能显著改善肺功能,保持血气稳定,降低了撤机失败率,并减少了胃肠道反应,且不增加并发症的发生率,临床治疗效果确切。因此,在早产儿重度RDS撤机后应用nSIMV值得临床推广。
| [1] | Zhou B, Zhai JF, Jiang HX, et al. Usefulness of DuoPAP in the treatment of very low birth weight preterm infants with neonatal respiratory distress syndrome[J]. Eur Rev Med Pharmacol Sci, 2015, 19(4): 573-577. |
| [2] | Howlett A, Ohlsson A, Plakkal N. Inositol in preterm infants at risk for or having respiratory distress syndrome[J]. Cochrane Database Syst Rev, 2015, 2: D366. |
| [3] | Armanian AM, Badiee Z, Heidari G, et al. Initial treatment of respiratory distress syndrome with nasal intermittent mandatory ventilation versus nasal continuous positive airway pressure: a randomized controlled trial[J]. Int J Prev Med, 2014, 5(12): 1543-1551. |
| [4] | Rebello CM, Precioso AR, Mascaretti RS; Grupo Colaborativo do Estudo Brasileiro Multicêntrico de Surfactante. A multicenter, randomized, double-blind trial of a new porcine surfactant in premature infants with respiratory distress syndrome[J]. Einstein (Sao Paulo), 2014, 12(4): 397-404. |
| [5] | Chang HY, Claure N, D'ugard C, et al. Effects of synchronization during nasal ventilation in clinically stable preterm infants[J]. Pediatr Res, 2011, 69(1): 84-89. |
| [6] | 王灿, 陈龙, 汪丽, 等. 经鼻间歇正压通气用于拔管后呼吸 支持的临床研究[J]. 重庆医学, 2013, 42(36): 4408-4409. |
| [7] | Wang C, Guo L, Chi C, et al. Mechanical ventilation modes for respiratory distress syndrome in infants: a systematic review and network meta-analysis[J]. Crit Care, 2015, 19: 108. |
| [8] | Yilmaz O, Kahveci H, Zeybek C, et al. Inhaled iloprost in preterm infants with severe respiratory distress syndrome and pulmonary hypertension[J]. Am J Perinatol, 2014, 31(4): 321-326. |
| [9] | Nayeri FS, Esmaeilnia ST, Aminnezhad M, et al. Comparison of INSURE method with conventional mechanical ventilation after surfactant administration in preterm infants with respiratory distress syndrome: therapeutic challenge[J]. Acta Med Iran, 2014, 52(8): 596-600. |
| [10] | Paul S, Rao S, Kohan R, et al. Poractant alfa versus beractant for respiratory distress syndrome in preterm infants: a retrospective cohort study[J]. J Paediatr Child Health, 2013, 49(10): 839-844. |
| [11] | Ochiai R. Mechanical ventilation of acute respiratory distress syndrome[J]. J Intensive Care, 2015, 3(1): 25-33. |
| [12] | 孔令凯, 孔祥永, 李丽华, 等. 双水平正压通气和经鼻持续 气道正压通气在早产儿呼吸窘迫综合征撤机后应用的比较[J]. 中国新生儿科杂志, 2014, 29(1): 14-18. |
| [13] | Pantalitschka T, Sievers J, Urschitz MS, et al. Randomised crossover trial of four nasal respiratory support systems for apnoea of prematurity in very low birthweight infants[J]. Arch Dis Child Fetal Neonatal Ed, 2009, 94(4): F245-F248. |
| [14] | Greenough A, Sharma A. What is new in ventilation strategies for the neonate?[J]. Eur J Pediatr, 2007, 166(10): 991-996. |
| [15] | Bai XM, Bian J, Zhao YL, et al. The application of nasal synchronized intermittent mandatory ventilation in primary apnea of prematurity[J]. Turk J Pediatr, 2014, 56(2): 150-153. |
 2016, Vol. 18
2016, Vol. 18