支气管哮喘作为儿童期最常见的慢性呼吸道疾病,因具反复发作性,影响儿童的生长发育、降低人群生活质量、增加家庭经济负担而备受国内外学者高度重视,因此成为近期研究的热点。而在研究哮喘的同时发现,全球范围肥胖及哮喘发病率呈同步增长现象[1, 2],这两者间是否存在一定的联系逐渐引起学者的兴趣,而相关的研究多集中于成人,极少涉及儿童。本研究将哮喘治疗后肺功能改善程度及哮喘控制情况作为观察指标,探讨体重因素在患儿哮喘治疗中的影响。
1 资料与方法 1.1 研究对象研究对象为2014年5月至2015年5月就诊于我院儿科哮喘专科门诊的患儿129例,纳入研究的患儿均须符合以下条件:(1)年龄5~12岁;(2)根据儿童支气管哮喘诊断与防治指南(2008版)首次诊断为哮喘,处于哮喘慢性持续期的中度哮喘患儿[1];(3)行相关检查后均无其他急慢性疾病,如心脏疾病、限制性肺病、间质性肺炎、除外哮喘其他疾病所致肺结构异常、结核感染等。另选取期间来我院体检的68例健康儿童作为健康对照组。所有研究对象均行肺功能检测并获其监护人知情同意加入此研究。
1.2 分组与治疗方法测量身高和体重,身高精确到0.1 cm,体重精确到0.05 kg。体重指数(BMI)高于同年龄、同性别人群第85百分位为肥胖。依据BMI将哮喘患儿分为2组:正常体重哮喘组(n=64)、哮喘伴肥胖组(n=65)。68例健康对照组儿童BMI正常。
所有患儿均进行吸入技能相关训练,在能正确熟练掌握吸入方法后,对入组患儿予以舒利迭干粉剂(沙美特罗替卡松吸入剂50/100 μg)吸入,早晚各1次,每吸含沙美特罗50 μg,丙酸氟替卡松100 μg,或信必可都保(布地奈德福莫特罗粉吸入剂80/4.5 μg)吸入,早晚各1次,每吸含布地奈德80 μg,富马酸福莫特罗4.5 μg。对有过敏性鼻炎患儿,采用鼻用激素(糠酸莫米松比喷雾剂、布地奈德鼻喷雾剂)及色甘萘甲那敏比喷雾剂联合顺尔宁治疗。治疗中急性发作患儿根据病情合理选用布地奈德混悬液(1 mg)、硫酸特布他林雾化液(2.5 mg或5 mg)、异丙托溴铵雾化液(1 mL)雾化治疗,必要时予口服或全身应用糖皮质激素。按照全球哮喘防治创意指南(GINA),治疗3个月后根据患儿哮喘控制情况及时调整治疗方案。
1.3 观察指标每1~2个月随访1次,记录患儿治疗期间白天及夜间哮喘症状控制情况、活动情况、额外使用速效β2受体激动剂情况、无症状天数、呼吸道感染患病情况、哮喘发作急诊就诊情况、哮喘雾化及全身激素用量(泼尼松或相当剂量的其他激素)情况等。并根据患儿哮喘控制测试(ACT)评分进行疗效评估,低于20分为未控制,20~24分为部分控制,25 分(满分为25分)为完全控制。
治疗前、治疗1年后分别测定患儿肺功能(测定时无急性发作或上呼吸道感染、支气管感染等)。肺功能测定仪器为德国耶格公司生产,由肺功能技师专人操作。主要观察指标包括:第1秒用力呼气容积占预计值百分比(FEV1%)、用力肺活量占预计值的百分比(FVC%)、呼气峰流速(PEF)、用力呼气25%流速(FEF25)、用力呼气50%流速(FEF50)。
1.4 统计学分析应用SPSS 17.0统计软件进行统计学分析,符合正态分布的计量资料用均数±标准差(x±s)表示,3组间比较采用单因素方差分析(3组间两两比较采用Scheffe检验);两组间均数的比较采用t检验。非正态分布的计量资料采用中位数(四分位间距)[P50(P25,P75)]表示,两组间比较采用Wilcoxon秩和检验。计数资料采用百分率(%)比较,组间等级资料的比较采用Mann-Whitney U检验。P<0.05示差异有统计学意义。
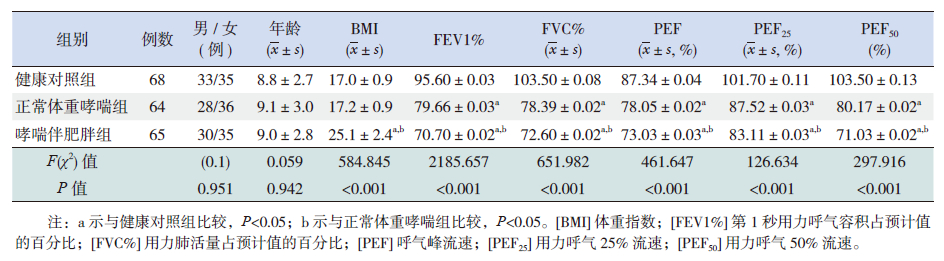
2 结果 2.1 治疗前组间相关指标的比较健康对照组、正常体重哮喘组、哮喘伴肥胖组3组间年龄、性别构成比差异无统计学意义。治疗前3组间肺功能组间两两比较差异均有统计学意义(P<0.001),其中健康对照组肺功能测定值最优,哮喘伴肥胖组测定值最差,见表 1。
| 表 1 各组治疗前相关指标的比较 |
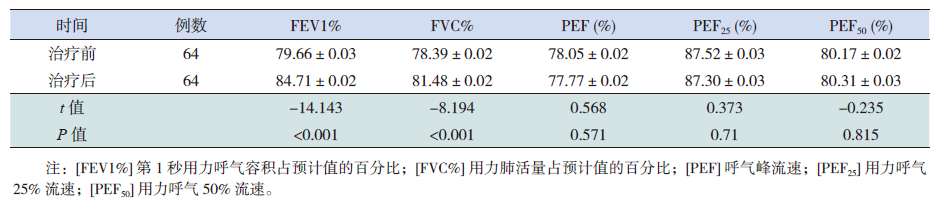
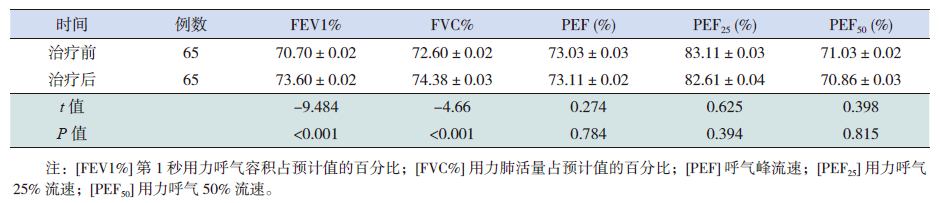
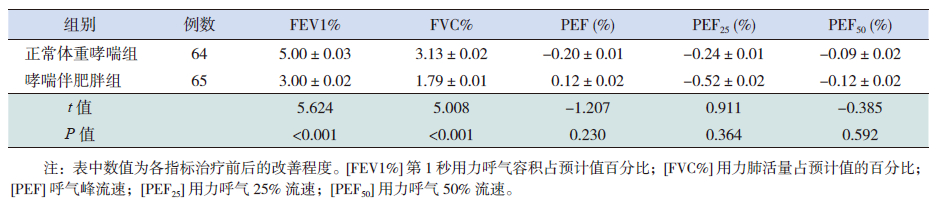
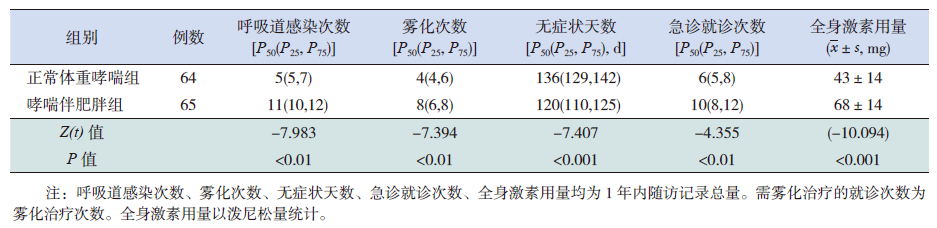
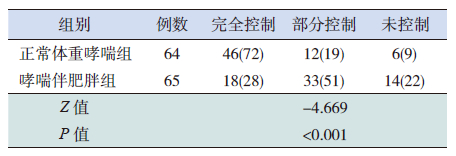
规范化治疗1年后两个哮喘组FEV1%、FVC%较治疗前有所改善(P<0.05),且以正常体重哮喘组改善更明显(P<0.001),但PEF、PEF25、PEF50两组均无明显改善(P>0.05)(表 2~4)。两组治疗期间哮喘伴肥胖组呼吸道感染次数、雾化治疗次数、哮喘发作急诊就诊次数、全身激素用量均比正常体重哮喘组多,而无症状天数明显少于正常体重哮喘组(表 5)。正常体重哮喘和哮喘伴肥胖组的哮喘完全控制率、部分控制率、未控率比较差异有统计学意义(P<0.001),以正常体重哮喘组控制更好(表 6)。
| 表 2 正常体重哮喘组治疗前后肺功能的变化 (x±s) |
| 表 3 哮喘伴肥胖组治疗前后肺功能的变化 (x±s) |
| 表 4 正常体重哮喘组及哮喘伴肥胖组治疗1 年后肺功能改善情况 (x±s) |
| 表 5 正常体重哮喘组与哮喘伴肥胖组治疗情况的比较 |
| 表 6 治疗1 年后正常体重哮喘组及哮喘伴肥胖组哮喘控制情况的比较 [n(%)] |
近20年来,全球范围内肥胖及哮喘发病率呈同步增长现象[2, 3],自GINA将肥胖作为哮喘发生发展的独立危险因素提出后,越来越多针对成人的研究发现肥胖不仅增加了哮喘的发病率,同时降低了激素治疗的疗效[4, 5],但肥胖对哮喘的影响机制仍未明了,目前的主要研究集中于遗传、机械损伤、炎性损伤、肥胖相关并发病等方面[6, 7, 8, 9]。
Weiss 等[10]报道肥胖与哮喘都存在家族聚集现象,Hallstrand等[11]针对1 384名双生儿基因多态性的研究发现,接近8%的肥胖基因序列与哮喘同源,这种同源性增加了肥胖患者发生哮喘的几率。
此后的基因片段分析发现,5q、6p、11q、12q作为肥胖和哮喘相关基因片段的重叠区域,与两种疾病发生密切相关[12]。其中5q的基因多态性与气道高反应性(AHR)、血清IgE水平、气管对β受体激动剂敏感性、肥胖的发生等有关;6p基因片段多态性不但与包括肥胖、胰岛素抵抗、高血压等在内的代谢异常有关,还与哮喘的发生显著相关,与此位点毗邻的TNF-β基因片段多态性与多种哮喘表型、腰围和其他代谢综合征相关表型有关[13, 14, 15];11ql3的解耦联蛋白基因多态性一方面通过对代谢率的调控参与肥胖的发生,另一方面可表达低亲和力FCεRB受体引起Th2免疫紊乱,参与哮喘的发生;12q多态性与体重及脂肪体积有关,而其编码的维生素D受体,又随体内维生素D水平的波动表现出不同的活性参与哮喘的发生[16]。基因多态性在解释肥胖对哮喘发病率及疗效中的意义为临床对哮喘伴肥胖患儿诊疗提供了新的思路。
本研究中,治疗前对3组儿童肺功能指标的比较发现,两组哮喘患儿肺功能指标均有下降,其中以哮喘伴肥胖组降低更为明显,此结果与Haselkron等[17]的研究结论“肥胖可加重哮喘患者肺功能损害”相一致。而在治疗满1年后,对正常体重哮喘组及哮喘伴肥胖组肺功能指标改善程度的比较发现,两者大气道功能虽较治疗前均有所改善,但哮喘伴肥胖组改善程度明显不及正常体重哮喘组,而两者小气道功能指标在治疗前后均无明显改善,其他相关研究也得出了相似的结论[18, 19],可认为肥胖对哮喘患者造成更为严重的肺功能损害,且导致疗效降低。
国外关于肥胖类型与哮喘肺功能损害关系的研究发现,中心性肥胖(尤其是女性)对哮喘的肺功能损害更为明显[20, 21, 22]。中心性肥胖患者,胸腹部脂肪堆积,增加呼吸运动负荷[23],机体潮气量降低,充足的潮气量是保证呼吸运动正常进行的基础[24],低潮气量将导致以膈肌为主的呼吸肌功能紊乱[19] ——参与呼吸运动的肌肉不能充分伸缩,气管无法充分扩张,气道管径缩小,最终以呼吸肌僵硬、肺顺应性降低为结局,不仅如此,外周气道的反复开放与闭合可造成肺泡破裂,加速哮喘气道狭窄的发生,导致气道重塑,而气道重塑是哮喘特征之一。这种病理损害在临床上表现为哮喘伴肥胖患者更容易出现喘息、胸闷等症状,肺功能损害更为严重且经激素治疗后小气道功能不易恢复,而肺泡的破裂可能是小气道功能恢复不理想的原因之一,此外,此类哮喘患者小气道功能的恢复可能还与哮喘控制不佳、药物反应性差、反复上呼吸道感染等有关。
国外研究哮喘伴肥胖患者体内炎症因子指标时发现,哮喘伴肥胖患者体内呼出气一氧化氮(FENO)、C反应蛋白(CRP)等炎症因子水平均高于正常体重哮喘患者[25],推断肥胖机体处于慢性炎症状态。脂肪组织具有内分泌功能[26],其分泌的瘦素作为促炎因子存在,既可作用于下丘脑增加基础代谢率,又与肺泡表面物质合成增多、支气管上皮增生密切相关,同时还可刺激机体释放TNF-α、IL-6、IL-12、IL-17、IL-1b等炎症介质,刺激交感神经释放儿茶酚胺间接影响肺功能[27]。与此同时,肥胖下调机体脂联素水平,脂联素作为体内主要的抗炎因子,可下调体内促炎因子水平、参与体内相关抗炎因子拮抗剂的活化过程,Sood等[28]的研究认为脂联素是哮喘发生的保护因素。肥胖机体瘦素、脂联素水平失衡,进一步引起体内促炎因子生成增多,为哮喘的发生提供了适宜的炎性环境。国外流行病学研究发现,肥胖多伴有维生素D的缺乏[29, 30],而体内维生素D水平与机体免疫平衡及肺组织对激素治疗敏感性相关[31],因此,体内维生素D水平的降低也被认为是肥胖对哮喘发生及治疗影响的机制之一,此外,肥胖还可通过影响Th17细胞活性参与免疫损害的发生,此通路可能与重症哮喘的发生有关[32]。
本研究还显示,哮喘伴肥胖组在哮喘控制过程中上呼吸道感染次数、雾化次数、全身激素用量等均高于正常体重哮喘组,且临床无症状天数也不及正常体重哮喘组。肥胖通过各种途径对机体免疫功能的损害,是哮喘伴肥胖患者更易罹患呼吸道感染的病理学基础,而反复的呼吸道感染,又可作为哮喘反复发作的诱因,导致哮喘的迁延不愈及肥胖与哮喘间的恶性循环状态,最终导致哮喘伴肥胖患者哮喘控制不佳,肺功能改善不理想,甚而演变成难治性哮喘。
哮喘伴肥胖患者对激素治疗疗效减弱除与免疫紊乱引起哮喘病程迁延不愈有关外,可能还因肥胖所造成的慢性炎症状态降低了机体对激素的敏感性,造成体内炎症因子尤其是TNF-α的表达增多有关,而一项敲除哮喘小鼠体内TNF-α基因的动物实验也侧面证实了此种可能:敲除该基因后,实验小鼠体内相关炎症因子产生减少,气道重塑、肺功能损害等也得到明显的改善[18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33]。此外, Harskamp-van Ginkel等[34]通过对肥胖药代动力学相关数据的分析后得出,肥胖儿童的临床的药代动力学参数与正常体重儿童相比有显著改变,造成了肥胖和非肥胖患儿之间疗效的差异。
肥胖人群多伴有血脂异常[23],Vinding等[35]研究发现,低密度胆固醇水平增加后,哮喘发生的风险增加了93%,且气道堵塞的风险也显著增加;肥胖除导致血脂异常外,也增加了胃食管反流、呼吸睡眠紊乱的发生率,而反流物刺激会增加 哮喘相关症状出现的频率,且不被激素治疗所缓解[36];肥胖还可增加2型糖尿病的发病率[37],Al-Shawwa等[38]的临床研究发现,肥胖者胰岛素抵抗的发病率更高,与Forno 等[39]和Sánchez Jiménez等[40]的研究一致,因此肥胖机体的胰岛素抵抗也可能影响哮喘伴肥胖患者激素治疗效果。
总之,本研究显示,肥胖可能是影响哮喘患儿治疗效果的重要因素,哮喘伴肥胖患儿治疗后大气道功能改善情况及哮喘控制状况较正常体重哮喘患儿差。但尽管对哮喘与肥胖间关系的研究越来越多,仍有许多问题尚未解决,如在探讨哮喘伴肥胖患者激素疗效时,环境、人种及肥胖者自身对哮喘相关症状的高敏感性等因素国内外研究极少涉及,且针对儿童的关于体重减轻在改善肥胖患者的疗效中作用的研究也极为有限,而对这些因素的探讨将作为本次研究的后续工作展开。
| [1] | 中华医学会儿科学分会呼吸学组;中华儿科杂志编辑委 员会. 儿童支气管哮喘诊断与防治指南[J]. 中华儿科杂志, 2008, 46(10): 745-750. |
| [2] | Corbo GM, Forastiere F, De Sario M, et al. Wheeze and asthma in children: associations with body mass index, sports, television viewing, and diet[J]. Epidemiology, 2008, 19(5): 747-755. |
| [3] | Bruske I, Flexeder C, Heinrich J. Body mass index and the incidence of asthma in children[J]. Curr Opin Allergy Clin Immunol, 2014, 14(2): 155-160. |
| [4] | Borrell LN, Nguyen EA, Roth LA, et al. Childhood obesity and asthma control in the GALA Ⅱ and SAGE Ⅱ studies[J]. Am J Respir Crit Care Med, 2013, 187(7): 697-702. |
| [5] | Juel CT, Ulrik CS. Obesity and asthma: impact on severity, asthma control, and response to therapy[J]. Respir Care, 2013, 58(5): 867-873. |
| [6] | Frey U, Latzin P, Usemann J, et al. Asthma and obesity in children: current evidence and potential systems biology approaches[J]. Allergy, 2015, 70(1): 26-40. |
| [7] | Lang JE. Obesity and asthma in children: current and future therapeutic options[J]. Paediatr Drugs, 2014, 16(3): 179-188. |
| [8] | Boulet LP. Obesity and atopy[J]. Clin Exp Allergy, 2015, 45(1): 75-86. |
| [9] | Hampton T. Studies probe links between childhood asthma and obesity[J]. JAMA, 2014, 311(17): 1718-1719. |
| [10] | Weiss ST, Shore S. Obesity and asthma: directions for research[J]. Am J Respir Crit Care Med, 2004, 169(8): 963-968. |
| [11] | Hallstrand TS, Fischer ME, Wurfel MM, et al. Genetic pleiotropy between asthma and obesity in a community-based sample of twins[J]. J Allergy Clin Immunol, 2005, 116(6): 1235- 1241. |
| [12] | Los H, Postmus PE, Boomsma DI. Asthma genetics and intermediate phenotypes: a review from twin studies[J].Twin Res, 2001, 4(2): 81-93. |
| [13] | González JR, Caceres A, Esko T, et al. A common 16p11.2 inversion underlies the joint susceptibility to asthma and obesity[J]. Am J Hum Genet, 2014, 94(3): 361-372. |
| [14] | Hamid YH, Urhammer SA, Glümer C, et al. The common T60N polymarphism of the lymhotaxin-alpha gene is associated with type 2 diabetes and other phenotypes of the metabolic syndrome[J]. Disbetologia, 2005, 48(3): 445-451. |
| [15] | Sandford AJ, Pare PD. The genetics of asthma. The important questions[J]. Am J Respir Crit Care Med, 2000, 161(3 Pt 2): S202-S206. |
| [16] | Clarke JR, Jenkins MA, Hopper JL, et al. Evidence for genetic associations between asthma, atopy, and bronchial hyperresponsiveness: a study of 8- to 18-yr-old twins[J]. Am J Respir Crit Care Med, 2000, 162(6): 2188-2193. |
| [17] | Haselkorn T, Fish JE, Chipps BE, et al. Effect of weight change on asthma-related health outcomes in patients with severe or difficult-to-treat asthma[J]. Respir Med, 2009, 103(2): 274-283. |
| [18] | Razi E, Razi A, Moosavi GA. Influence of body mass indexes on response to treatment in acute asthma[J]. Acta Med Iran, 2014, 52(3): 192-196. |
| [19] | da Rosa GJ, Schivinski CI. Assessment of respiratory muscle strength in children according to the classification of body mass index[J]. Rev Paul Pediatr, 2014, 32(2) : 250-255. |
| [20] | Silva Rde C, Assis AM, Goncalves MS, et al. The prevalence of wheezing and its association with body mass index and abdominal obesity in children[J]. J Asthma, 2013, 50(3): 267- 273. |
| [21] | Tavasoli S, Eghtesadi S, Heidarnazhad H, et al. Central obesity and asthma outcomes in adults diagnosed with asthma[J]. J Asthma, 2013, 50(2): 180-187. |
| [22] | Assad N, Qualls C, Smith LJ, et al. Body mass index is a stronger predictor than the metabolic syndrome for future asthma in women. The longitudinal CARDIA study[J]. Am J Respir Crit Care Med, 2013, 188(3): 319-326. |
| [23] | Shore SA. Obesity and asthma: possible mechanisms[J]. J Allergy Clin Immunol, 2008, 121(5): 1087-1093. |
| [24] | Raj D, Kabra SK, Lodha R. Childhood obesity and risk of allergy or asthma[J]. Immunol Allergy Clin North Am, 2014, 34(4): 753-765. |
| [25] | Gruchała-Niedoszytko M, Malgorzewicz S, Niedoszytko M, et al. The influence of obesity on inflammation and clinical symptoms in asthma[J]. Adv Med Sci, 2013, 58(1): 15-21. |
| [26] | Jensen ME, Gibson PG, Collins CE, et al. Airway and systemic inflammation in obese children with asthma[J]. Eur Respir J, 2013, 42(4): 1012-1019. |
| [27] | 毕鑫, 霍建民. 肥胖人群并发支气管哮喘的可能机制—氧化 应激[J]. 中华哮喘杂志, 2012, 6(2): 123-126. |
| [28] | Sood A, Qualls C, Schuyler M, et al. Low serum adiponectin predicts future risk for asthma in women[J]. Am J Respir Crit Care Med, 2012, 186(1): 41-47. |
| [29] | Paul G, Brehm JM, Alcorn JF. Vitamin D and asthma[J]. Am J Respir Crit Care Med, 2012, 185(2): 124-132. |
| [30] | Ginde AA, Liu MC, Camargo CA Jr. Demographic differences and trends of vitamin D insufficiency in the US population, 1988-2004[J]. Arch Intern Med, 2009, 169(6): 626-632. |
| [31] | Brehm JM, Celedón JC, Soto-Quiros ME, et al. Serum vitamin D levels and markers of severity of childhood asthma in Costa Rica[J]. Am J Respir Crit Care Med, 2009, 179(9): 765-771. |
| [32] | Wang YH, Wills-Karp M. The potential role of interleukin-17 in severe asthma[J]. Curr Allergy Asthma Rep, 2011, 11(5): 388- 394. |
| [33] | Young KJ, Jung-Ho S, Jae-Hyun L, et al. Obesity increases airway hyperresponsiveness via the TNF-α pathway and treating obesity induces recovery[J]. PLoS One, 2015, 10(2): e0116540. |
| [34] | Harskamp-van Ginkel MW, Hill KD, Becker K, et al. Drug dosing and pharmacokinetics in children with obesity: a systematic review[J]. JAMA Pediatr, 2015, 169(7): 678-685. |
| [35] | Vinding RK, Stokholm J, Chawes BL, et al. Blood lipid levels associate with childhood asthma, airway obstruction, bronchial hyperresponsiveness, and aeroallergen sensitization[J]. Allergy Clin Immunol, 2015, 6749(15): 783-786. |
| [36] | Jacobson BC, Somers SC, Fuchs CS, et al. Body-mass index and symptoms of gastroesophageal reflux in women[J]. N Engl J Med, 2006, 354(22): 2340-2348. |
| [37] | Serafino-Agrusa L, Spatafora M, Scichilone N. Asthma and metabolic syndrome: current knowledge and future perspectives[J]. World J Clin Cases, 2015, 3(3): 285-292. |
| [38] | Al-Shawwa BA, Al-Huniti NH, DeMattia L, et al. Asthma and insulin resistance in morbidly obese children and adolescents[J]. Asthma, 2007, 44(6): 469-473. |
| [39] | Forno E, Han YY, Muzumdar RH, et al. Insulin resistance, metabolic syndrome, and lung function in US adolescents with and without asthma[J]. J Allergy Clin Immunol, 2015, 136(2): 304-311. |
| [40] | Sánchez Jiménez J, Herrero Espinet FJ, Mengibar Garrido JM, et al. Asthma and insulin resistance in obese children and adolescents[J]. Pediatr Allergy Immunol, 2014, 25(7): 699-705. |
 2016, Vol. 18
2016, Vol. 18