近年来随着机械通气等新型医疗技术的广泛应用,使早产儿存活率明显提高,但是早产儿长时间吸入高氧后常发生急慢性肺损伤、支气管肺发育不良等严重并发症[1, 2]。沉默接合型信息调节因子2同源蛋白1(sirtuin1,SIRT1)是一类具有高度保守性的依赖烟碱腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)的第三类组蛋白去乙酰化酶,通过组蛋白/非组蛋白去乙酰化基的作用发挥其抗氧化应激、抗炎、抑制细胞凋亡等作用,大量研究已经证实SIRT1在氧化应激中具有保护作用[3, 4, 5]。白藜芦醇(resveratrol,Res)是目前发现SIRT1最有效的天然激动剂[6, 7],可通过上调SIRT1表达参与细胞能量代谢、抑制细胞凋亡等[8, 9, 10, 11],但在高氧诱导早产儿氧化应激损伤中是否具有保护作用,国内外尚无报道。本研究以早产儿外周血单个核细胞(peripheral blood mononuclear cell,PBMC)为研究对象,探讨SIRT1激动剂Res在高氧诱导早产儿氧化应激损伤中是否具有保护作用,从而为Res用于早产儿氧化应激损伤的保护提供实验性理论依据。
1 材料与方法1.1 主要材料与试剂人外周血淋巴细胞分离液(天津灏洋)、Res(上海国药)、胎牛血清(美国Gibco Invitrongen)、丙二醛(MDA)试剂盒(南京建成)、MitoSOXTMRed(Molecular Probes,美国Invitrogen),4%多聚甲醛、DAPI、抗荧光淬灭剂(上海碧云天),BSA(北京索莱宝)、SIRT1小鼠抗人抗体(武汉博士德)、罗丹明标记山羊抗小鼠抗体(北京中杉金桥)、ML-ⅡCB数字智能测氧仪(北京航天鹏诚)、激光共聚焦显微镜(德国Leica TCS SP5)、荧光显微镜(日本OLYMPUS)、全光谱分光光度仪(美国Thermo)、医用低速离心机(河北白洋)。
1.2 实验分组及细胞高氧模型的建立选取2014年3月至2015年3月在四川医科大学附属第一医院新生儿科住院的胎龄<32周且未吸氧的40例早产儿为研究对象,其中男19例,女21例,出生体重1460±118g。采集早产儿外周血1~2mL,EDTA抗凝,采用Ficoll密度梯度离心法分离PBMC,随机数字表法将分离得到的PBMC分为对照组、空气+Res组、高氧组、高氧+Res组。4组标本所对应的早产儿性别、胎龄、出生体重比较差异无统计学意义。对照组置于5%CO2培养箱中培养;空气+Res组:加入终浓度为6μmol/L的Res(采用二甲基亚砜避光溶解,其浓度为1.4g/L)后,置于5%CO2培养箱中培养;高氧组:采用空气混合仪通入以5:95比例混合的CO2和O2,10min后置于5%CO2培养箱中密闭培养,48h后采用ML-ⅡCB数字智能测氧仪检测培养瓶中氧浓度,如培养瓶中氧浓度低于90%,则将此样本弃去;高氧+Res组:加入终浓度为6μmol/L的Res后,通入高氧混合气10min后置于5%CO2培养箱中密闭培养48h,离心收集各组PBMC及培养液检测如下指标[12, 13]。本研究通过四川医科大学附属第一医院伦理委员会批准,血液标本的采集征得家属同意并签署知情同意书。
1.3 激光共聚焦检测PBMC中活性氧簇水平MitoSOXTM是一种具有高度选择性的可检测线粒体内活性氧簇(ROS)的荧光染料,其可自由透过活细胞膜进入细胞内并选择性靶向线粒体,并且可以被线粒体内的ROS氧化产生红色荧光。(1)离心收集PBMC:调整细胞浓度为2×106/mL,取300μL细胞悬液均匀涂于载玻片上,室温待干;(2)固定:4%多聚甲醛固定20min后,PBS洗涤3次;(3)装载探针:按照说明书配制MitoSOXTMRed后,取500μL均匀覆盖于细胞上,37℃湿盒孵育30min,PBS洗涤3次;(4)染核:取DAPI500μL均匀覆盖于细胞上,3min后PBS洗涤3次;(4)封片:取30μL抗荧光淬灭剂封片。采用激光共聚焦显微镜在510nm/580nm处检测红色荧光,采用Image pro plus 6.0图像分析软件对图像进行分析处理,测定平均吸光度值,进行统计分析。
1.4 硫代巴比妥酸比色法检测血清中MDA水平氧化应激可以诱导大量氧自由基生成并且引发脂质过氧化作用,由此形成脂质过氧化物MDA。MDA可以和硫代巴比妥酸缩合,形成红色产物,在532nm处有最大吸收峰。收集各组细胞培养液,采用硫代巴比妥酸比色法(TBA),全光谱分光光度仪检测培养液中MDA的含量[14]。
1.5 免疫荧光检测PBMC中SIRT1定位情况采用细胞免疫荧光方法检测早产儿PBMC中SIRT1蛋白的定位。细胞涂片和固定同上,0.3%TritonX-100室温下打孔10min,PBS洗涤3次,3%BSA室温下封闭40min,一抗(1:50)4℃湿盒孵育过夜,PBS洗涤3次,二抗(1:50)37℃孵育1h,PBS洗涤3次,DAPI染核,PBS洗涤3次,抗荧光淬灭剂封片,荧光显微镜检测SIRT1蛋白的定位。
1.6 Western Blot检测PBMC内SIRT1的表达水平分别提取各组细胞中的总蛋白,采用聚丙烯氨酰胺凝胶电泳,经过SDS-PAGE分离蛋白质,转移至PVDF膜上,用封闭液(5%脱脂奶粉的TBST缓冲液)封闭1h,加入小鼠抗人SIRT1 Amb(1:1000稀释)和小鼠抗人GAPDH Amb(1:3000稀释)4℃孵育过夜后,TBST洗涤3次,每次5min,加入HRP标记的山羊抗小鼠IgG(1:5000稀释),37℃孵育1.5h后,TBST洗涤4次,每次5min。进入暗室,擦去多余的发光剂,将胶片放入显影液中,出现条带后放入定影液中,流水冲洗后晾干。采用UVP凝胶图像处理系统Lakworks 4.6软件分析目的条带的灰度值,结果以SIRT1/GAPDH表示并做统计分析。
1.7 统计学分析采用SPSS 19.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x ± s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验;计数资料用百分率(%)表示,多组间比较采用卡方检验;P<0.05为差异有统计学意义。计数资料组间两两比较采用卡方分割法,P<0.009为差异有统计学意义。
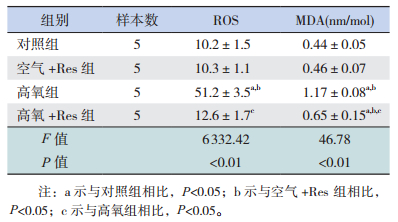
2 结果2.1 氧暴露后各组早产儿PBMC中ROS产生情况与对照组相比,空气+Res组细胞内ROS无明显变化(P>0.05),高氧组细胞内ROS明显增加(P<0.05);与高氧组相比,高氧+Res组细胞中的ROS明显降低(P<0.05),与对照组相比差异无统计学意义(P>0.05)。见图 1,表 1。
 |
图 1 Res对氧暴露后早产儿PBMC内ROS 水平的影响(激光共聚焦,×200) 细胞核呈蓝色荧光,ROS呈红色荧光。与对照组相比,高氧组中红色荧光明显增强,代表ROS明显增加。与高氧组相比,高氧+Res 组中红色荧光明显降低,表示ROS明显降低。 |
| 表 1 Res对氧暴露后早产儿PBMC内ROS水平和 MDA水平的影响(x ± s) |
与对照组相比,空气+Res组细胞内MDA无明显变化(P>0.05),高氧组细胞内MDA明显增加(P<0.05);与高氧组相比,高氧+Res组细胞中的MDA明显降低(P<0.05),但未达到对照组水平(P<0.05)。见表 1。
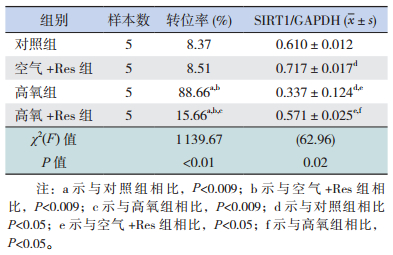
2.3 氧暴露后SIRT1在各组早产儿PBMC中的定位情况与对照组相比,空气+Res组SIRT1转位率无明显变化(P>0.009),高氧组转位率明显增加(P<0.009)。与高氧组相比,高氧+Res组SIRT1转位率明显降低(P<0.009),但未达到对照组水平(P<0.009)。见表 2,图 2。
| 表 2 Res 对早产儿氧暴露后外周血单个核细胞内 SIRT1转位率和 SIRT1 表达水平 |
 |
图 2 Res对早产儿氧暴露后PBMC中SIRT1 转位的影响(免疫荧光,×400) 细胞核呈蓝色荧光,SIRT1呈红色荧光。在对照组中,SIRT1 的红色荧光均匀分布在细胞核中,细胞质中未见分离的红色荧光,表示SIRT1未发生蛋白转位。 在高氧组中,细胞质中出现分离的红色荧光,表示SIRT1 开始从细胞核穿梭至细胞质中。 |
在Westernblot结果中,与对照组相比,空气+Res组SIRT1蛋白表达水平明显升高(P<0.05),高氧组SIRT1蛋白表达水平明显降低(P<0.05);与高氧组相比,高氧+Res组SIRT1蛋白水平明显升高(P<0.05),与对照组相比差异无统计学意义(P>0.05)。见表 2,图 3。
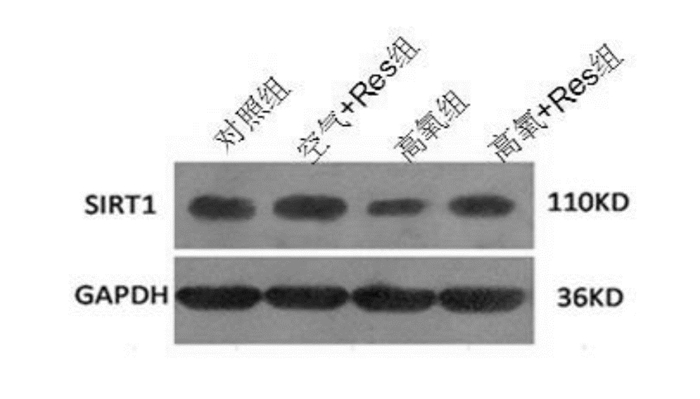 |
图 3 Western blot检测Res对早产儿氧暴露后PBMC内SIRT1 表达的影响 |
近年来随着呼吸机等新型医疗技术的广泛应用,使得早产儿,特别是超低出生体重儿存活率得到很大程度的提升,但这也同时使早产儿更多暴露在高氧环境中。早产儿在长时间吸入高浓度氧气时常发生急慢性肺损伤、支气管肺发育不良等严重并发症。研究发现,氧化应激反应在高氧肺损伤中扮演着非常重要的角色。氧暴露所致的氧化应激可诱导机体产生大量ROS,而早产儿缺乏抗氧化应激酶,因此,当ROS的产生超过了自身机体的清除能力时,常发生氧化应激损伤[14, 15]。研究发现,大量ROS可以上调促凋亡蛋白表达,促进线粒体通透性转变孔的开放,激活天冬氨酸特异的半胱氨酸酶(caspase)诱导肺泡上皮细胞凋亡[16, 17]。
SIRT1是一类依赖NAD+的第三类组蛋白去乙酰化酶,通过去乙酰化组蛋白/非组蛋白赖氨酸残基,如P53、FOXO、NF-κB、eNOS,由此参与调节细胞能量代谢、细胞凋亡及抵抗各种应激等[18, 19, 20]。研究发现定位在细胞核上的SIRT1主要起到抗凋亡作用,当在氧化应激条件下,SIRT1从细胞核穿梭至细胞质中依赖caspase途径促进细胞凋亡[16, 21, 22, 23, 24]。Res是一种存在于葡萄、虎杖、花生等天然植物及果实中的植物多酚类化合物,是目前发现的SIRT1最有效的天然激动剂,大量研究表明Res通过上调SIRT1表达参与细胞能量代谢、抑制细胞凋亡[6, 7, 8, 9, 10, 11]。
本研究以早产儿PBMC为对象,探讨SIRT1激动剂Res在高氧诱导下早产儿的氧化应激损伤中是否具有保护作用,结果显示:与对照组相比,空气+Res组中ROS、MDA、SIRT1转位率无明显变化,SIRT1表达水平明显增加;高氧组中ROS、MDA、SIRT1转位率明显增加,SRIT1蛋白表达水平明显降低。与高氧组相比,高氧+Res组中ROS、MDA、SIRT1转位率明显降低,但仅ROS达到对照组水平,SIRT1蛋白表达水平明显增加,且与对照组比较差异无统计学意义。由此推测:高氧诱导早产儿机体中产生大量ROS、MDA,促使SIRT1核-浆穿梭并抑制SIRT1表达,从而抑制了SIRT1抗氧化应激的能力,进而增加了早产儿氧化应激损伤。SIRT1激动剂Res可以通过上调SIRT1表达及活性并抑制SIRT1核-浆穿梭,从而增加SIRT1抗氧化应激的能力,进而减少了早产儿氧化应激损伤。
综述所述,通过对SIRT1激动剂Res在影响高氧诱导下早产儿PBMC内SIRT1变化及ROS产生的探讨,证明了Res在早产儿氧化应激中具有保护作用。本研究为Res用于早产儿氧化应激损伤的保护提供了一定实验性理论依据,Res可能成为防治早产儿高氧肺损伤、支气管肺发育不良等疾病的新药研发靶点,但其在早产儿抗氧化应激中的具体信号通路及机制还需要进一步的探讨。
| [1] | Sureshbabu A, Syed MA, Boddupalli CS, et al. Conditional overexpression of TGFβ1 promotes pulmonary inflammation, apoptosis and mortality via TGFβR2 in the developing mouse lung[J]. Respir Res, 2015, 16: 4. |
| [2] | Bhandari V. Postnatal inflammation in the pathogenesis of bronchopulmonary dysplasia[J]. Birth Defects Res A Clin Mol Teratol, 2014, 100(3): 189-201. |
| [3] | Volonte D, Zou H, Bartholomew JN, et al. Oxidative stressinduced inhibition of Sirt1 by caveolin-1 promotes p53-dependent premature senescence and stimulates the secretion of interleukin 6 (IL-6)[J]. J Biol Chem, 2015, 290(7): 4202-4214. |
| [4] | Wang SJ, Zhao XH, Chen W, et al. Sirtuin 1 activation enhances the PGC-1α/mitochondrial antioxidant system pathway in status epilepticus[J]. Mol Med Rep, 2015, 11(1): 521-526. |
| [5] | Nogueiras R, Habegger KM, Chaudhary N, et al. Sirtuin 1 and sirtuin 3: physiological modulators of metabolism[J]. Physiol Rev, 2012, 92(3): 1479-1514. |
| [6] | Meng C, Liu JL, Du AL. Cardioprotective effect of resveratrol on atherogenic diet-fed rats[J]. Int J Clin Exp Pathol, 2014, 7(11): 7899-7906. |
| [7] | Sinclair DA, Guarente L. Small-molecule allosteric activators of sirtuins[J]. Annu Rev Pharmacol Toxicol, 2014, 54: 363-380. |
| [8] | Ruan Y, Dong C, Patel J, et al. SIRT1 suppresses doxorubicininduced cardiotoxicity by regulating the oxidative stress and p38MAPK pathways[J]. Cell Physiol Biochem, 2015, 35(3): 1116-1124. |
| [9] | Zhang L, Guo X, Xie W, et al. Resveratrol exerts an antiapoptotic effect on human bronchial epithelial cells undergoing cigarette smoke exposure[J]. Mol Med Rep, 2015, 11(3): 1752-1758. |
| [10] | Li J, Feng L, Xing Y, et al. Radioprotective and antioxidant effect of resveratrol in hippocampus by activating Sirt1[J]. Int J Mol Sci, 2014, 15(4): 5928-5939. |
| [11] | Nicoletti NF, Rodrigues-Junior V, Santos AA Jr, et al. Protective effects of resveratrol on hepatotoxicity induced by isoniazid and rifampicin via SIRT1 modulation[J]. J Nat Prod, 2014, 77(10): 2190-2195. |
| [12] | Yun JM, Chien A, Jialal I, et al. Resveratrol up-regulates SIRT1 and inhibits cellular oxidative stress in the diabetic milieu: mechanistic insights[J]. J Nutr Biochem, 2012, 23(7): 699-705. |
| [13] | 车忠丽, 董文斌, 李清平, 等. PKCβ/P66Shc 氧化应激通路 在高氧诱导人肺泡上皮细胞活性氧簇产生中的作用[J]. 中国 当代儿科杂志, 2015, 17(3): 275-280. |
| [14] | 张玲萍, 董文斌, 李清平, 等. p47phox 介导早产儿氧暴露后 体内活性氧簇产生的机制[J]. 中华实用儿科临床杂志, 2015, 30(2): 127-130. |
| [15] | 卢美燕, 董文斌. 氧化应激在高体积分数氧肺损伤中的作用[J]. 实用儿科临床杂志, 2012, 27(22): 1763-1765. |
| [16] | 张春艳, 董文斌, 李清平, 等. 白藜芦醇上调人肺泡上皮细 胞SIRT1 表达抑制高氧诱导的细胞凋亡[J]. 细胞与分子免疫 学杂志, 2015, 31(5): 590-595. |
| [17] | 车忠丽, 董文斌, 李清平, 等. PKCβ/p66Shc 氧化应激通路 介导高氧诱导人肺泡上皮细胞凋亡的作用[J]. 临床儿科杂 志, 2013, 31(11): 1066-1069. |
| [18] | Lau AW, Liu P, Inuzuka H, et al. SIRT1 phosphorylation by AMP-activated protein kinase regulates p53 acetylation[J]. Am J Cancer Res, 2014, 4(3): 245-255. |
| [19] | Iyer S, Han L, Bartell SM, et al. Sirtuin1 (Sirt1) promotes cortical bone formation by preventing β-catenin sequestration by FoxO transcription factors in osteoblast progenitors[J]. J Biol Chem, 2014, 289(35): 24069-24078. |
| [20] | Hori YS, Kuno A, Hosoda R, et al. Regulation of FOXOs and p53 by SIRT1 modulators under oxidative stress[J]. PLoS One, 2013, 8(9): e73875. |
| [21] | Kim YH, Hwang JH, Kim KS, et al. NAD(P)H: quinone oxidoreductase 1 activation reduces blood pressure through regulation of endothelial nitric oxide synthase acetylation in spontaneously hypertensive rats[J]. Am J Hypertens, 2015, 28(1): 50-57. |
| [22] | Tanno M, Sakamoto J, Miura T, et al. Nucleocytoplasmic shuttling of the NAD+-dependent histone deacetylase SIRT1[J]. J Biol Chem, 2007, 282(9): 6823-6832. |
| [23] | Morris KC, Lin HW, Thompson JW, et al. Pathways for ischemic cytoprotection: role of sirtuins in caloric restriction, resveratrol, and ischemic preconditioning[J]. J Cereb Blood Flow Metab, 2011, 31(4): 1003-1019. |
| [24] | Verdin E, Dequiedt F, Kasler HG. Class II histone deacetylases: versatile regulators[J]. Trends Genet, 2003, 19(5): 286-293. |
 2016, Vol. 18
2016, Vol. 18