2. 重庆市妇幼保健院新生儿科, 重庆 400013
新生儿缺氧缺血性脑病(hypoxia-ischemic encephalopathy, HIE)是围生期新生儿常见的中枢神经系统疾病,可以导致严重的神经系统后遗症。但其发病机制尚未完全阐明。Janus激酶-信号转导与转录激活因子(janus kinase-signal transducer and activator of transcription, JAK-STAT)途径是近年来新发现的一条信号转导途径,该途径可能与脑缺血[1, 2, 3, 4]、神经炎症[5]等中枢神经系统疾病相关。STAT3 是 STATs 家族的重要成员,能参与信号转导和结合相应DNA位点。当细胞因子与相应的受体结合后,JAKs募集胞浆内的STAT3,使STAT3发生磷酸化而活化。活化的 STAT3 形成同源或异源二聚体转位到细胞核内,与其特异DNA反应元件结合,启动下游靶基因的转录[6]。研究表明成年鼠脑缺血损伤后,STAT3 的活化形式磷酸化STAT3 (phosphorylated STAT3, p-STAT3)在脑组织中的表达会升高,但p-STAT3在神经细胞上的定位存在差异,一些报道认为 p-STAT3 主要在神经元中表达[1, 2],而另一些研究则认为 p-STAT3 在反应性星形胶质细胞、小胶质细胞中表达[7]。另外,缺血性脑损伤时 STAT3 活化的作用也存在争议,有研究发现 STAT3 活化可以上调抗凋亡蛋白 Bcl-2、Bcl-xl 并下调促凋亡蛋白Bax表达,从而发挥神经保护作用[1, 2, 3],另有研究认为 STAT3 的过量活化会导致神经细胞凋亡[4]。不同研究中 p-STAT3 开始出现及达到高峰的时间也不尽相同。上述关于STAT3的研究大都集中在成年鼠脑缺血模型中,而对于STAT3 信号通路在新生鼠脑缺氧缺血性(hypoxia-ischemia, HI)损伤中所起作用报道较少。
血管内皮生长因子(vascular endothelial growth factor, VEGF)是 STAT3 重要的下游效应分子。VEGF 不仅能促进新生血管生成和血管重塑,还是一种重要的神经营养和保护因子[8, 9],其对中枢神经系统的保护作用已成为研究的热点。尽管有报道称 VEGF 在鼠脑局部脑缺血后表达上调[10],但是尚不清楚这种变化是否与 STAT3的活化及神经细胞凋亡相关。
本研究意在阐明 STAT3 在新生鼠缺氧缺血性脑损伤(hypoxic-ischemic brain damage, HIBD)中的作用及其与 VEGF 表达、神经细胞凋亡的关系。
1 材料与方法 1.1 主要试剂及仪器山羊血清、SP 免疫组化试剂盒(北京中杉金桥生物公司);兔抗 STAT3 抗体、兔抗 p-STAT3抗体(Cell Signaling 公司,美国);兔抗 VEGF 抗体、小鼠抗β-actin抗体及辣根过氧化物酶标记的抗兔及抗鼠 IgG 抗体(Santa Cruz 公司,美国); TUNEL 细胞凋亡原位检测试剂盒(Roche 公司,美国);酪氨酸磷酸酶抑制剂 Cocktail Ⅱ(Sigma 公司,美国);BCA 蛋白定量检测试剂盒、牛血清白蛋白(北京百泰克公司);ECL 底物化学发光试剂(Pierce 公司,美国)。图像采集系统、 CX31 显微镜(Olympus 公司,日本);ImagePro Plus 4.5 图像分析软件(Media Cybernetics 公司,美国)。
1.2 实验动物分组与模型建立7日龄Sprague-Dawley(SD)大鼠共80只(购于华西实验动物中心),雌雄不限,体重11~18 g,随机分为假手术组和HI组,每组40只。
采用Rice-Vannucci法制备HIBD模型[11],两组大鼠经乙醚麻醉后取仰卧位固定,颈正中切口,HI组分离并结扎右侧颈总动脉,缝合切口。术后恢复1 h,再将大鼠放入缺氧舱中,充以氮氧混合气(92% N2、8% O2)2.5 h,之后取出置于母鼠笼中。假手术组仅予以分离右侧颈总动脉,不予结扎及缺氧处理,其余处理同HI组。
1.3 标本采集每组按HI后4、6、8、12和24 h 5个时间点取材,每个时间点每组各取8只,然后平均分为两部分,一部分(n=4)于心脏内灌注20 mL生理盐水,4%多聚甲醛内固定20 min,开颅将脑完整取出,分离右侧脑组织,用于苏木精-伊红(HE)染色、免疫组化及TUNEL染色;另一部分(n=4)同上法开颅取脑,在冰袋上分离右侧脑组织,置于液氮中备用于Western blot检测。
1.4 HE染色在海马层面取材,切片(5 μm)经常规脱蜡水化后,苏木素染色5 min,盐酸酒精分化,自来水冲洗,伊红染色2 min。脱水、透明、封片。
1.5 免疫组织化学法检测 STAT3、p-STAT3 及 VEGF 蛋白表达实验步骤按试剂盒说明进行。一抗滴度为1 : 100(STAT3)、1 : 75(p-STAT3)和 1 : 200 (VEGF)。PBS 代替一抗做阴性对照。在海马层面取材,每个脑组织标本共选取6张切片(5 μm),光镜下每张切片随机选取5个视野(×400)采集图像,应用 Image Pro Plus 4.5 图像分析软件测定蛋白阳性表达的积分光密度(IOD)值。
1.6 Western blot 检测蛋白表达取冻存脑组织标本50 mg放入细胞裂解液中,匀浆,冰上放置30 min后于4℃、14 000 r/min 离心30 min,收集上清总蛋白。恒压110 V电泳1 h,凝胶转移至固相支持物,膜封闭,ECL显色,凝胶成像仪成像并检测其 IOD 值。目的蛋白条带和内参 β-actin 条带的 IOD 比值表示目的蛋白相对表达量。
1.7 TUNEL染色按 TUNEL试剂盒操作步骤进行。在海马层面取材,石蜡切片(5 μm)常规脱蜡水化,置于pH 6.0 的柠檬酸缓冲液中,加热30 min,封闭10 min,漂洗后加脱氧核糖核苷酸末端转移酶反应液,37℃ 避光孵育60 min,漂洗后加 Streptavidin-HRP 工作液,37℃避光孵育30 min,DAB显色,阳性细胞显色为棕黄色。每个脑组织标本共选取6张切片,光镜下每张切片随机选5个视野(×400)采集图像,计算凋亡指数(凋亡指数=凋亡阳性细胞数/总细胞数×100%)。
1.8 统计学分析采用SPSS 12.0统计软件包对数据进行统计学分析。计量资料采用均数±标准差(x ± s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,组间两两比较采用LSD-t检验,P<0.05 为差异有统计学意义。
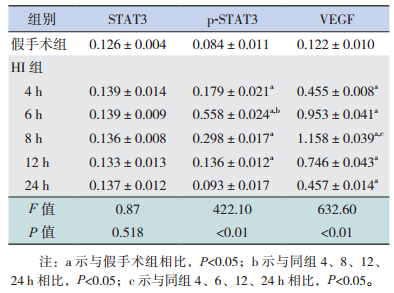
2 结果 2.1 两组新生大鼠神经细胞病理改变HI 组不同时间点皮层和海马有不同程度细胞肿胀、细胞间隙增宽、细胞排列紊乱、神经元变性、核固缩,HI 后 24 h 细胞缺失明显;假手术组皮层和海马区细胞排列有序,形态正常。见图 1。
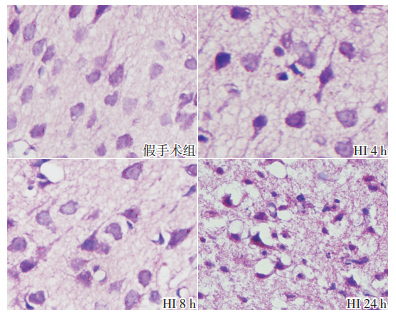 |
图 1 两组新生大鼠各时间点神经细胞病理学改变(HE染色,×400) 假手术组皮层细胞排列有序,形态正常; HI组不同时间点皮层细胞肿胀、细胞间隙增宽、细胞排列紊乱、神经元变性、核固缩,24 h细胞缺失明显。 |
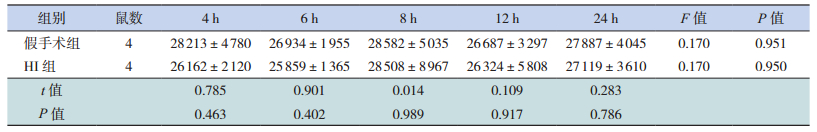
STAT3 主要分布于皮质和海马区等部位,定位于胞浆及胞核。HI组各时间点STAT3表达水平比较差异无统计学意义(P>0.05);HI组与假手术组比较,各时间点STAT3表达水平差异无统计学意义(P>0.05)。见图 2,表 1。
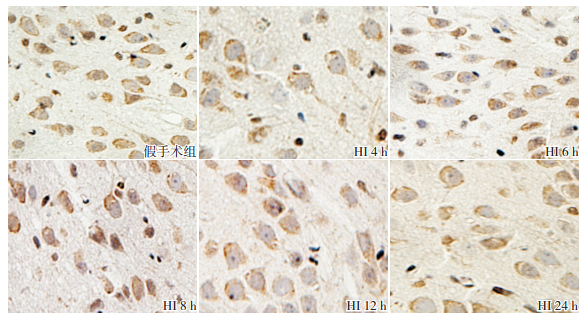 |
图 2 两组新生大鼠各时间点STAT3蛋白的表达(免疫组化,×400) 假手术组皮质胞浆及胞核均可见STAT3蛋白表达;HI组各时间点皮质胞浆及胞核STAT3蛋白表达水平与假手术组比较无明显差异。STAT3阳性表达呈棕黄色。 |
| 表 1 两组新生大鼠STAT3蛋白表达水平比较(x ± s) |
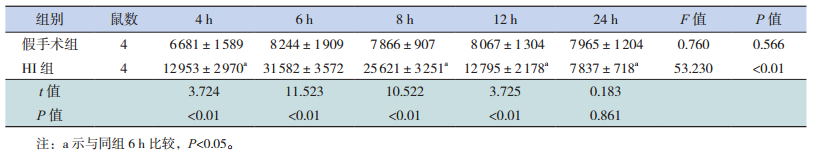
p-STAT3 分布区域和定位与STAT3蛋白一致。和假手术组相比,HI组大鼠HI后4 h p-STAT3蛋白表达增加,6 h 达高峰,8 h 开始降低,但仍然维持在较高水平(P<0.05),24 h 降至最低,与假手术组比较差异无统计学意义(P>0.05)。见图 3,表 2。
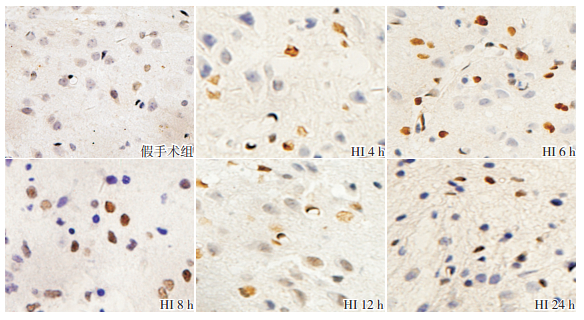 |
图 3 两组新生大鼠各时间点p-STAT3蛋白的表达(免疫组化,×400) 假手术组皮质胞浆及胞核偶见 p-STAT3 蛋白表达;HI组各时间点皮质胞浆及胞核p-STAT3蛋白表达较假手术组显著增加,6 h时表达水平达高峰。p-STAT3阳性表达呈棕黄色。 |
| 表 2 16例患儿MMACHC基因突变检测结果分析(x ± s) |
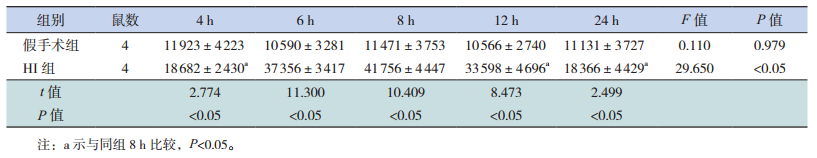
VEGF主要分布于皮质和海马区等部位,定位于胞浆。和假手术组相比,HI组大鼠HI后4 h VEGF蛋白表达增加,8 h达高峰,12 h开始降低,24 h 降至最低(P<0.05)。见图 4,表 3。
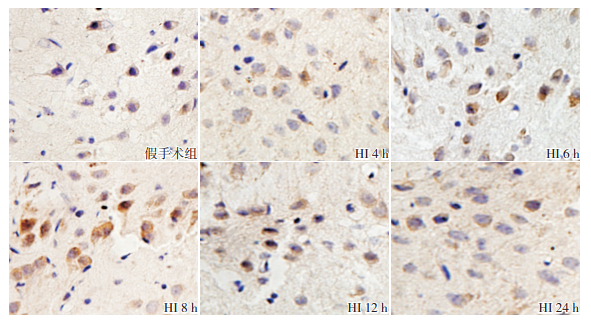 |
图 4 两组新生大鼠各时间点VEGF蛋白的表达(免疫组化,×400) 假手术组皮质胞浆偶见VEGF蛋白表达;HI组各时间点皮质胞浆VEGF蛋白表达较假手术组显著增加,8 h时表达水平达高峰。VEGF阳性表达呈棕黄色。 |
| 表 3 两组新生大鼠VEGF蛋白表达水平比较(x ± s) |
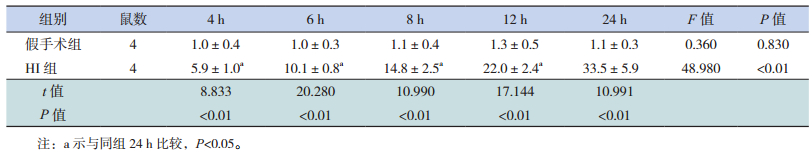
HI组各时间点凋亡细胞指数均高于假手术组,且随时间延长逐渐增加,24 h时细胞凋亡指数最高(P<0.01),假手术组各时间点有少量细胞凋亡,见图 5,表 4。
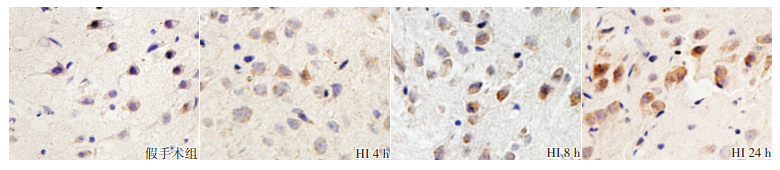 |
图 5 两组新生大鼠细胞凋亡情况(TUNEL染色,×400) 假手术组偶见TUNEL阳性细胞表达;HI组各时间点神经细胞胞核TUNEL阳性表达较假手术组显著增加,24 h时表达水平最高。TUNEL阳性表达呈棕黄色。 |
| 表 4 两组新生大鼠细胞凋亡指数比较(x ± s) |
与假手术组相比,HI后各时间点STAT3蛋白表达差异无统计学意义(P>0.05)。p-STAT3 蛋白表达于HI后4 h开始升高,6 h达高峰,8 h以后逐渐降低,除24 h外,HI组各时间点p-STAT3表达均高于假手术组(P<0.05)。VEGF 蛋白表达于HI后4 h明显增加,8 h达高峰,24 h明显降低,变化趋势与免疫组化结果相似。HI后各时间点VEGF表达均高于假手术组(P<0.05)。见图 6,表 5。
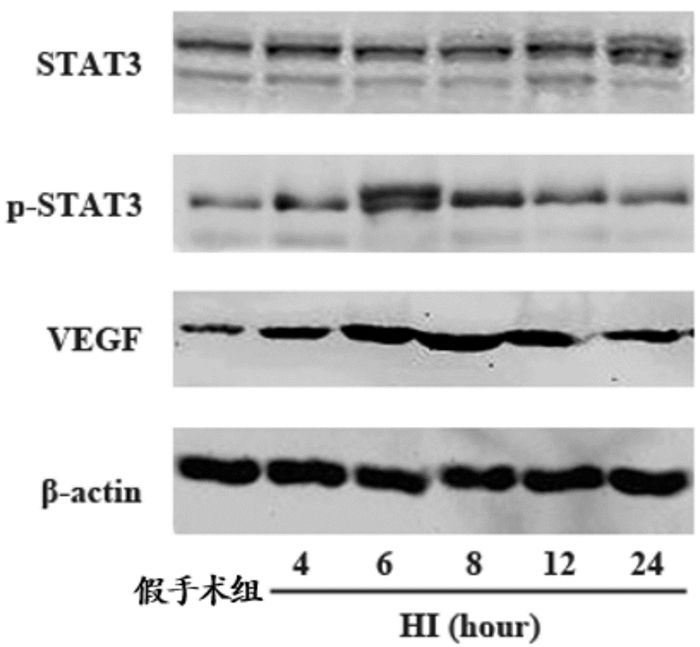 |
图 6 Western blot 检测两组新生大鼠STAT3、p-STAT3及VEGF蛋白表达 1为假手术组;2~6分别为HI组HI后4、6、8、12及24 h。 |
| 表 5 Western blot 检测两组新生大鼠各蛋白相对表达水平(n=4,x ± s) |
JAK-STAT信号通路是近年来新发现的一条细胞内信号转导途径[2, 12]。在JAK-STAT通路众多分子中,STAT3与神经系统发育和分化密切相关。有研究发现,以成年小鼠脑卒中为研究模型,利用IL-6受体单克隆抗体阻断 IL-6 信号转导后,小鼠大脑皮层缺血半暗带p-STAT3蛋白表达显著减少,梗塞区域凋亡神经细胞明显增多,提示STAT3活化可能具有神经保护作用,从而阻止细胞凋亡[13]。然而,新生鼠脑HI后STAT3是否活化,以及是否参与损伤神经细胞修复,目前研究甚少。
在本研究中,发现假手术组和HI组STAT3阳性细胞在皮质和海马广泛分布,与既往研究一致[1, 2];且在假手术组新生大鼠脑组织中p-STAT3蛋白表达水平极低,表明STAT3蛋白主要是以非磷酸化的形式存在于正常新生鼠脑组织中。在HI后4 h p-STAT3蛋白表达增加,6 h达高峰,8 h后降低,p-STAT3阳性细胞主要位于皮质深部及海马,胞质和胞核均有表达,但以胞核表达为主。而STAT3在HI后各时间点表达无差异,提示在HIBD模型中,HI可以诱导STAT3 磷酸化从而激活。Suzuki等[14]建立成年大鼠大脑中动脉栓塞模型,检测其局灶性脑缺血再灌注损伤后p-STAT3蛋白在脑组织中表达的变化,发现大脑皮质局部缺血再灌注3.5 h后,皮层及纹状体神经元p-STAT3表达水平开始升高,再灌注损伤24 h后p-STAT3蛋白在缺血半暗带区显著增多并达高峰,此后,p-STAT3随着再灌注时间延长表达逐渐减少。其p-STAT3表达趋势与本研究相似,即先升高后降低,但上述研究中p-STAT3表达高峰时间晚于本研究所观察到的时间,这可能与动物年龄及模型不同有关。
作为STAT3重要的下游效应分子之一[15], VEGF已被证实可促进缺血区血管再生、结合受体发挥抗凋亡效应、诱导神经干细胞增殖分化成熟[9, 16]。那么在HI后,STAT3活化是否诱导VEGF的表达呢?本研究结果显示,HI后4 h VEGF表达增加,8 h达高峰,之后降低,但假手术组只有少量VEGF表达。以上结果提示新生鼠脑组织发生HI改变后会出现VEGF的表达上调。而另一个值得关注的问题是,HI后p-STAT3表达也呈先升高后降低的趋势,但表达高峰早于VEGF。根据p-STAT3与VEGF表达高峰出现的先后及表达趋势的一致性推断:新生鼠脑HI后,活化的STAT3可能参与了其下游VEGF的表达调控。
本研究凋亡检测发现,凋亡细胞数随HI时间的延长逐渐增加,VEGF的表达变化趋势与凋亡趋势相反,即VEGF表达高时,凋亡程度轻,VEGF下降时,凋亡增加。这可能是由于p-STAT3 蛋白逐渐减少,受其调控的VEGF表达也相应降低,对神经有保护作用的因子下调,导致损伤加重,凋亡细胞增多[3, 17]。其他信号通路,如HIF-1α/caspase-3在新生鼠脑HI中的作用研究也提示上游神经保护因子HIF-1α的表达呈先增加后降低的趋势,而神经细胞的凋亡呈逐渐增加趋势[18],与本实验结果类似。因此,推测新生大鼠HIBD时,VEGF表达增加对神经细胞具有保护作用。
综上,HI可激活新生大鼠脑组织STAT信号通路,诱导STAT3磷酸化,调节其下游VEGF蛋白表达,推测STAT3通路激活可能参与了神经细胞的凋亡调节,与神经细胞的凋亡抑制相关。
| [1] | 谢欣梅, 庞晓斌, 赵艳, 等. 消栓通络有效成分组对氧糖剥夺 损伤原代培养神经元的保护作用[J]. 药学学报, 2014, 49(8): 1130-1135. |
| [2] | Zhou H, Zhang Z, Wei H, et al. Activation of STAT3 is involved in neuroprotection by electroacupuncture pretreatment via cannabinoid CB1 receptors in rats[J]. Brain Res, 2013, 1529: 154-164. |
| [3] | Lin Y, Cai B, Xue XH, et al. TAT-mediated delivery of neuroglobin attenuates apoptosis induced by oxygen-glucose deprivation via the Jak2/Stat3 pathway in vitro[J]. Neurol Res, 2015, 37(6): 531-538. |
| [4] | Liu R, Xu N, Yi W, et al. Electroacupuncture effects on cortical neurons, as well as Janus kinase 2-signal transducer and activator of transcription 3 signal transduction pathway, in a rat model of cerebral ischemia[J]. Neural Regen Res, 2012, 7(6): 457-462. |
| [5] | Meares GP, Liu Y, Rajbhandari R, et al. PERK-dependent activation of JAK1 and STAT3 contributes to endoplasmic reticulum stress-induced inflammation[J]. Mol Cell Biol, 2014, 34(20): 3911-3925. |
| [6] | Cai B, Cai JP, Luo YL, et al. The specific roles of JAK/STAT signaling pathway in sepsis[J]. Inflammation, 2015, 38(4): 1599-1608. |
| [7] | Hong S, Song MR. STAT3 but not STAT1 is required for astrocyte differentiation[J]. PLoS One, 2014, 9(1): e86851. |
| [8] | Song S, Park JT, Na JY, et al. Early expressions of hypoxiainducible factor 1alpha and vascular endothelial growth factor increase the neuronal plasticity of activated endogenous neural stem cells after focal cerebral ischemia[J]. Neural Regen Res, 2014, 9(9): 912-918. |
| [9] | Gao L, Zhou S, Cai H, et al. VEGF levels in CSF and serum in mild ALS patients[J]. J Neurol Sci, 2014, 346(1-2): 216-220. |
| [10] | Li L, Qu Y, Mao M, et al. The involvement of phosphoinositid 3-kinase/Akt pathway in the activation of hypoxia-inducible factor-1alpha in the developing rat brain after hypoxiaischemia[ J]. Brain Res, 2008, 1197: 152-158. |
| [11] | Rice JE 3rd, Vannucci RC, Brierley JB. The influence of immaturity on hypoxic-ischemic brain damage in the rat[J]. Ann Neurol, 1981, 9(2): 131-141. |
| [12] | Villarino AV, Kanno Y, Ferdinand JR, et al. Mechanisms of Jak/ STAT signaling in immunity and disease[J]. J Immunol, 2015, 194(1): 21-27. |
| [13] | Yamashita T, Sawamoto K, Suzuki S, et al. Blockade of interleukin-6 signaling aggravates ischemic cerebral damage in mice: possible involvement of STAT3 activation in the protection of neurons[J]. J Neurochem, 2005, 94(2): 459-468. |
| [14] | Suzuki S, Tanska K, Nogawa S, et al. Phosphorylation of signal transducer and activator of transcription-3 (STAT3) after focal cerebral ischemia in rats[J]. Exp Neurol, 2001, 170(1): 63-71. |
| [15] | Kamran MZ, Patil P, Gude RP. Role of STAT3 in cancer metastasis and translational advances[J]. Biomed Res Int, 2013, 2013: Article ID 421821, 15 pages. |
| [16] | Rosenstein JM, Krum JM, Ruhrberg C. VEGF in the nervous system[J]. Organogenesis, 2010, 6(2):107-114. |
| [17] | Zhou TF, Yu JG. Recombinant human erythropoietin attenuates neuronal apoptosis and cognitive defects via JAK2/STAT3 signaling in experimental endotoxemia[J]. J Surg Res, 2013, 183(1): 304-312. |
| [18] | 李丽华, 屈艺, 张莉, 等. HIF-lα 表达在新生大鼠缺氧/ 缺 氧缺血性脑损伤神经元凋亡中的作用[J]. 四川大学学报( 医 学版), 2008, 39(6): 912-915. |
 2016, Vol. 18
2016, Vol. 18