2. 第四军医大学西京医院 儿科脑发育研究室, 陕西 西安 710032
惊厥是新生儿期常见的神经系统症状。据报道足月新生儿惊厥发生率为1‰~3‰,早产儿则更高[1]。越来越多的实验研究提示新生期频繁的惊厥发作可通过干扰脑的发育进程而导致神经网络结构和功能的异常改变[2, 3],使患儿以后患癫癎、脑瘫、智力低下的风险增高[4]。即使是单次惊厥,也有可能引起脑内谷氨酸能突触传递的持久性改变[5]。因此,对新生儿惊厥应给以积极有效的治疗。然而,传统的抗惊厥药如苯巴比妥(phenobarbital, PB)、地西泮、苯妥英等均有潜在的神经毒性[6],尤以PB对发育脑造成的远期认知障碍最受关注,许多动物研究均显示生后早期PB暴露可能造成持久的神经系统功能损害[7, 8]。因此,如何权衡惊厥后果和药物伤害是新生儿科医生面临的重大挑战,而探索一种对发育脑具有保护作用的抗惊厥药将为新生儿惊厥的救治提供一个理想的选择。
琥珀是传统的镇惊安神类中药,自古以来被用于治疗惊厥。现代研究发现琥珀的主要成分琥珀酸(succinic acid, SA)具有良好的抗惊厥作用。来自小鼠、大鼠、兔和狗等多种动物的实验研究表明腹腔注射10~12 mM SA可对抗多种方式造成的动物惊厥[9]。SA的化学结构与脑内重要的抑制性神经递质γ氨基丁酸(GABA)相似,许多研究显示SA的主要药理作用是中枢抑制[10];然而,另有研究证实SA具有强烈的中枢兴奋作用[9],这些研究提示SA的中枢作用可能是双向的。因为SA位于三羧酸循环和脑内特有的谷氨酸-GABA-SA代谢旁路的枢纽地位,不仅在脑的能量代谢上具有特殊地位,而且可能对于兴奋性突触传递和抑制性突触传递均有调节作用,有利于维持脑内兴奋-抑制的平衡,从而减轻病理状态下神经元的损伤[11]。但是,SA对发育中的脑有无保护作用尚不清楚。
本课题组以前的研究发现单次大剂量PB即可增强惊厥幼鼠小脑主神经元浦肯野细胞(purkinje cell, PC)的高兴奋性,并加剧惊厥幼鼠PC长时程抑制(long term depression, LTD)的表达异常[12],本研究在此基础上,进一步研究了单次给予SA对惊厥幼鼠PC电活动的近期和远期影响,并与单次大剂量和小剂量PB的作用对比,为SA安全用于新生儿惊厥的临床治疗提供实验依据。
1 材料与方法 1.1 主要材料与试剂葡萄糖酸钾、HEPES、EGTA、磷酸肌酸二钠、Na2ATP、Na3GTP、KOH,NaCl、KCl、NaH2PO4 · H2O、MgSO4 ·7H2O、CaCl2 ·2H2O、NaHCO3、葡萄糖、戊四氮及SA均购自Sigma公司;PB由第四军医大学西京医院提供。
电极内液成分:葡萄糖酸钾120.0 mmoL/L,KCl 5.0 mmoL/L,HEPES 10.0 mmoL/L,EGTA 5.0 mmoL/L,CaCl2 ·2H2O 0.5 mmoL/L,MgSO4 ·7H2O 2.0 mmoL/L,磷酸肌酸二钠2.0 mmoL/L,Na2ATP 4.0 mmoL/L,Na3GTP 0.3 mmoL/L,调pH为7.35~7.45,渗透压为280~290 mOsm/L。人工脑脊液(artificial cerebrospinal fluid, ACSF)成分:NaCl 126.0 mmol/L,KCl 5.0 mmol/L,NaH2PO4 ·H2O 1.25 mmol/L,MgSO4 ·7H2O 2.0 mmol/L,CaCl2 ·2H2O 2.0 mmol/L,NaHCO3 26.0 mmol/L,葡萄糖10.0 mmol/L,调pH为7.35~7.45,渗透压为300~310 mOsm/L。
渗透压测定仪(Model 210, FISKE ASSOCIATE, USA),振动切片机(VT1000S, LEICA, USA),恒流泵(HL-2,上海泸西仪器厂),正置显微镜(Ziss, Axopatch, Germen),放大器(Axon 700A, Axon Instrument, USA),微电极操纵仪(Model 285, Sutter Instrument, USA),电极拉制仪(P-97, Sutter Instrument, USA),模拟-数字转换器(Digidata1322A, Axon Instruments, USA),刺激器(PG4000A, CYGNUS, USA)。
1.2 惊厥动物模型的制备及药物剂量的选择第四军医大学动物实验中心为本研究提供健康新生7 d(P7)的Sprague-Dawley(SD)幼鼠。实验操作及内容符合西京医院实验动物保护和使用委员会的规定。给予P7 SD幼鼠腹腔注射60 mg/kg戊四氮[13, 14],放于空地,观察30 min,依据Racine分级标准,0级:无发作;Ⅰ级:仅口面部轻度阵挛;Ⅱ级:Ⅰ级基础上出现节律性点头;Ⅲ级:Ⅱ级基础上出现前肢阵挛;Ⅳ级:Ⅲ级基础上出现后肢的阵挛;Ⅴ级:全身强直性抽搐[15]。选择V级视为惊厥全面发作,作为惊厥模型。临床上PB治疗新生儿惊厥的负荷量和维持剂量分别是20 mg/kg、5 mg/kg[16],依据人与大鼠体表面积换算公式计算[17],本实验给予惊厥幼鼠PB的大剂量为120 mg/kg(相当于PB临床负荷量),小剂量为30 mg/kg(相当于PB临床维持量)。参照SA抗惊厥的相关研究文献[11],本实验给予惊厥幼鼠SA的大剂量为120 mg/kg,小剂量为30 mg/kg。
1.3 动物分组将SD幼鼠分为新生期幼鼠组和发育期幼鼠组。新生期幼鼠组幼鼠于生后7 d腹腔注射药物后30 min处死取小脑;发育期幼鼠组幼鼠于生后7 d腹腔注射药物后送回母鼠笼内,饲养至30 d再处死取小脑。新生期幼鼠组分为以下6组:正常对照组(不制作惊厥模型,腹腔注射与PB等容积的生理盐水),惊厥模型组(腹腔注射与PB等容积的戊四氮),小剂量PB组(制作惊厥模型,腹腔注射30 mg/kg PB),大剂量PB组(制作惊厥模型,腹腔注射120 mg/kg PB),小剂量SA组(制作惊厥模型,腹腔注射30 mg/kg SA),大剂量SA组(制作惊厥模型,腹腔注射120 mg/kg SA)。发育期幼鼠组分组及处理方法同上。PB和SA均在SD幼鼠惊厥全面发作后一次性腹腔注射给药,每组动物均为10只。
1.4 脑片制备取SD幼鼠小脑后迅速投入充以饱和95%O2+5%CO2混合气体的ACSF冰水中约1 min取出,修整后固定于切片槽内,用振动切片机切出厚约300~400 μm的脑片,置于32℃的ACSF中孵育30 min,再于室温下孵育30 min后开始记录。整个过程通以95%O2+5%CO2混合气体。
1.5 全细胞膜片钳记录将脑片移至记录浴槽内,先在低倍镜下找到小脑皮层的细胞层,再在高倍镜下选择表面光滑、立体感强的PC。玻璃电极内充灌内液后电阻为5~8 MΩ,当电极尖端靠近PC时,给予合适的负压,形成1 GΩ以上高阻抗封接,继续施加负压或用1.5 V、5~20 ms的短时脉冲击破细胞膜,形成PC全细胞记录。在电流钳模式下,向细胞内注射去极化电流(50~900 pA, 150 ms),诱发并记录PC动作电位(action potential, AP)。在电压钳模式下,用充有ACSF的玻璃微电极刺激小脑分子层的平行纤维(PF),可在PC上记录到兴奋性突触后电流(excitatory postsynaptic current, EPSC),以1串300个脉冲组成的频率为1 Hz的低频刺激(low frequency stimulation, LFS)诱发PF-PC突触传递的LTD现象。整个记录过程持续用恒流泵以2 mL/min的速度向浴槽内灌注充以95%O2+5%CO2混合气体的ACSF。
1.6 统计学分析采用SPSS 17.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x ± s)表示,多组间比较应用单因素方差分析,组间两两比较应用SNK-q检验,P<0.05为差异有统计学意义。
2 结果 2.1 琥珀酸对新生期惊厥幼鼠小脑PC兴奋性的影响在小脑脑片上,细胞内给予去极化电流可诱发PC产生AP。各组AP阈刺激比较差异有统计学意义(F=83.58,P<0.01)。在正常对照组,诱发PC产生AP的阈刺激为173±13 pA,惊厥模型组的阈刺激为165±11 pA,与正常对照组相比差异无统计学意义(P>0.05)。小剂量PB组和大剂量PB组诱发AP的阈刺激分别为160±13 pA和114±14 pA,与惊厥模型组和正常对照组相比,小剂量PB组差异无统计学意义(P>0.05),但大剂量PB组PC的阈刺激明显降低(P<0.01)。小剂量SA组和大剂量SA组PC的阈刺激分别为167±10 pA和169±12 pA,与惊厥模型组和正常对照组相比差异均无统计学意义(P>0.05),见图 1A。
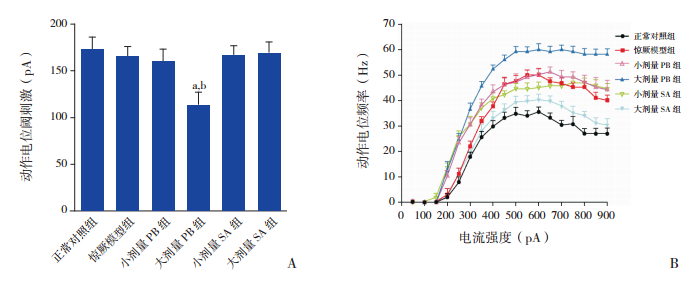 |
图 1 琥珀酸对新生期惊厥幼鼠小脑PC兴奋性的影响 A:刺激各组PC产生动作电位的阈值比较(n=10)。B:不同电流强度刺激各组PC产生动作电位的频率比较(n=10)。a示与正常对照组比较,P<0.01;b示与惊厥模型组比较,P<0.01。 |
诱发惊厥模型组AP的阈刺激与正常对照组相比虽然无明显变化,但不同刺激强度(50~900 pA)诱发的AP频率在惊厥模型组却显著增高(P<0.05)。小剂量PB组AP的频率也高于正常对照组(P<0.05),与惊厥模型组相近(P>0.05);而大剂量PB组AP的频率较惊厥模型组更高(P<0.05)。小剂量SA组AP频率与惊厥模型组相近(P>0.05),高于正常对照组(P<0.05);大剂量SA组AP的频率显著低于惊厥模型组(P<0.05),接近正常对照组(P>0.05)。见图 1B。
以上结果表明:新生期惊厥幼鼠小脑PC兴奋性增高,小剂量PB和小剂量SA对惊厥幼鼠PC兴奋性无明显影响,大剂量PB可使其兴奋性进一步增高,而大剂量SA可显著降低惊厥幼鼠PC的兴奋性。
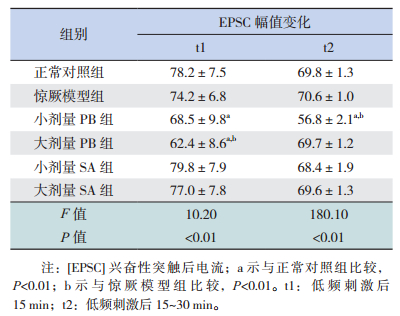
2.2 琥珀酸对新生期惊厥幼鼠小脑PF-PC LTD的影响在新生期惊厥幼鼠各组小脑脑片上,LFS均可诱发出PF-PC EPSC的LTD。正常对照组EPSC幅值在LFS后15 min内降至72.5%,LFS后15~30 min内降至68.8%。LFS后的15 min内,惊厥模型组 EPSC幅值的抑制程度大于正常对照组,但差异无统计学意义(P>0.05);LFS后的15~30 min,惊厥模型组EPSC幅值的抑制程度与正常对照组相似(P>0.05)。小剂量PB组在LFS后EPSC幅值抑制程度显著大于惊厥模型组(P<0.01)和正常对照组(P<0.01);大剂量PB组EPSC幅值抑制程度在LFS后15 min内显著大于惊厥模型组(P<0.01)和正常对照组(P<0.01),但在LFS后的15~30 min接近正常对照组(P>0.05)。小剂量SA组和大剂量SA组EPSC幅值的抑制程度均接近正常对照组(P>0.05)。见图 2,表 1。
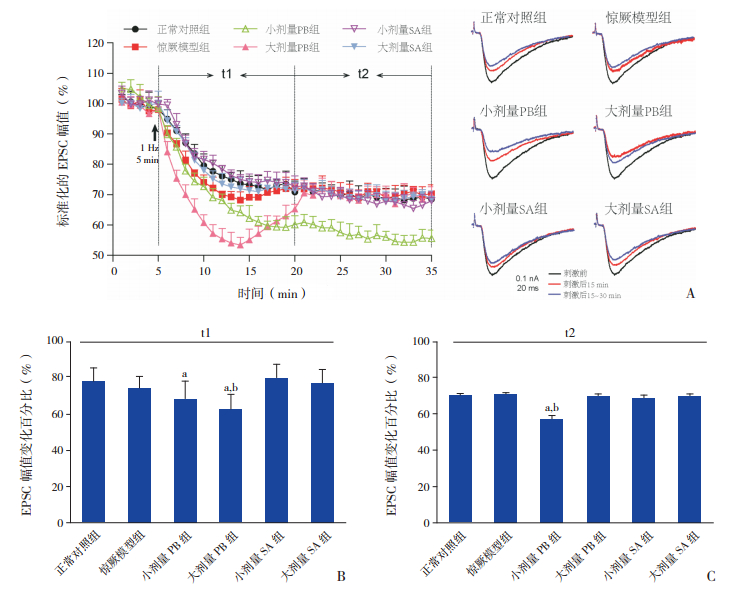 |
图 2 琥珀酸对新生期惊厥幼鼠小脑PC长时程抑制的影响 A:(左):低频刺激(1 Hz,5 min)各组平行纤维(PF)诱发的PC兴奋性突触后电流(EPSC)的长时程抑制比较(n=10),t1:刺激后15 min;t2:刺激后15~30 min。(右):各组典型的PC EPSC在刺激前(黑色)、刺激后15 min(红色)和刺激后15~30 min(蓝色)的幅值变化。B:低频刺激后15 min内各组EPSC幅值变化的比较(n=10)。C:低频刺激后15~30 min各组EPSC幅值变化的比较(n=10)。a示与正常对照组比较,P<0.01;b示与惊厥模型组比较,P<0.01。 |
| 表 1 琥珀酸对新生期惊厥幼鼠小脑PC长时程抑制的影响 |
以上结果表明新生期惊厥幼鼠小脑PF-PC LTD的表达模式发生了轻微的变化,小剂量PB和大剂量PB均加剧了新生期惊厥幼鼠LTD表达模式的变化,而小剂量SA和大剂量SA均可使新生期惊厥幼鼠LTD的表达模式恢复正常。
2.3 琥珀酸对发育期惊厥幼鼠小脑PC兴奋性的影响各组AP阈刺激比较差异有统计学意义(F=111.62,P<0.01)。在正常对照组,诱发PC产生AP的阈刺激为141±13 pA,惊厥模型组的阈刺激为95±8 pA,与正常对照组相比明显降低(P<0.01)。小剂量PB组和大剂量PB组诱发AP的阈刺激分别为106±12 pA和91±11 pA,与惊厥模型组相比差异均无统计学意义(P>0.05),但均低于正常对照组(P<0.01)。小剂量SA组和大剂量SA组PC的阈刺激分别为130±9 pA和132±12 pA,与惊厥模型组相比均明显增高(P<0.01),与正常对照组相比差异均无统计学意义(P>0.05),见图 3A。
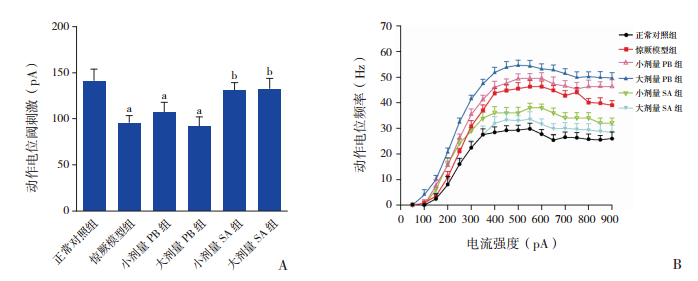 |
图 3 琥珀酸对发育期惊厥幼鼠小脑PC兴奋性的影响 A:刺激各组PC产生动作电位的阈值比较(n=10)。B:不同电流强度刺激各组PC产生动作电位的频率比较(n=10)。a示与正常对照组比较,P<0.01;b示与惊厥模型组比较,P<0.01。 |
与正常对照组相比,惊厥模型组在不同刺激强度(50~900 pA)下诱发的AP频率亦明显增高(P<0.05)。小剂量PB组AP频率比大剂量PB组略低,但差异无统计学意义(P>0.05),均高于正常对照组(P<0.05),与惊厥模型组相近(P>0.05)。小剂量SA组AP频率略低于惊厥模型组,略高于正常对照组,但差异均无统计学意义(P>0.05)。大剂量SA组AP频率显著低于惊厥模型组(P<0.05),接近正常对照组(P>0.05)。见图 3B。
以上结果表明:惊厥幼鼠发育期小脑PC兴奋性增高,小剂量PB和大剂量PB对惊厥幼鼠发育期小脑PC的高兴奋性无显著性影响,而小剂量SA和大剂量SA可显著降低惊厥幼鼠PC的兴奋性,大剂量SA的作用更明显。
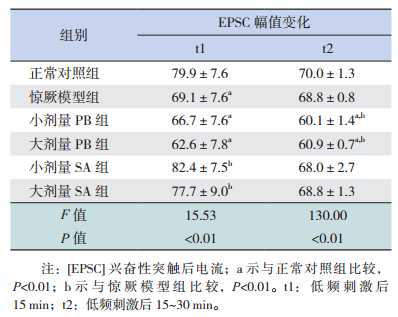
2.4 琥珀酸对惊厥幼鼠发育期小脑PF-PC LTD的影响在各组发育期惊厥幼鼠小脑脑片上,LFS均可诱发出PF-PC EPSC的LTD。正常对照组EPSC幅值在LFS后15 min内降至73.7%,LFS后15~30 min内降至69.0%。LFS后的15 min内,惊厥模型组EPSC幅值的抑制程度明显大于正常对照组(P<0.01),LFS后的15~30 min,惊厥模型组EPSC幅值的抑制程度与正常对照组相近(P>0.05);小剂量PB组和大剂量PB组在LFS后15~30 min,EPSC幅值抑制程度均显著大于惊厥模型组(P<0.01)和正常对照组(P<0.01);小剂量SA组和大剂量SA组EPSC幅值的抑制程度接近正常对照组(P>0.05)。见图 4,表 2。
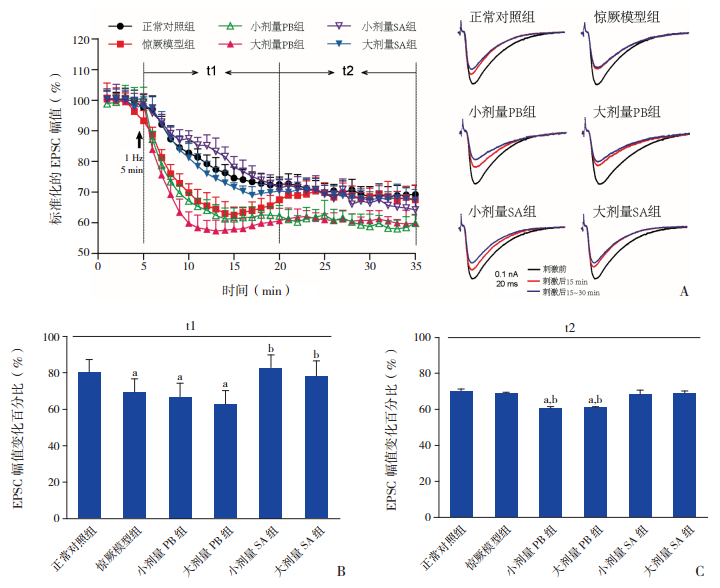 |
图 4 琥珀酸对发育期惊厥幼鼠小脑PC长时程抑制的影响 A(左):低频刺激(1 Hz,5 min)各组平行纤维(PF)诱发的PC兴奋性突触后电流(EPSC)的长时程抑制比较(n=10),t1:刺激后15 min;t2:刺激后15~30 min。(右):各组典型的PC EPSC在刺激前(黑色)、刺激后15 min(红色)和刺激后15~30 min(蓝色)的幅值变化。B:低频刺激后15 min内各组EPSC幅值变化的比较(n=10)。C:低频刺激后15~30 min各组EPSC幅值变化的比较(n=10)。a示与正常对照组比较,P<0.01;b示与惊厥模型组比较,P<0.01。 |
| 表 2 琥珀酸对发育期惊厥幼鼠小脑PC长时程抑制的影响 |
以上结果表明惊厥幼鼠发育期小脑PF-PC LTD的表达模式发生了变化,小剂量PB和大剂量PB均加剧了惊厥幼鼠发育期LTD表达模式的变化,而小剂量SA和大剂量SA均可使惊厥幼鼠发育期LTD的表达模式恢复正常。
3 讨论本研究显示新生期(P7)惊厥幼鼠PC兴奋性增高,并持续至发育期(P30)。值得注意的是,惊厥幼鼠PC的阈刺激在P7时未发生明显变化,而到P30时显著降低。这表明惊厥对幼鼠PC兴奋性的影响可能是长期的、渐进的。PB对这种惊厥造成的PC兴奋性的渐进性增强并没有抑制作用,大剂量PB甚至使惊厥幼鼠PC兴奋性进一步增强。而SA对惊厥幼鼠PC的高兴奋性有明显的抑制作用,大剂量SA对惊厥幼鼠PC放电频率的抑制比小剂量SA更显著。
徐晓科等[18]的研究发现单次给予P7幼鼠腹腔注射62.5 mg/kg PB,24 h后在海马下托部位发现神经元过度凋亡,但未造成幼鼠3周后海马的形态学改变和行为学(水迷宫测试)变化。本研究发现单次给予P7幼鼠腹腔注射120 mg/kg PB,对幼鼠小脑PC电活动的影响可持续到P30,而30 mg/kg PB对惊厥幼鼠PC电活动无明显的近期或远期影响。这些结果表明PB对发育脑造成的神经损伤与剂量有关,大剂量PB引起药物性脑损伤的可能性更大,持续时间更长。目前认为这与PB的作用机制和未成熟脑的特点有关。PB是通过增强GABA能突触传递,使神经元超极化而发挥抗惊厥作用的[19],但在未成熟脑内,由于神经元内Cl-浓度较高,GABA受体激活后Cl-外流,反而使细胞膜去极化,继而导致神经元的兴奋性增高[20]。
与PB相比,SA的作用机制较为复杂。研究发现SA一方面能抑制GABA和琥珀酸半醛之间的互变反应,升高惊厥动物脑内的GABA水平,增强中枢抑制,另一方面又能增加脑内谷氨酸脱羧酶活性,抑制谷氨酸水平的增高,抑制中枢兴奋[21]。此外,SA还能通过改变细胞膜对Cl-的通透性,抑制神经元去极化而降低神经元的兴奋性[22]。而当脑内神经元过度抑制时,SA又可调节谷氨酸水平,使脑内兴奋-抑制系统恢复平衡[9]。这种双向调节作用有利于维持脑内兴奋-抑制的平衡,减轻神经元的损伤。本研究发现SA能降低惊厥幼鼠PC的高兴奋性,证实其对未成熟脑具有良好的保护作用,推测可能与SA对神经元兴奋-抑制系统的适度调节有关。
LTD主要是指由α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(AMPA)受体介导的兴奋性突触在某种刺激后使突触传递效率持续降低的现象。本研究中,低频刺激PF使PC EPSC的幅值降低,并持续半小时以上,此即LTD。已经证明导致LTD出现的最终一步,是突触后膜表面AMPA受体总数的减少,其间详细的信号转导过程,涉及Ca2+内流以及蛋白激酶C(protein kinase C, PKC)、环磷酸鸟苷(guanosine 3',5'-cyclic phosphate, cGMP),和一氧化氮(NO)的激活和生成等机制[23]。近半个多世纪的研究发现脊椎动物小脑不仅参与一向公认的躯体平衡、运动协调和技巧动作的获得,而且也参与内脏功能调节和高级认知功能的形成。自上世纪80年代以来,以Ito为首的小脑科学家们发现小脑LTD在动物眨眼反射、前庭-眼反射和动作学习过程中发挥关键作用,认为小脑LTD是运动学习和记忆的分子基础[24]。与海马储存记忆功能不同的是,小脑LTD可能在纠错记忆中发挥重要的作用,因而使小脑LTD成为与高级认知功能相关的另一个研究热点[25]。许多研究表明在有学习记忆障碍的动物脑中,无法成功诱导LTD,反之亦然。因此目前公认LTD是学习和记忆的分子基础[26]。
我们先前的研究发现惊厥发作使P7惊厥幼鼠PC LTD发生了模式改变,表现为LFS后早期抑制程度的增强(LFS后15 min内)[12]。本研究发现PC LTD模式变化在惊厥幼鼠P30时更为显著。这一结果表明生后早期的惊厥事件对SD幼鼠PF-PC突触传递功能的影响会持续到发育期。而PB不仅加剧了惊厥幼鼠PC LTD的早期抑制,同时也加重了PC LTD的晚期抑制(LFS后15~30 min)。SA对惊厥幼鼠PC LTD模式的改变却有显著的矫正作用,无论P7还是P30,大剂量和小剂量SA均使PC LTD的抑制程度接近正常对照组。
Cornejo等[5]的研究发现,P7 SD大鼠单次惊厥发作即可永久性地改变谷氨酸能突触功能,使惊厥幼鼠在P60时海马长时程增强(LTP)被抑制,LTD被增强,同时细胞膜上AMPA受体亚型GluR1减少,N-甲基-D-天冬氨酸(N-methyl-D-aspartic acid, NMDA)受体亚型NR2A总量减少。本研究关于LTD的结果与Cornejo等[5]的研究相似,提示新生期的单次惊厥所产生的远期不良影响值得进一步关注。
未成熟脑对抗惊厥药有特殊的敏感性。有研究发现生后早期长程给予PB可引起大鼠脑发育异常,海马神经元和小脑PC及颗粒细胞数量减少,并抑制新生细胞的增殖,导致幼鼠成年后认知和行为能力改变[27, 28]。本研究发现P7单次给予PB(30 mg/kg)对大鼠PC LTD的强化可持续至P30,提示生后早期即使单次小剂量PB也有可能对远期认知能力产生不良影响。
本研究发现SA不仅能降低惊厥幼鼠PC的高兴奋性,对惊厥幼鼠PC LTD的异常也有近期和远期的修复作用。这一结果提示SA能够抑制新生期惊厥发作对大鼠PF-PC谷氨酸能突触功能的影响,从而具有神经保护作用。关于SA如何消除惊厥对发育脑PC LTD的影响,我们推测有以下几种可能:(1)通过上调突触间隙的谷氨酸水平,促进PC膜上大量静止型突触向活动型突触转变,从而解除惊厥对PC LTD的强化;(2)通过增加PC上的AMPA受体密度或抑制AMPA受体内化,使PC对PF传入的兴奋性刺激保持一定的反应能力;(3)通过调节全脑的能量代谢,减轻惊厥对神经元造成的损伤,从而使PC LTD能够正常表达。无论怎样,SA对未成熟脑的保护作用及其机制均有待于进一步探讨。
综上所述,本研究表明单次惊厥对未成熟脑的发育会产生远期不良影响,PB可能加剧这种损伤,SA能降低惊厥造成的神经元高兴奋性,并逆转惊厥引起的PC LTD强化,有明显的近期和远期神经保护效果,是一种用于临床新生儿惊厥救治的潜在的理想药物,值得深入研究。
| [1] | Vasudevan C, Levene M. Epidemiology and aetiology of neonatal seizures[J]. Semin Fetal Neonatal Med, 2013, 18(4): 185-191. |
| [2] | Castelhano AS, Cassane Gdos S, Scorza FA, et al. Altered anxiety-related and abnormal social behaviors in rats exposed to early life seizures[J]. Front Behav Neurosci, 2013, 7: 36. |
| [3] | Sayin U, Hutchinson E, Meyerand ME, et al. Age-dependent long-term structural and functional effects of early-life seizures: evidence for a hippocampal critical period influencing plasticity in adulthood[J]. Neuroscience, 2015, 288: 120-134. |
| [4] | Glass HC. Neonatal seizures: advances in mechanisms and management[J]. Clin Perinatol, 2014, 41(1): 177-190. |
| [5] | Cornejo BJ, Mesches MH, Coultrap S, et al. A single episode of neonatal seizures permanently alters glutamatergic synapses[J]. Ann Neurol, 2007, 61(5): 411-426. |
| [6] | Forcelli PA, Janssen MJ, Vicini S, et al. Neonatal exposure to antiepileptic drugs disrupts striatal synaptic development[J]. Ann Neurol, 2012, 72(3): 363-372. |
| [7] | Gutherz SB, Kulick CV, Soper C, et al. Brief postnatal exposure to phenobarbital impairs passive avoidance learning and sensorimotor gating in rats[J]. Epilepsy Behav, 2014, 37: 265-269. |
| [8] | Bhardwaj SK, Forcelli PA, Palchik G, et al. Neonatal exposure to phenobarbital potentiates schizophrenia-like behavioral outcomes in the rat[J]. Neuropharmacology, 2012, 62(7): 2337-2345. |
| [9] | 金园, 岳旺. 琥珀酸的药理研究进展[J]. 中国药学杂志, 1983, 18(2): 36-38. |
| [10] | 金园, 张士善. 琥珀酸的中枢抑制作用[J]. 药学学报, 1980, 15(12): 761-763. |
| [11] | Yue W, Liu YX, Zang DL, et al. Inhibitory effects of succinic acid on chemical kindling and amygdala electrical kindling in rats[J]. Acta Pharmacol Sin, 2002, 23(9): 847-850. |
| [12] | 谭晓丽, 师长宏, 任颖鸽, 等. 大剂量苯巴比妥对惊厥幼鼠 浦肯野细胞电生理功能的影响[J]. 中国病理生理杂志, 2014, 30(3): 529-532, 557. |
| [13] | Löscher W, Schmidt D. Which animal models should be used in the search for new antiepileptic drugs? A proposal based on experimental and clinical considerations[J]. Epilepsy Res, 1988, 2(3): 145-181. |
| [14] | Craig CR, Colasanti BK. A study of pentylenetetrazol kindling in rats and mice[J]. Pharmacol Biochem Behav, 1988, 31(4): 867-870. |
| [15] | Racine RJ. Modification of seizure activity by electrical stimulation. II. Motor seizure[J]. Electroencephalogr Clin Neurophysiol, 1972, 32(3): 281-294. |
| [16] | Kikuchi K, Hamano S, Oritsu T, et al. Effectiveness and safety of non-intravenous high-dose phenobarbital therapy for intractable epilepsy during childhood[J]. Brain Dev, 2011, 33(5): 379-383. |
| [17] | 徐书云, 卞如濂, 陈修. 药理实验方法学[M]. 第3 版. 北京: 人民卫生出版社, 2001: 200-204. |
| [18] | 徐晓科, 蔡方成, 宋艳, 等. 常用抗惊厥治疗方案对新生鼠 脑发育的影响[J]. 第三军医大学学报, 2010, 32(18): 1981-1985. |
| [19] | Schulz DW, Macdonald RL. Barbiturate enhancement of GABA-mediated inhibition and activation of chloride ion conductance: correlation with anticonvulsant and anesthetic actions[J]. Brain Res, 1981, 209(1): 177-188. |
| [20] | Ben-Ari Y. The GABA excitatory/inhibitory developmental sequence: a personal journey[J]. Neuroscience, 2014, 279: 187-219. |
| [21] | 章政, 李静, 聂惠贞, 等. 干贝素的抗癫癎作用[J]. 中国海洋 药物, 2005, 24(3): 33-35. |
| [22] | 丛红群, 岳旺, 杨志宏, 等. 琥珀酸在海马CA1 区对突触前 GABA 释放的影响[J]. 神经解剖学杂志, 2009, 25(1): 6-10. |
| [23] | Kohda K, Kakegawa W, Yuzaki M. Unlocking the secrets of the δ2 glutamate receptor: a gatekeeper for synaptic plasticity in the cerebellum[J]. Commun Integr Biol, 2013, 6(6): e26466. |
| [24] | 韩中胜, 乔健天. 小脑: 它的组件式神经元环路是如何进 行运动学习和经典式条件反射活动的?[J]. 生理科学进展, 2008, 39(1): 15-20. |
| [25] | Ito M, Yamaguchi K, Nagao S, et al. Long-term depression as a model of cerebellar plasticity[J]. Prog Brain Res, 2014, 210: 1-30. |
| [26] | D'Angelo E. The organization of plasticity in the cerebellar cortex: from synapses to control[J]. Prog Brain Res, 2014, 210: 31-58. |
| [27] | Chen J, Cai F, Cao J, et al. Long-term antiepileptic drug administration during early life inhibits hippocampal neurogenesis in the developing brain[J]. J Neurosci Res, 2009, 87(13): 2898-2907. |
| [28] | Verrotti A, Scaparrotta A, Cofini M, et al. Developmental neurotoxicity and anticonvulsant drugs: a possible link[J]. Reprod Toxicol, 2014, 48: 72-80. |
 2016, Vol. 18
2016, Vol. 18