2. 华中科技大学同济医学院附属武汉市妇女儿童医疗保健中心 急救科, 湖北 武汉 430016
β-内酰胺类抗生素/β-内酰胺酶抑制剂(β-lactam/β-lactamase inhibitors,BL/BLI)是儿科常用抗生素,有研究报道阿莫西林/克拉维酸、哌拉西林/他唑巴坦、头孢哌酮/舒巴坦等BL/BLI是导致细菌性重症肺炎患儿抗生素相关性腹泻(antibiotic-associated diarrhea,AAD)发生的高危因素[1]。为了探究其原因,本研究对是否根据细菌β-内酰胺酶(β-lactamase,BLs)选用 BL/BLI 患儿的AAD发生率进行对比分析,以探讨根据 BLs 选择抗生素对细菌性重症肺炎患儿 AAD 发生的影响。
1 资料与方法 1.1 研究对象收集武汉市妇女儿童医疗保健中心小儿重症医学科2011年1月至2014年1月期间,选用阿莫西林/克拉维酸(248例)或哌拉西林/他唑巴坦(208例)或头孢哌酮/舒巴坦(191例)抗感染的细菌性重症肺炎患儿,均未检测感染细菌的BLs,年龄1个月至14岁,平均3.8±1.7岁;以及2014年2月至2015年10月的细菌性重症肺炎患儿,年龄1个月至15岁,平均3.8±1.6岁,BLs阴性者选用阿莫西林(152例)或哌拉西林(184例)或头孢哌酮(136例)抗感染,BLs阳性者选择阿莫西林/克拉维酸(171例)或哌拉西林/他唑巴坦(107例)或头孢哌酮/舒巴坦抗感染(205例)。细菌性重症肺炎的诊断参照儿童社区获得性重症肺炎管理指南诊断标准[2]。
将选用阿莫西林或阿莫西林/克拉维酸的患儿作为阿莫西林组,选用哌拉西林或者哌拉西林/他唑巴坦的作为哌拉西林组,选用头孢哌酮或者头孢哌酮/舒巴坦的作为头孢哌酮组。
1.2 辅助治疗依据患儿病情采取氧疗、退热、补充水电解质,纠正酸碱失衡或者糖皮质激素等辅助治疗。
1.3 BLs检测按照全国临床检验操作规程[3]和相关文献[4],葡萄球菌和肠球菌β-内酰胺酶检测采用头孢硝噻吩试验,用棉拭子将待检菌悬液均匀涂布于Mueller-Hinton琼脂平板或血平板上,在平板中央贴1张头孢硝噻吩纸片(5 μg/片),35℃孵育16~18 h,头孢硝噻纸片不变色的为阴性,变成红色为阳性。对肺炎克雷伯菌、产酸克雷伯菌、大肠埃希氏菌和奇异变形杆菌采用超广谱β-内酰胺酶筛选和确证试验,筛选试验为头孢他啶抑菌环直径≤22 mm或头孢噻肟抑菌环直径≤27 mm;确证试验加含酶抑制剂,抑菌环直径与单药相比增大≥5 mm的即可判断为产超广谱β-内酰胺酶阳性。
1.4 抗感染治疗原则2011年1月至2014年1月期间未进行BLs检测,选择抗生素的原则是经验治疗与细菌药敏相结合,选用敏感药物阿莫西林/克拉维酸或哌拉西林/他唑巴坦或头孢哌酮/舒巴坦。2014年2月至2015年10月选择抗生素的原则是根据感染细菌的BLs及药敏结果,BLs阴性者选用阿莫西林或哌拉西林或头孢哌酮,BLs阳性者选择阿莫西林/克拉维酸或哌拉西林/他唑巴坦或头孢哌酮/舒巴坦抗感染。
1.5 AAD诊断AAD 诊断参考卫生部《医院感染诊断标准(试行)》AAD 诊断方案[5] :(1)入院前均无腹泻,静脉应用抗生素1~5 d 后出现腹泻;(2)大便次数≥3次/d,伴大便性状改变,如水样便、稀便;(3)大便常规无或少量白细胞;(4)大便中可检测出大量机会菌转变为优势菌或检出特殊病原菌(例如难辨梭状芽孢杆菌、金黄色葡萄球菌、白色念珠菌等);(5)排除基础疾病、病毒性肠炎、慢性肠炎急性发作、护理不当及饮食等相关原因所致的腹泻。
1.6 AAD临床症状观察对AAD患儿记录腹泻开始时间、腹泻病程、每日腹泻次数、抗生素使用时间及住院日。
1.7 统计学分析采用SPSS 19.0统计学软件进行数据处理。正态分布资料以均数±标准差(x±s)表示,组间比较采用t检验;计数资料以百分率表示,组间比较采用χ2检验。P<0.05为差异有统计学意义。
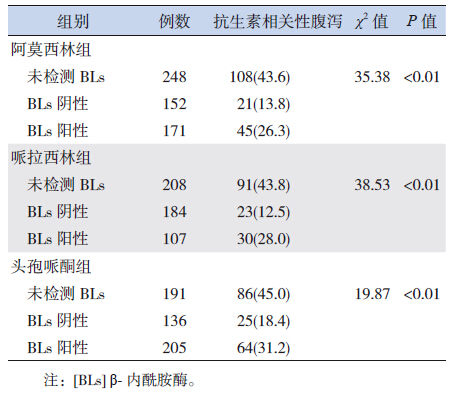
2 结果 2.1 各组抗生素相关性腹泻发生率的比较阿莫西林组、哌拉西林组、头孢哌酮组未检测 BLs、经验性选用BL/BLI患儿的AAD 发生率均较高(43.6%,43.8%,45.0%),高于相应各组BLs阴性(选用的β-内酰胺类抗生素)或阳性患儿(选用的BL/BLI抗生素)的AAD发生率;各组BLs阳性患儿的AAD发生率高于BLs阴性患儿,差异有统计学意义(P<0.01)。见表 1。
| 表 1 各组抗生素相关性腹泻发生率的比较 |
2.2 AAD临床症状分析
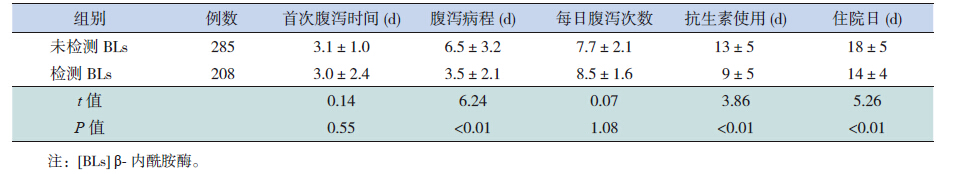
所有入组重症肺炎患儿中发生AAD的493例,其中未检测BLs的患儿285例、检测BLs的患儿208例,两组患儿首次发生腹泻的时间、每天腹泻次数的差异没有统计学意义(P>0.05);而检测BLs患儿的AAD病程、抗生素使用时间和住院日均短于未检测BLs的患儿(P<0.01)。见表 2。
| 表 2 检测与未检测BLs 患儿的抗生素相关性腹泻临床症状比较 (x±s) |
3 讨论
AAD 是指在抗生素治疗过程中或停用后2个月内发生的没有其它原因可解释的腹泻,在细菌性重症肺炎患儿中AAD的发生率较高[6],有文献显示我国某些地区重症肺炎患儿AAD 发生率达到70.59%[7]。AAD可能导致住院时间延长,医疗费用增加,甚至医疗纠纷,因此探究如何降低细菌性重症肺炎患儿 AAD 的发生率非常重要。
产BLs 的细菌能够水解 BL 类抗生素而导致治疗失败。目前治疗产BLs 的细菌感染可选择敏感的 BL/BLI抗生素[8],如阿莫西林/克拉维酸、氨苄西林/舒巴坦、哌拉西林/他唑巴坦、替卡西林/克拉维酸、头孢哌酮/舒巴坦等,对于儿童患者而言上述复合抗生素与喹诺酮类、氨基糖苷类抗生素相比副作用较小[2]。本研究发现,2014年1月之前未进行BLs检测,对于细菌性重症肺炎患儿均结合药敏经验性选用BL/BLI抗生素如阿莫西林/克拉维酸或哌拉西林/他唑巴坦或者头孢哌酮/舒巴坦,AAD 发生率因此也较高。对 于BLs 阴性的细菌感染选用 BL/BLI 容易导致 AAD 发生率增高,可能原因:(1)BL/BLI 比单一的 BL 类抗生素抗菌谱更广,不合理使用可能使肠道产 BLs 的正常菌群(例如脆弱类杆菌等)大量减少,导致条件致病菌大量增加,肠道黏膜屏障破坏[9-10];(2)不合理使用 BLI可能增加肠道正常菌群(双歧杆菌、乳酸杆菌等)细胞壁的通透性,以致一些药物或毒素更容易穿透这类细菌的细胞壁,抑制这类细菌生长,因此导致肠道正常菌群减少、条件致病菌增加[11-12];(3)某些过量的 BLI 破坏肠道正常功能,例如导致肠道碳水化合物和胆汁酸代谢紊乱,刺激小肠蠕动加速,因此发生渗透性腹泻[13]。
本研究于2014年1月之后对BLs 阳性的细菌性重症肺炎患儿选用相应敏感的 BL/BLI,而对 BLs 阴性者选用对应敏感的 BL 类抗生素。通过对比分析,我们发现根据BLs 选用 BL/BLI 可以降低细菌性重症肺炎患儿 AAD 的发生率,减轻腹泻症状,缩短腹泻病程、抗生素使用时间和住院日。对BLs 阳性的细菌感染患儿选用 BL/BLI 并不会导致较高的AAD,可能是由于BLI与 BLs 的不可逆结合,导致没有或者仅剩少量的 BLI 作用于人体正常菌群,对肠道正常菌群的抑制作用较小[14]。
总之,根据BLs规范使用BL/BLI可有效降低细菌性重症肺炎患儿AAD发生率并减轻腹泻症状。
| [1] | 李自华, 程国平, 汪在华, 等. 细菌性重症肺炎患儿抗生素 相关性腹泻发病率及高危因素分析[J]. 临床儿科杂志 , 2015, 33 (8) : 698–701. |
| [2] | 中华医学会儿科学分会呼吸学组, 《中华儿科杂志》编辑委员会. 儿童社区获得性肺炎管理指南(2013 修订)( 上)[J]. 中 华儿科杂志 , 2013, 51 (10) : 745–752. |
| [3] | 洪香华,孙自镛. 临床微生物与寄生虫病[M]//尚红, 王毓三, 申子瑜. 全国临床检验操作规程. 第4 版. 北京: 人民卫生 出版社, 2015: 574-625. |
| [4] | Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing; Twenty-fifth informational supplement[M]. M100S25. Wayne, PA: CLSI, 2015: 108-110. |
| [5] | 中华人民共和国卫生部. 医院感染诊断标准( 试行)[J]. 中华 医学杂志 , 2001, 81 (5) : 314–320. |
| [6] | Luzina EV, Lareva NV. Antibiotic-associated diarrhea in clinical practice[J]. Ter Arkh , 2013, 85 (2) : 85–88. |
| [7] | 鲍连生, 张振, 张多. 重症细菌性肺炎患儿继发抗生素相关 性腹泻临床分析[J]. 临床儿科杂志 , 2014, 32 (6) : 562–563. |
| [8] | 周华, 李光辉, 陈佰义, 等. 中国产超广谱β-内酰胺酶肠杆 菌科细菌感染应对策略专家共识[J]. 中华医学杂志 , 2014, 94 (24) : 1847–1856. |
| [9] | Rashid MU, Rosenborg S, Panagiotidis G, et al. Ecological effect of ceftazidime/avibactam on the normal human intestinal microbiota[J]. Int J Antimicrob Agents , 2015, 46 (1) : 60–65. DOI:10.1016/j.ijantimicag.2015.02.027 |
| [10] | Dubreuil L, Odou MF. Anaerobic bacteria and antibiotics: What kind of unexpected resistance could I find in my laboratory tomorrow[J]. Anaerobe , 2010, 16 (6) : 555–559. DOI:10.1016/j.anaerobe.2010.10.002 |
| [11] | Charteris WP, Kelly PM, Morelli L, et al. Antibiotic susceptibility of potentially probiotic Lactobacillus species[J]. J Food Prot , 1998, 61 (12) : 1636–1643. |
| [12] | Masco L, Van Hoorde K, De Brandt E, et al. Antimicrobial susceptibility of Bifidobacterium strains from humans, animals and probiotic products[J]. J Antimicrob Chemother , 2006, 58 (1) : 85–94. DOI:10.1093/jac/dkl197 |
| [13] | Bergogne-Bérézin E. Treatment and prevention of antibiotic associated diarrhea[J]. Intern J Antimicrob Agent , 2000, 16 (4) : 521–526. DOI:10.1016/S0924-8579(00)00293-4 |
| [14] | Toussaint KA, Gallagher JC. β-Lactam/β-Lactamase inhibitor combinations: from then to now[J]. Ann Pharmacother , 2015, 49 (1) : 86–98. DOI:10.1177/1060028014556652 |
 2016, Vol. 18
2016, Vol. 18