脓毒性休克(septic shock,SS)是儿童危重症死亡最常见的原因之一,病死率可达10%~50%[1]。SS时活化的免疫细胞产生大量的炎症细胞因子,激活下丘脑-垂体-肾上腺(HPA)轴,免疫细胞也可合成、分泌具有免疫活性的促肾上腺皮质激素(ACTH)[2],引起皮质醇大量分泌以限制炎症反应,从而保护机体免受炎症及过度免疫反应的打击,是机体适应、应激、抵御疾病的重要保障[3]。近年,小儿脓毒症、严重脓毒症的早期HPA轴功能状态已有研究报告,其中,安红等[4]做了动态研究,肯定了血清皮质醇、ACTH对判断脓毒症患儿病情严重程度、预测预后的临床价值,但研究对象都不包含SS患儿,研究结果是否适用于SS患儿有待于进一步研究。为此,本研究对SS患儿的血清皮质醇、ACTH水平进行了动态监测,探讨其临床意义。
1 资料与方法 1.1 研究对象及分组本研究病例来源于2010年12月至2014年12月入住我院PICU的SS患儿,共49例,其中男27例,女22例;年龄为2~36个月,平均年龄21个月,按2006年版儿科感染性休克(脓毒性休克) 诊疗推荐方案[5]进行诊断并分期。49例SS患儿中,SS失代偿期25例(男14例,女11例),SS早期24例(男13例,女11例)。排除患免疫缺陷病、肿瘤及近期接受免疫抑制剂治疗的患儿。同时随机选取相应年龄的健康体检儿童25例(男13例,女12例)作为正常对照组,无血液系统疾病、传染病、变态反应疾病等。各组在年龄、性别、体重等方面差异均无统计学意义。
SS失代偿期组及SS早期组患儿于入院后均给予液体复苏、呼吸支持、血管活性药、抗感染、低剂量糖皮质激素(氢化可的松每日50 mg/m2)、保护各脏器功能及对症支持治疗等。
1.2 检测指标及方法SS失代偿期组、SS早期组于入院当时及入院第3天、第8天上午8 : 00~9 : 00空腹采集静脉血4 mL,正常对照组于体检当日8 : 00~9 : 00空腹采集静脉血1次。待测标本分别注入促凝管和EDTA-2K抗凝管各2 mL,离心10 min分离血清和血浆,并将血清、血浆样本转移至1.5 mL的离心管内,-70℃保存,分别用于检测血皮质醇、ACTH,均采用化学发光法,操作步骤按照试剂盒说明进行。
1.3 仪器与试剂皮质醇检测采用贝克曼公司生产的ACCESS型全自动化学发光免疫检测仪,ACTH检测采用意大利索灵公司生产的LIASION型全自动化学发光免疫检测仪,均使用原装配套试剂盒。
1.4 统计学分析应用SPSS 13.0统计软件进行数据处理与分析。计量资料以均数±标准差(x±s)表示,各组数据经正态性检验后符合正态分布,两组间的比较采用成组t检验;3组间比较采用单因素方差分析。P<0.05为差异具有统计学意义。
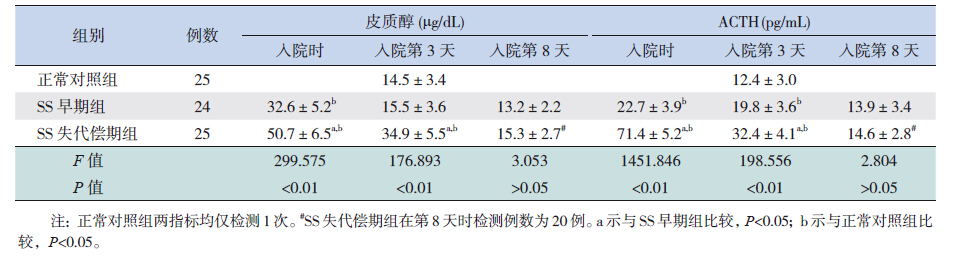
2 结果 2.1 SS失代偿期组、SS早期组的血清皮质醇、ACTH动态变化及与正常对照组的比较入院时SS失代偿期组、SS早期组和正常对照组的血清皮质醇水平比较差异有统计学意义(P<0.01),其中SS失代偿期组和SS早期组明显高于正常对照组(P<0.05),SS失代偿期组高于SS早期组(P<0.05);入院第3天SS失代偿期、SS早期组的血清皮质醇水平均有所下降,但3组相比差异仍具有统计学意义(P<0.01),其中SS失代偿期组高于SS早期组和正常对照组(P<0.05),SS早期组和正常对照组间的差异无统计学意义(P>0.05);入院第8天3组间相比差异均无统计学意义(P>0.05)。见表 1。
| 表 1 3 组血清皮质醇及ACTH 水平的比较(x±s) |
与正常对照组比较,入院时SS失代偿期组、SS早期组的ACTH水平明显升高(P<0.05),SS失代偿期组高于SS早期组(P<0.05),3组相比差异有统计学意义(P<0.01);入院第3天SS失代偿期、SS早期组的血ACTH水平均有所下降,但3组相比差异仍具有统计学意义(P<0.01),其中SS失代偿期组高于SS早期组和正常对照组(P<0.05),SS早期组高于正常对照组(P<0.05);入院第8天3组间相比差异无统计学意义(P>0.05)。见表 1。
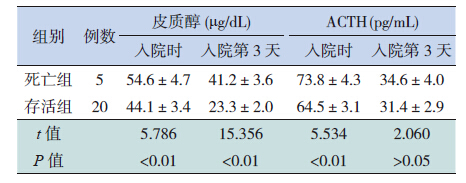
2.2 SS失代偿期患儿死亡亚组和存活亚组血清皮质醇及ACTH的比较SS失代偿期组中,5例死亡均发生在入院后5 d内。死亡患儿入院时的血清皮质醇水平明显高于存活患儿(P<0.01);入院第3天死亡患儿的血清皮质醇水平仍显著高于存活患儿(P<0.01)。死亡患儿入院时的血清ACTH水平明显高于存活患儿(P<0.01);入院第3天,两亚组ACTH水平均有下降,两亚组比较差异无统计学意义(P>0.05)。见表 2。
| 表 2 SS 失代偿期组死亡与存活患儿血清皮质醇及ACTH 水平的比较(x±s) |
3 讨论
神经内分泌免疫网络在应激状态下相互影响与调控[6]。研究表明,脓毒症时机体可刺激HPA轴,通过机体神经内分泌调节机制促进脑垂体释放ACTH作用于肾上腺皮质,ACTH具有控制本身释放的短反馈调节作用,ACTH升高是机体对肾上腺皮质功能受损的第一反应[7],是机体努力维持肾上腺皮质激素水平正常的代偿表现,产生并释放皮质醇以限制炎症反应[8],抑制淋巴细胞过度活化产生的细胞因子瀑布式级联反应,阻止循环功能衰竭、多器官功能障碍的发生;肾上腺皮质激素对下丘脑促肾上腺皮质激素释放激素及垂体前叶ACTH的分泌起负反馈调节作用。严重感染患者血清皮质醇水平普遍升高,波动范围明显增大[9]。Boonen等[10]发现,脓毒症患者皮质醇代谢酶的表达和活性降低,导致血浆皮质醇分解减少,从而皮质醇水平升高。靶器官不能对现有肾上腺皮质激素充分利用,相对于其感染应激的状态仍不足,即相对性肾上腺皮质功能减退(RAI)[11],呈“充足的饥饿状态”。
Sam等[12]对比观察了SS、脓毒症和健康对照组的游离皮质醇浓度,结果表明SS患者游离皮质醇浓度明显高于脓毒症和健康对照组,提示体内皮质醇水平变化与病情严重程度密切相关。由于血游离皮质醇检测存在困难,故临床常选择血清总皮质醇作为肾上腺皮质功能的指标。本研究显示,SS失代偿期组、SS早期组入院时的血清皮质醇与正常对照组比较均有明显升高,且SS失代偿期组显著高于SS早期组,随着入院时间的增加、炎症感染的控制,入院第3天,SS失代偿期组、SS早期组的血清皮质醇水平下降,但SS失代偿期组仍明显高于SS早期组和正常对照组,SS早期组和正常对照组间的差异已无统计学意义;入院第8天3组差异无统计学意义。SS失代偿期组中死亡患儿入院时及入院第3天的血清皮质醇均明显高于存活患儿。以上结果提示SS患儿的血清皮质醇水平与病情严重程度相关,持续高水平的血清皮质醇预示着死亡高风险。
安红等[4]研究发现,脓毒症患儿入院时病情越严重,血ACTH水平越高,恢复期ACTH浓度呈下降趋势,表明血ACTH升高的水平与病情严重程度相关。Sharshar等[13]在死于SS患者的尸检中发现,过量的炎症介质可诱导垂体细胞的凋亡,导致ACTH的合成与分泌急剧减少。本研究显示,SS失代偿期组、SS早期组入院时的ACTH与正常对照组比较均有明显升高,且SS失代偿期组显著高于SS早期组,随着入院时间的推移、炎症感染的控制,SS失代偿期组、SS早期组的ACTH水平逐渐下降,入院第3天SS失代偿期、SS早期组的血ACTH水平均有所下降,但SS失代偿期组仍明显高于SS早期组和正常对照组,SS早期组高于正常对照组;入院第8天3组差异无统计学意义。死亡患儿入院时的ACTH水平显著高于存活患儿,入院第3天二者ACTH水平均有下降,以死亡患儿为甚,二者差异无显著性。以上结果提示SS患儿的血清ACTH水平与病情严重程度相关。
综上所述,SS患儿的血清皮质醇、ACTH水平越高,病情越严重,尤其是是持续高水平的血清皮质醇提示预后差,死亡风险大。茜金强等[14]的研究也有类似发现,脓毒症患者血浆中皮质醇、ACTH明显升高,尤其是严重脓毒症患者血皮质醇升高更明显且持续。因此,动态监测SS患儿的血清皮质醇、ACTH对判断病情的严重程度及预后具有较高的临床价值。
| [1] | 周新央, 徐小龙. 40 例小儿严重脓毒症患者死亡的危险因素 分析[J]. 浙江实用医学 , 2012, 17 (1) : 63–64. |
| [2] | Clarke BL. Binding and processing of I-ACTH by isolated rat splenic lymphocytes[J]. Biochem Biophys Res Commun , 1999, 266 (2) : 542–546. DOI:10.1006/bbrc.1999.1848 |
| [3] | 崔娜, 刘大为. 糖皮质激素在严重感染和感染性休克中的应 用[J]. 中国危重病急救医学 , 2005, 17 (4) : 241–243. |
| [4] | 安红, 于哩哩, 徐丽瑾. 脓毒症患儿血清皮质醇、促肾上腺 皮质激素水平的测定及其临床意义[J]. 中国小儿急救医学 , 2012, 19 (4) : 387–389. |
| [5] | 中华医学会儿科学分会急救学组, 中华医学会急诊医学分会儿科组, 中华儿科杂志. 儿科感染性休克( 脓毒性休克) 诊 疗推荐方案[J]. 中国小儿急救医学 , 2006, 13 (4) : 313–315. |
| [6] | 王新兴, 钱令嘉. 应激与代谢调节[J]. 生理科学进展 , 2013, 44 (5) : 333–338. |
| [7] | Rivers E, Nguyen B, Havstad S, et al. Early goal-directed therapy in the treatment of severe sepsis and septic shock[J]. N Engl J Med , 2001, 345 (19) : 1368–1377. DOI:10.1056/NEJMoa010307 |
| [8] | Marik PE, Zaloga GP. Adrenal insufficiency in the critically ill: a new look at an old problem[J]. Chest , 2002, 122 (5) : 1784–1796. DOI:10.1378/chest.122.5.1784 |
| [9] | Hamrahian AH, Oseni TS, Arafah BM. Measurements of serum free cortisol in critically ill patients[J]. N Engl J Med , 2004, 350 (16) : 1629–1638. DOI:10.1056/NEJMoa020266 |
| [10] | Boonen E, Vervenne H, Meersseman P, et al. Reduced cortisol metabolism during critical illness[J]. N Engl J Med , 2013, 368 (16) : 1477–1488. DOI:10.1056/NEJMoa1214969 |
| [11] | Annane D, Sébille V, Troché G, et al. A 3-level prognostic classification in septic shock based on cortisol levels and cortisol response to corticotropin[J]. JAMA , 2000, 283 (8) : 1038–1045. DOI:10.1001/jama.283.8.1038 |
| [12] | Sam S, Corbridge TC, Mokhlesi B, et al. Cortisol levels and mortality in severe sepsis[J]. Clin Endocrinol (Oxf) , 2004, 60 (1) : 29–35. DOI:10.1111/cen.2004.60.issue-1 |
| [13] | Sharshar T, Gray F, Lorin de la Grandmaison G, et a1. Apoptosis of neurons in cardiovascular autonomic centres triggered by inducible nitric oxide synthase after death from septic shock[J]. Lancet , 2003, 362 (9398) : 1799–1805. DOI:10.1016/S0140-6736(03)14899-4 |
| [14] | 茜金强, 寿松涛. 脓毒症患者血浆皮质醇水平的动态变化及 临床意义[J]. 中国临床医学 , 2014, 21 (1) : 9–12. |
 2016, Vol. 18
2016, Vol. 18