2. 湖南省儿童医院肾脏风湿科, 湖南 长沙 410007
癫癎持续状态(status epilepsy,SE)或称癫癎状态,是癫癎连续发作之间意识未完全恢复又频繁再发,或发作持续30 min以上不自行停止。SE是癫癎发作的一种特殊形式,是需要紧急处理的一种严重状态。大约10%~20%的儿童癫癎病人至少有一次SE发作,所以更是儿科常见的急诊疾患之一。
MicroRNA是近年来发现的一类新的调控家族,与神经发育以及成人神经生物网络的多基因调控相关,如microRNA-132与神经外向性生长有关,而microRNA-134在神经突触的调节中起了重要作用,提示这些神经源性microRNA与突触可塑性等神经功能关系密切[1-3]。已有学者发现在癫癎发生后,不同海马组织中microRNAs的表达改变不同[4-5],其中microRNA-132和microRNA-134在这些脑组织及体液中呈现异常表达,提示其可能作为癫癎等脑损伤后的生物学标记。在一些癫癎患者中,持续癫癎发作伴随的海马组织中microRNA-132表达水平增加,可能导致神经形态学的改变,引起神经元的过度兴奋和大脑认知功能障碍[6]。前期本课题组也发现在幼年内侧颞叶癫癎(MTLE)大鼠模型各期microRNA-132呈现持续性表达增高,提示microRNA-132与MTLE的发生发展关系密切[7]。细胞实验证实,在体外培养原代神经元中,通过有效干预改变microRNA-132的表达,可对神经细胞突触形态及细胞兴奋性产生影响,过度表达的microRNA-132可导致神经突触重塑和树突出芽,增加兴奋性电流,促进神经元细胞的异常放电[8-9]。但目前国内外缺乏在体干扰microRNA-132对癫癎发生、发展影响的研究,对于干扰时机、给药方式更缺乏系统的研究。MicroRNA拮抗剂是一类经过特殊化学修饰的microRNA拮抗剂,通过与体内成熟的microRNA强竞争性结合,阻止microRNA靶基因mRNA的互补配对,达到抑制microRNA功能的作用。在前期的研究中,microRNA拮抗剂干预神经系统最常采用侧脑室注射方法[7-10]。因此,结合国内外研究进展和本课题组的前期工作基础,本研究采用氯化锂-匹罗卡品诱导建立幼年Sprague-Dawley(SD)大鼠SE模型,在造模前侧脑室注射microRNA-132拮抗剂下调microRNA-132水平,观察microRNA-132拮抗剂对大鼠SE发生的影响,探讨调控microRNA-132对大鼠癫癎发作的在体影响,为后续机制研究奠定良好的基础。
1 材料与方法 1.1 主要试剂及仪器MicroRNA-132拮抗剂及拮抗剂阴性对照购买自广州瑞博生物科技有限公司(产品ID:miR111645)。MicroRNA-132拮抗剂以冻干粉的形式保存于-20℃~-80℃,使用前用RNase-free H2O(上海信然生物科技有限公司)稀释,分装保存,尽量不要超过5次反复冻融。
匹罗卡品(美国Sigma-Aldrich公司);氯化锂(美国Genview公司);脑电图记录仪(日本Olympus公司);脑立体定位仪、微量注射器、套管针(深圳瑞沃德公司);微型手持式颅钻(STRONG90,韩国SAESHIN公司)。
1.2 实验动物分组3周龄雄性SD大鼠购自中南大学湘雅医学院实验动物中心,随机分为癫癎模型组、microRNA-132拮抗剂组、microRNA-132拮抗剂阴性对照组,在置管至建模前存活的大鼠进入研究,如期间死亡予以剔除,并分批次同步补充至每组15只。
1.3 侧脑室置管及脑电图电极定位采用立体脑定位仪,以实验动物前囟中点为参照点,在前囟中点旁移1.2 cm,后移0.6 cm,深度4.1 cm置入套管针,牙科水泥固定。海马电极定位为前囟中点旁移2.5 mm,后移3.8 mm,颅骨下3.8 mm。小脑参考电极定位为正中线人字缝后1 mm突破颅骨即可。
1.4 MicroRNA-132拮抗剂预处理在侧脑室成功置管后1周、建模前24 h,microRNA-132拮抗剂组和microRNA-132拮抗剂阴性对照组大鼠固定于脑立体定位仪上,采用微量注射器分别向侧脑室置管内注射microRNA-132拮抗剂、microRNA-132拮抗剂阴性对照,剂量为50 μL(20 nmol/mL)[4, 10],癫癎模型组则同步给予生理盐水50 μL。
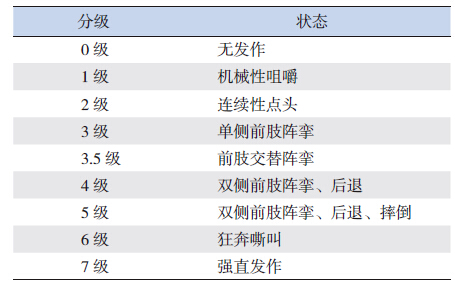
1.5 动物建模各组SD大鼠腹腔注射氯化锂125 mg/kg,18~20 h后腹腔注射匹罗卡品(50 mg/kg),诱导至癫癎发作[11],根据Lado幼鼠癫癎评分判定癫癎发作的程度,达到Lado幼鼠癫癎发作分级标准4~7级(表 1)并持续2 h即为SE[12]。给予SE大鼠水合氯醛300 mg/kg腹腔注射终止发作,解救前死亡者剔除,解救成功者纳入进一步研究。
| 表 1 Lado 幼鼠癫癎发作分级标准 |
1.6 行为学观察
通过行为学观察统计潜伏期时长,将实验大鼠从注射致癎药物开始到出现行为学Lado分级4级及以上癎性发作所需时间定义为潜伏期。Lado幼鼠癫癎评分评价大鼠抽搐严重程度,统计死亡率。
1.7 脑电图观察癫癎放电监测时长为注射匹罗卡品后约3 h,达到SE后90 min终止。
1.8 统计学分析采用SPSS 17.0统计软件包对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,多组计量资料的比较采用单因素方差分析,组间两两比较采用SNK-q检验,P<0.05为差异有统计学意义。
2 结果 2.1 SE模型制备结果各组给予氯化锂诱导后,注射匹罗卡品5~30 min,动物开始出现机械性咀嚼、连续性点头、单侧前肢阵挛、前肢交替阵挛,随后出现双侧前肢阵挛、后退、摔倒,最后出现狂奔嘶叫、强直发作。癫癎模型组、microRNA-132拮抗剂组及其阴性对照组分别有8、9、9只大鼠达到SE,诱导成功,成功率分别为53%(8/15)、60%(9/15)、60%(9/15),各组间比较差异无统计学意义(χ2=5.42,P>0.05)。
2.2 各组大鼠抽搐潜伏期时长各组潜伏期比较差异有统计学意义(F=4.72,P<0.05)。MicroRNA-132拮抗剂组潜伏期(56.9±2.7 min)(n=9)较其阴性对照组(51.4±1.7 min)(n=9)、癫癎模型组(52.2±2.3 min)(n=8)明显延长(P<0.05),癫癎模型组和microRNA-132拮抗剂阴性对照组之间比较,差异无统计学意义(P>0.05)。
2.3 各组大鼠抽搐Lado评分Lado评分结果显示:各组Lado评分比较差异有统计学意义(F=5.16,P<0.05)。MicroRNA-132拮抗剂预处理后,SD大鼠的Lado评分为5.3±1.0分(n=9),较癫癎模型组(5.8±0.8分)(n=8)及其阴性对照组(5.7±0.8分)(n=9)均有下降(P<0.05);而其阴性对照组与癫癎模型组比较差异无统计学意义(P>0.05)。
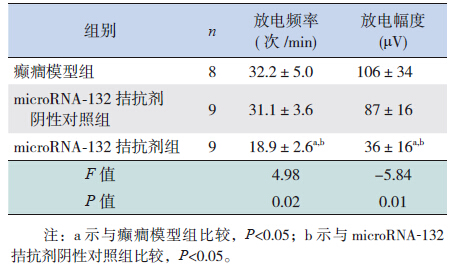
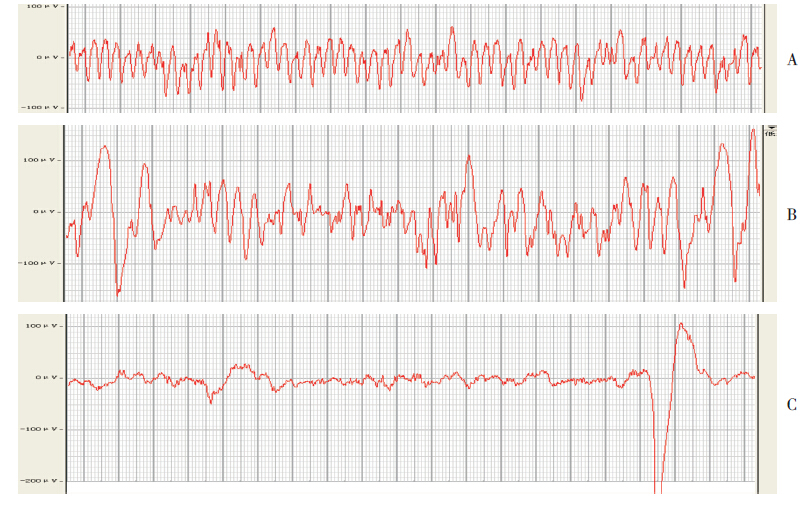
2.4 脑电图监测通过脑电图监测观察到,在诱导SE后,各组大鼠脑电图均可见到高波幅尖波、尖棘波发放,分析SE后30 min脑电图结果显示(图 1),microRNA-132拮抗剂组的大鼠脑电图尖波放电频率及放电幅度均明显低于癫癎模型组及microRNA-132拮抗剂阴性对照组(P<0.05),而癫癎模型组与microRNA-132拮抗剂阴性对照组的放电频率及幅度比较差异无统计学意义(P>0.05)。见表 2。
|
图 1 各组脑电图监测结果 A:癫癎模型组;B:microRNA-132 拮抗剂阴性对照组;C:microRNA-132 拮抗剂组。 脑电图记录参数为200 ms/div、100 μV、0.02 s、30 Hz。 |
| 表 2 各组大鼠放电频率与放电幅度比较 (x±s) |
2.5 各组大鼠死亡情况
SE诱导成功后通过观察各期的大鼠死亡情况发现,在SE后短时间(7 d)内,各组均有不同程度的死亡,癫癎模型组、microRNA-132拮抗剂及其阴性对照组分别死亡2、2、3只,在21 d内,癫癎模型组、microRNA-132拮抗剂及其阴性对照组分别死亡3、2、3只,21 d后至56 d内,癫癎模型组、microRNA-132拮抗剂及其阴性对照组大鼠均无新发死亡。
3 讨论MicroRNA是微小非编码RNA,参与各种生物的分化、增殖及凋亡等生理、病理过程。MicroRNA-132被认为是神经元性microRNA[13],在大鼠、小鼠及人类的中枢神经系统均100%保守表达,与正常神经分化、生长及扩展以及突触重塑等诸多神经功能有关。
MicroRNA-132表达具有突触优势,既往发现成熟的microRNA-132在海马齿状回区域神经元高度表达,在胚胎后期神经元树突区域或者成年大脑的突触碎片均有表达;除了成熟体,microRNA-132前体也在轴突富集[8-9]。MicroRNA-132表达增加能促进锥体细胞和颗粒细胞向神经元的成熟,促使颗粒神经元分化成熟。在培养的原代神经元中,microRNA-132富集于轴突,作为调节轴突延伸发展的正性调节因子,作用于轴突局部,调节Rasal mRNA,促进轴突延伸,与神经元形态和突触可塑相关,是调节突触活动的神经结构和功能的可塑性的重要因素[13-14]。
有研究发现microRNA-132表达异常与神经系统的许多疾病相关[13-16]。同时,在多种MTLE模型中,microRNA-132均表达上调,认为其与癫癎的发生、发展有关系[14-16]。有观点认为MTLE发生时,急性期存在大量神经元的丢失,同时,星形胶质细胞和小胶质细胞大量增生从而对癫癎的反复发作产生长期的影响,由于大量神经元丢失,星形胶质细胞、小胶质细胞增生,海马硬化发生[7, 17]。在体外培养原代神经元中,过度表达microRNA-132导致神经突触重塑和树突出芽,增加兴奋性电流,对神经元细胞的异常放电有影响[8-9]。也有研究在诱导癫癎前给予干预,使用microRNA-132 拮抗剂,抑制microRNA132的表达,可减少SE后海马CA3区域的神经元细胞死亡[4, 13-14]。在本研究中我们通过侧脑室注射microRNA-132拮抗剂预处理后建立SE模型,从脑电图来看,其放电频率和幅度均低于癫癎模型组,可能与此有关。
本课题组发现在幼年MTLE大鼠模型microRNA-146a、155及132的表达有改变,尤其是microRNA-132呈现持续性表达增高,提示microRNA-132与MTLE的发生发展关系密切。Huang等[10]发现在氯化锂-匹罗卡品模型中急性期microRNA-132表达上调,而慢性期表达下调,所以认为抑制microRNA-132的表达可能是起神经保护性作用。而既往的实验通过沉默microRNA-132基因或使用拮抗剂改变microRNA-132的表达,会对神经系统造成改变。在培养的海马轴突中,敲除microRNA-132减少轴突的延伸,而过度表达则促进其延伸[18]。清除体内的microRNA-132,与突触长度和宽度减少有关,而且使得突触转运受损[1, 19]。在本研究中,我们通过使用microRNA-132拮抗剂干预后,期望改变体内microRNA-132的水平,我们观察到注射microRNA-132拮抗剂的幼年SD大鼠诱导SE,其急性期死亡率低于对照组,可以证实microRNA-132拮抗剂对癫癎疾患存在保护作用,但由于为小样本资料,结果仍值得商榷。而通过比较microRNA-132拮抗剂组达到SE的潜伏期长于癫癎模型组,总体死亡率低于癫癎模型组,可以推测microRNA-132拮抗剂可能通过某些信号途径调节,减少神经元的死亡而发挥神经保护作用,而相关机制的研究,亦是我们进一步的研究方向。
综上所述,通过使用 microRNA-132拮抗剂,对氯化锂-匹罗卡品诱导的幼年SD大鼠发生SE具有抑制作用,因此抑制microRNA-132的表达有可能成为SE药物治疗的潜在靶点和新方向。
| [1] | Lambert TJ, Storm DR, Sullivan JM. MicroRNA132 modulates short-term synaptic plasticity but not basal release probability in hippocampal neurons[J]. PLoS One , 2010, 5 (12) : e15182. DOI:10.1371/journal.pone.0015182 |
| [2] | Numakawa T, Richards M, Adachi N, et al. MicroRNA function and neurotrophin BDNF[J]. Neurochem Int , 2011, 59 (5) : 551–558. DOI:10.1016/j.neuint.2011.06.009 |
| [3] | Henshall DC. microRNAs in the pathophysiology and treatment of status epilepticus[J]. Front Mol Neurosci , 2013, 6 : 37. |
| [4] | Jimenez-Mateos EM, Bray I. miRNA expression profile after status epilepticus and hippocampal neuroprotection by targeting miR-132[J]. Am J Pathol , 2011, 179 (5) : 2519–2532. DOI:10.1016/j.ajpath.2011.07.036 |
| [5] | McKiernan RC, Jimenez-Mateos EM, Bray I, et al. Reduced mature microRNA levels in association with dicer loss in human temporal lobe epilepsy with hippocampal sclerosis[J]. PLoS One , 2012, 7 (5) : e35921. DOI:10.1371/journal.pone.0035921 |
| [6] | Shaltiel G, Hanan M, Wo l f Y, et al. Hippocampal microRNA-132 mediates stress -inducible cognitive deficits through its acetylcholinesterase target[J]. Brain Struct Funct , 2013, 218 (1) : 59–72. DOI:10.1007/s00429-011-0376-z |
| [7] | Peng J, Omran A, Ashhab MU, et al. Expression patterns of miR-124, miR-134, microRNA-132, and miR-21 in an immature rat model and children with mesial temporal lobe epilepsy[J]. J Mol Neurosci , 2013, 50 (2) : 291–297. DOI:10.1007/s12031-013-9953-3 |
| [8] | Vo N, Klein ME, Varlamova O, et al. A cAMP-response element binding protein-induced microRNA regulates neuronal morphogenesis[J]. Proc Natl Acid Sci U S A , 2005, 102 (45) : 16426–16431. DOI:10.1073/pnas.0508448102 |
| [9] | Wayman GA, Lee YS, Tokumitsu H, et al. Calmodulin-kinases: modulators of neuronal development and plasticity[J]. Neuron , 2008, 59 (6) : 914–931. DOI:10.1016/j.neuron.2008.08.021 |
| [10] | Huang Y, Guo J, Wang Q, et al. MicroRNA-132 silencing decreases the spontaneous recurrent seizures[J]. Int J Clin Exp Med , 2014, 7 (7) : 1639–1649. |
| [11] | 甘娜, 尹飞, 孔惠敏, 等. IL-1β 和 NF-κB 在慢性内侧颞 叶癫癎模型中的相互作用[J]. 神经解剖学杂志 , 2013, 29 (6) : 637–643. |
| [12] | Gan N, Yang L, Omran A, et al. Myeloid-related protein 8, an endogenous ligand of Toll-like receptor 4, is involved in epileptogenesis of mesial temporal lobe epilepsy via activation of the nuclear factor-κB pathway in astrocytes[J]. Mol Neurobiol , 2014, 49 (1) : 337–351. DOI:10.1007/s12035-013-8522-7 |
| [13] | Magill ST, Cambronne XA, Luikart BW, et al. microRNA-132 regulates dendritic growth and arborization of newborn neurons in the adult hippocampus[J]. Proc Natl Acad Sci U S A , 2010, 107 (47) : 20382–20387. DOI:10.1073/pnas.1015691107 |
| [14] | Luikart BW, Bensen AL, Washburn EK, et al. miR-132 mediates the integration of newborn neurons into the adult dentate gyrus[J]. PLoS One , 2011, 6 (5) : e19077. DOI:10.1371/journal.pone.0019077 |
| [15] | Guo J, Wang H, Wang Q, et al. Expression of p-CREB and activity-dependent miR-132 in temporal lobe epilepsy[J]. Int J Clin Exp Med , 2014, 7 (5) : 1297–1306. |
| [16] | Miller BH, Zeier Z, Xi L, et al. MicroRNA-132 dysregulation in schizophrenia has implications for both neurodevelopment and adult brain function[J]. Proc Natl Acad Sci U S A , 2012, 109 (8) : 3125–3130. DOI:10.1073/pnas.1113793109 |
| [17] | Freiman TM, Eismann-Schweimler J, Frotscher M, et al. Granule cell dispersion in temporal lobe epilepsy is associated with changes in dendritic orientation and spine distribution[J]. Exp Neurol , 2011, 229 (2) : 332–338. DOI:10.1016/j.expneurol.2011.02.017 |
| [18] | Hancock ML, Preitner N, Quan J. MicroRNA-132 is enriched in developing axons, locally regulates Rasa1 mRNA, and promotes axon extension[J]. J Neurosci , 2014, 34 (1) : 66–78. DOI:10.1523/JNEUROSCI.3371-13.2014 |
| [19] | Bicker S, Lackinger M, Wei? K, et al. MicroRNA-132, -134, and -138: a microRNA troika rules in neuronal dendrites[J]. Cell Mol Life Sci , 2014, 71 (20) : 3987–4005. DOI:10.1007/s00018-014-1671-7 |
 2016, Vol. 18
2016, Vol. 18

 , 孔惠敏1, 李琳红1
, 孔惠敏1, 李琳红1