2. 皖南医学院第一附属医院药剂科, 安徽 芜湖 241001
随着围产医学的发展,早产儿的出生率和存活率越来越高,早产儿脑损伤引起的远期神经系统后遗症发病率也逐年增加,给社会和家庭带来了严重的负担[1-2]。宫内感染是引起早产的主要因素之一,临床和动物实验研究证实[3-5],宫内感染/炎症时,孕母和胎儿体内细胞因子网络激活,尤其小胶质细胞的激活,导致组成脑白质的主要细胞,少突胶质前体细胞(oligodendrocyte precursor cells,OPCs)的损伤,是宫内感染所致早产儿发生脑白质坏死、髓鞘减少或髓鞘合成延迟、轴突损伤以及神经元凋亡/坏死等的关键机制,也是宫内感染所致脑损伤早产儿发生远期神经系统后遗症的重要机制。Nogo-66受体(Nogo-66 receptor,NgR)广泛分布在中枢神经系统(central nervous system,CNS),神经元细胞和非神经元细胞均有表达,因其介导抑制成年人轴突损伤后再生而受到广泛关注[6-7]。研究表明[8],各年龄组大鼠CNS均有NgR表达,高表达始于新生鼠,以抑制突触形成。而成年大鼠大脑中动脉阻塞后1~3 d脑组织NgR表达达到第1个高峰[9]。创伤性脑损伤后高表达的NgR抑制神经再生和重塑[10]。在认知障碍大鼠中,NgR表达和轴突生长呈负相关,抑制海马神经元NgR的表达,促进轴突生长[11]。Pourabdolhossein等[12]研究发现,抑制NgR表达可促进成年小鼠视神经交叉非免疫局灶性脱髓鞘的修复,增加OPCs在损伤区的聚集。此外,NgR在小胶质细胞的表达,是导致CNS损伤后小胶质细胞损伤区聚集和持久性神经炎症的主要原因之一[7]。这些结果表明NgR与小胶质细胞的活化 、轴突生长和髓鞘发育、损伤后神经再生和重塑密切相关。本研究假设抑制NgR表达可以通过阻止抑制因子传导通路促进损伤神经再生,而NgR主要通过Rho-ROCK信号通路发挥抑制作用。本实验应用宫内感染所致早产大鼠脑损伤模型,经侧脑室一次性注射NgR特异性siRNA,观察脑组织中NgR表达,并测定活性RhoA变化及小胶质细胞活化程度等,探讨沉默NgR基因表达在宫内感染所致早产大鼠脑损伤修复中的可能作用及机制。
1 材料与方法 1.1 材料实验试剂包括脂多糖(LPS,Sigma 公司),米菲司酮(RU486,北京紫竹药业有限公司),TRIzol试剂(Invitrogen公司),RT逆转录试剂盒(Fermentas公司),Q-PCR试剂盒(Takara公司),活化RhoA(GTP结合RhoA)分离提取试剂盒 (Thermo&Scientific公司),β-actin抗体(上海碧云天生物技术公司),RhoA多抗(Thermo Scientific Pierce),CD11b抗体(abcam公司),O4抗体(Millpore公司),FIIC二抗(Biolegend公司),倒置相差荧光显微镜 IX50(OLYMPUS株式会社),NgR-siRNA慢病毒载体和慢病毒空载体(滴度为109,苏州吉玛基因股份有限公司)。
1.2 实验动物模型的建立及分组SPF级健康5月龄Sprague-Dawley大鼠40只,孕15 d,体重380~420 g,由南京市江宁区青龙山动物繁殖场提供,动物自由进食水。参照文献[13]并改良,随机选取10只孕鼠,颈部皮下注射RU486,每次每只0.15 mg,每日1次,连用两日,待其自然分娩,获胎龄小于22 d的单纯早产大鼠,从中随机选取36只,雌雄不拘,为对照组。另30只孕鼠,于腹中线处腹腔内注射LPS,每次0.25 mg/kg,每日1次,连用两日,待其自然分娩,获胎龄小于22 d的宫内感染致脑损伤早产大鼠,雌雄不拘,随机分为模型组、空载体组和NgR-siRNA组,每组36只。对照组和模型组早产大鼠出生后不给于特殊干预,返回母鼠身边常规饲养;空载体组和NgR-siRNA组均于出生后第1天(P1)使用脑立体定位仪分别从侧脑室经微量注射器一次性注射滴度为109慢病毒空载体和NgR-siRNA慢病毒载体 250 μL/kg(侧脑室注射点为前囟后1 mm、前囟右1 mm,深度1 mm),返回母鼠身边常规饲养。
1.3 标本制备按照实验设计,各组于P3、P7、P14各随机选取8只早产大鼠,经20%乌拉坦腹腔注射麻醉,4%多聚甲醛行全身灌注固定,断头取脑,半侧脑组织于4℃ 4%多聚甲醛中固定24 h,然后依次置入梯度为15%、20%和30%的磷酸盐缓冲液蔗糖溶液中分别过夜沉底,取下丘脑部位冠状切面,-20℃恒冷切片机行10 μm连续切片,用于免疫荧光组化。另外半侧脑组织,其中6只于-80℃冻存,用于活化RhoA蛋白和NgR mRNA的检测;2只用于苏木精-伊红(HE)染色。
1.4 免疫荧光组化脑组织冰冻切片4℃丙酮固定,TBS清洗、封闭1 h,分别加O4、CD11b一抗(1 : 200)4℃过夜,FIIC二抗孵育(1 : 1 600)2 h,免疫荧光防淬灭剂封片,O4标记OPCs,CD11b标记小胶质细胞,倒置相差荧光显微镜观察O4标记的OPCs形态及小胶质细胞CD11b的荧光强度。CD11b的荧光强度值计算:每个脑组织随机选取5张切片,每张切片随机观察5个视野,在相同荧光背景下运用image J软件计算出每张切片的荧光强度值,5张切片的平均值为该脑组织荧光强度值。
1.5 苏木精-伊红染色冰冻切片丙酮固定1 min,无水乙醇1 min,清洗,苏木素染色1 min,伊红染色15~20 s,酒精分化,清洗。脱水、透明、封片。
1.6 Real-Time PCR测定脑组织NgR mRNA采用Primer Premier 5.0软件设计引物,由上海生物工程有限公司合成。NgR上游序列5'-GCGTCTGCTGGAAATGCAC-3',下游序列5'-AAAGTCCCAAATGGAGAGTCATTG-3',扩增产物为109 bp;β-actin上游序列5'-TGACGTGGACATCCGCAAAG-3' ,下游序列5'-CTGGAAGGTGGACAGCGAGG-3',扩增产物为200 bp。引物设计后通过BLAST分析(www. ncbi. nlm. nih. gov/BLAST)避免扩增的序列存在非特异性,用Oligo demo软件测试序列无引物二聚体形成。TRIzol提取总RNA,按逆转录试剂盒说明书逆转录为cDNA。PCR反应体系(10 μL):20 mM上下游引物各0.1 μL,cDNA 0.1 μL,RoxⅡ 0.2 μL,SYBR Premix 5 μL,ddH2O 4.5 μL;PCR反应程序:94℃ 10 s;94℃ 10 s,60℃ 30 s,40个循环。用Real-Time PCR仪(Bio-Rad公司)进行反应,获得目的基因和内参基因Ct值。根据2-△△Ct公式对目的基因进行相对定量分析。
1.7 Western blot检测脑白质活化RhoA蛋白按活化RhoA(GTP-RhoA)分离提取试剂盒说明书操作,提取脑组织活化RhoA蛋白,取上样蛋白110 V恒压电泳2~3 h。凝胶转移至固相支持物,膜封闭,ECL显色,凝胶成像仪成像并检测其 IOD 值。目的蛋白条带和内参β-actin 条带的 IOD 比值表示目的蛋白相对表达量。
1.8 行为学检测各组取12只早产大鼠于P30时行行为学检测,行为学检测实验参考文献[14-15]。
(1)旷场实验:实验装置由旷场反应箱和数据自动采集处理系统两部分组成,由宁波安来软件科技有限公司提供(AniLab ver 6.52)。大鼠旷场反应箱高40 cm,底边长100 cm,内壁涂黑,底面平均分为25个4 cm×4 cm小方格,正上方2 m处架一数码摄像头,其视野可覆盖整个旷场内部。实验室背景噪音控制在65 dB以下,将实验大鼠放入箱内底面中心,同时进行摄像和计时。观察5 min。选择旷场中的总路程、平均速度、跨格次数和中心区域活动时间及距离作为参考指标。注意两次实验之间清洗实验设备,以免上次动物余留信息影响下次实验结果。
(2)悬吊实验:将一直径约0.5 cm的透明玻璃棒平行固定于距离桌面45 cm左右的位置,使大鼠脚紧抓玻璃棒,记录大鼠掉下的时间,具体评分标准为:<10 s得1分;10~30 s得2分;30~120 s得3分;2~5 min得4分;>5 min得5分。
(3)斜坡实验:将大鼠头向下置于45°的斜面上,记录大鼠头向上大于135°的时间,以秒进行计算。
1.9 统计学分析使用SPSS 10.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示。多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验,P<0.05为差异有统计学意义。
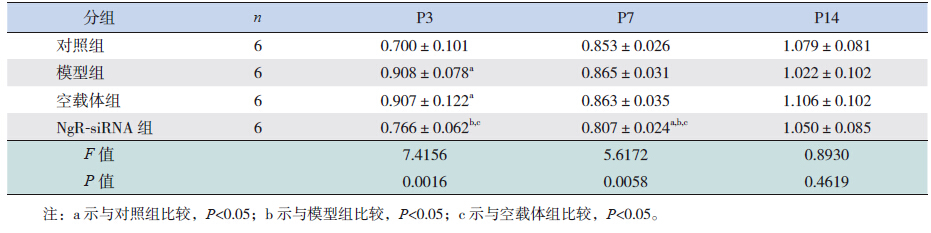
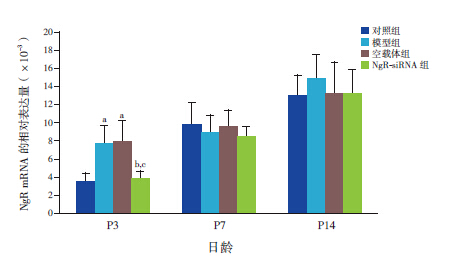
2 结果 2.1 NgR mRNA相对表达量在P3时,模型组和空载体组脑组织NgR mRNA的表达量显著高于对照组(P<0.05),NgR-siRNA组NgR mRNA的表达量显著低于模型组和空载体组(P<0.05),但同对照组比较差异无统计学意义(P>0.05);但至P7、P14时,各组间NgR mRNA表达量比较差异均无统计学意义(P>0.05)。见表 1,图 1。
| 表 1 各组大鼠不同时间点脑组织NgR mRNA 相对表达 量比较 (x±s,×10-3) |
|
图 1 RT-PCR 检测各组早产鼠各时间点脑组织NgR mRNA 相对表达量(n=6) a 示与对照组比较,P<0.05,b 示 与模型组比较,P<0.05,c 示与空载体组比较,P<0.05。 |
2.2 活性RhoA蛋白表达水平
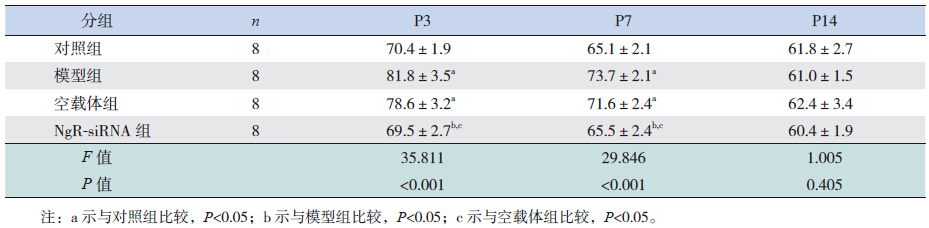
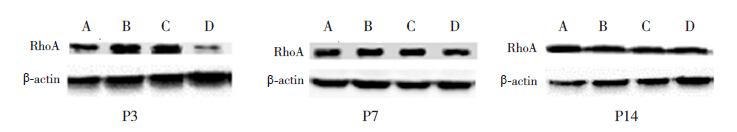
在P3时,模型组和空载体组脑组织活性RhoA蛋白水平高于对照组(P<0.05),NgR-siRNA组活性RhoA蛋白水平明显低于模型组和空载体组(P<0.05),且与对照组比较,差异无统计学意义(P>0.05);至P7时,NgR-siRNA组脑组织活性RhoA蛋白水平均低于对照组、模型组和空载体组(P<0.05),对照组、模型组和空载体组间比较差异无统计学意义(P>0.05);至P14时,各组间RhoA蛋白水平比较差异无统计学意义(P>0.05)。见表 2,图 2。
| 表 2 各组大鼠不同时间点脑组织活性RhoA 蛋白表达量比较 (x±s) |
|
图 2 Western blot 检测各组早产鼠各时间点脑组织活性RhoA 蛋白水平(n=6) A:对照组,B:模型组, C:空载体组,D:NgR-siRNA 组。 |
2.3 各组NgR mRNA表达与活性RhoA蛋白表达的相关性分析
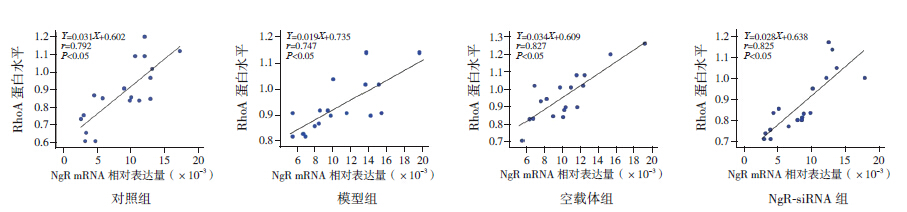
对照组、模型组、空载体组和NgR-siRNA组NgR mRNA相对表达量与活性RhoA蛋白水平均呈正相关(分别r=0.792、0.747、0.827、0.825,P<0.05)。见图 3。
|
图 3 各组NgR mRNA 表达与活性RhoA 蛋白表达的相关性分析图 |
2.4 各组CD11b标记的小胶质细胞免疫荧光强度
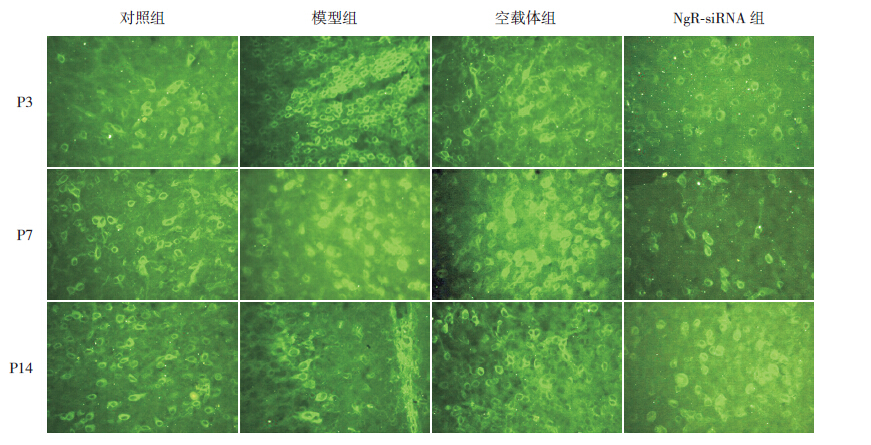
在P3时,模型组和空载体组脑组织中小胶质细胞表面CD11b荧光强度高于对照组(P<0.05),NgR-siRNA组小胶质细胞表面CD11b荧光强度较模型组和空载体组明显减弱(P<0.05),但与对照组比较差异无统计学意义(P>0.05)。在P7时,模型组和空载体组小胶质细胞表面CD11b荧光强度仍高于对照组(P>0.05),NgR-siRNA组荧光强度仍然弱于模型组和空载体组(P<0.05),同对照组比较差异无统计学意义(P>0.05)。在P14时,各组间的比较脑组织中小胶质细胞表面CD11b荧光强度差异无统计学意义(P>0.05)。见表 3,图 4。
| 表 3 各组不同时间点脑组织CD11b 标记的小胶质细胞平均荧光强度比较 (x±s) |
|
图 4 各组不同时间点脑组织CD11b 标记的小胶质细胞平均荧光强度比较 (x±s) 在 P3、P7 时,模型组和空载体组早产大鼠脑组织荧光强度强于对照组和NgR-siRNA 组。 |
2.5 各组O4抗体标记的OPCs形态
在P3时,各组多数O4+细胞呈现为三极突起的少突胶质-2型星型前体细胞形态,少数细胞呈现多突起的分裂末期OPCs形态。至P7、P14时,对照组和NgR-siRNA组仅少数O4+细胞呈三极突起形态,多数细胞呈多突起形态,细胞相互间连接成网状结构;而模型组和空载体组仅有少数细胞呈三极突起形态,绝大多数为散在分布、形态不一的细胞。见图 5。
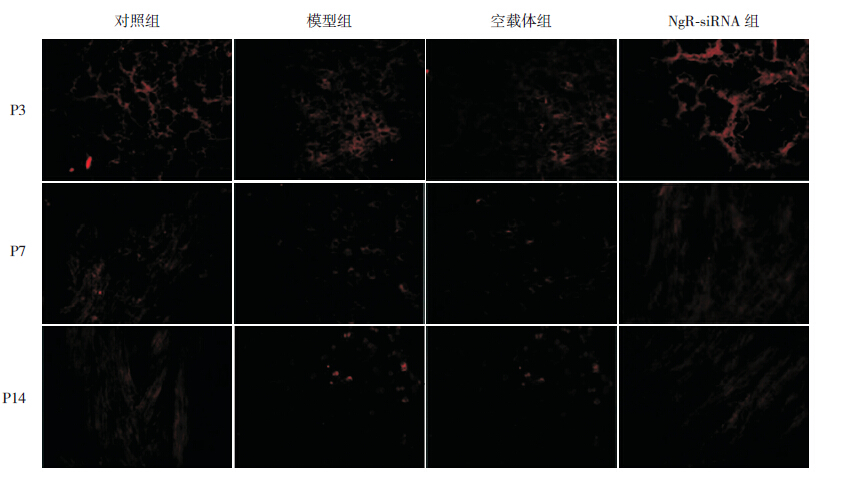
|
图 5 免疫荧光观察不同时间点各组早产大鼠脑组织中O4 抗体标记的OPCs 形态(×400) 在P3 时,各 组细胞多数呈现为三极突起的少突胶质-2 型星型前体细胞形态,至P7、P14 时, 模型组和空载体组仅有少数O4+ 细胞呈三 极突起形态,多数为散在分布、形态不一的细胞。O4 标记阳性的OPCs 呈红色。 |
2.6 脑组织病理变化
对照组在各时间点均可见脑室周围白质结构清晰,神经纤维走向整齐,排列致密;模型组和空载体组,在P3时,可见脑室周围白质结构疏松、纤维紊乱及软化灶,至P7、P14时损伤的白质区可见大量胶质细胞增生,神经纤维呈网状或条索状; NgR-siRNA组在各时间点均可见脑室周围白质神经纤维紊乱及结构疏松相对较轻,胶质细胞增生不明显,未见明显软化灶。见图 6。

|
图 6 各组早产鼠在不同时间脑组织病理学变化 对照组在各时间点均可见脑室周围白质结构清晰,神经纤维走 向整齐,排列致密;模型组和空载体组,在P3 时可见脑室周围白质结构疏松、纤维紊乱及软化灶,至P7、P14 时损伤白质 区可见大量胶质细胞增生,神经纤维呈网状或条索状;NgR-siRNA 组在各时间点均可见脑室周围白质神经纤维紊乱及结构疏 松相对较轻,胶质细胞增生不明显,未见明显软化灶。箭头所示为软化灶。 |
2.7 行为学检测
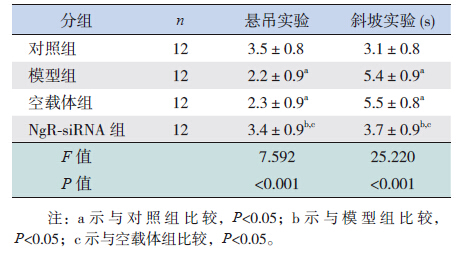
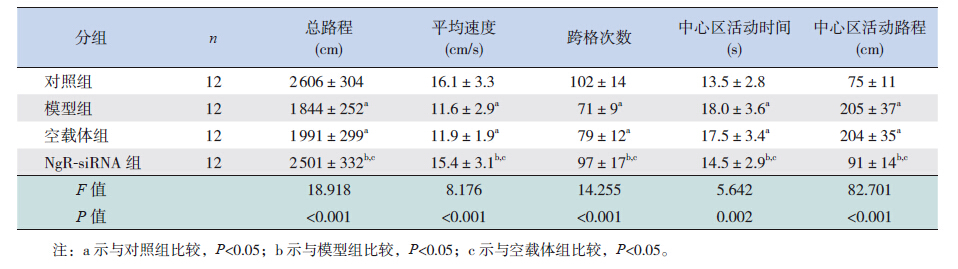
对P30时早产大鼠进行的神经行为学检测评分结果显示,模型组和空载体组悬吊实验评分均低于对照组,斜坡实验时间均长于对照组(P<0.05)。NgR-siRNA组悬吊实验评分高于模型组和空载体组,斜坡实验时间较模型组和空载体组明显缩短(P<0.05);但同对照组比较差异均无统计学意义(P>0.05)。旷场实验结果显示:模型组和空载体组活动总路程、平均速度和跨格次数均小于对照组,中心区活动时间和路程均大于对照组(P<0.05)。NgR-siRNA组活动总路程、平均速度和跨格次数均大于模型组和空载体组,中心区活动时间和路程明显少于模型组和空载体组(P<0.05);但与对照组比较差异无统计学意义(P>0.05)。见表 4~5。
| 表 4 各组早产大鼠行为学检测评分比较 (x±s) |
| 表 5 各组早产大鼠旷场实验总体结果比较 (x±s) |
3 讨论
CNS内少突胶质细胞的丢失、星形胶质细胞过度增生及神经元的损伤是宫内感染所致脑损伤早产儿发生远期神经系统后遗症的重要机制[16]。近年的研究发现,NgR在成熟的CNS损伤后的修复中具有至关重要的作用[17-18],而在啮齿动物CNS的发育过程中,NgR在胚胎中的表达始于13 d,参与调控神经干细胞和少突胶质细胞的分化及CNS小胶质等免疫细胞的黏附和迁移,维持CNS发育的完整性[6, 19-20]。宫内感染时,胎儿或新生儿CNS内小胶质细胞的活化是导致早产和脑损伤发生的关键因素[21],其关键机制是活化的小胶质细胞抑制OPCs增殖、诱导OPCs凋亡导致髓鞘发育障碍[22]。本研究应用外源性LPS经孕母鼠腹腔注射诱导早产,建立宫内感染所致早产大鼠脑损伤模型,并以RU486诱导的单纯早产大鼠为对照,结果发现:在P3时,模型组脑组织NgR mRNA的表达、活性RhoA蛋白水平和小胶质细胞活化程度均明显高于对照组;O4+的OPCs明显少于对照组;脑室周围白质结构疏松、神经纤维紊乱,可见软化灶。表明应用LPS可诱导宫内感染所致早产大鼠发生脑损伤,且NgR/RhoA信号通路的激活、小胶质细胞过度活化可能参与该病理损伤过程。
小分子RNA干扰是有效基因沉默技术,近年来的研究表明在CNS其干扰抑制目标基因表达的效能非常高[23]。本研究结果发现:在P3时,NgR-siRNA组脑组织NgR mRNA表达量显著低于模型组和空载体组,同对照组比较差异无统计学意义;但至P7、P14时,各组间的比较差异无统计学意义。表明经侧脑室一次性注射NgR特异性siRNA可有效沉默NgR基因的表达,且干扰效能可持续一定的时间。
在CNS中,除大脑皮层、海马神经元、脑桥等表达NgR[6],OPCs、单核细胞和小胶质细胞均有表达[7, 24],通过其下游主要信号分子RhoA发挥调控细胞增值、分化、凋亡/坏死等生物学作用[17]。Pedraza等[25]研究发现,抑制RhoA活化可促进OPCs的成熟和髓鞘形成。小胶质细胞的迁移、黏附和活化与NgR/RhoA信号密切相关[7]。本研究结果发现:在P3、P7时,NgR-siRNA组活性RhoA蛋白水平和小胶质细胞活化程度均明显低于模型组和空载体组,同对照组比较差异无统计学意义;但至P14时,各组间比较差异无统计学意义。同时,脑组织免疫荧光发现:在P3时,NgR-siRNA组O4+的三极形态和网状相连的多突起形态的细胞明显多于模型组和空载体组,同对照组基本一致;至P7、P14时,NgR-siRNA组细胞多数呈网状相连的多突起及片状形态,明显不同于模型组和空载体组散在分布的不规则形态细胞。病理学结果进一步证实,在P14时,NgR-siRNA组脑室周围白质神经纤维紊乱及结构疏松较轻,未见明显软化灶。表明沉默CNS NgR基因表达,可有效抑制RhoA蛋白的激活及小胶质细胞过度活化,促进OPCs的分化和成熟减轻脑损伤。此外,有研究已表明损伤的OPCs不仅导致髓鞘发育障碍,还改变局部微环境,抑制神经元前体细胞的分化、增殖[26]。RhoA信号在神经元的发育、存活及退变中具有关键作用[27],高表达的RhoA可导致出生后皮层神经元发生凋亡[28],抑制受损神经元轴突生长和重塑[20, 29]。可见一定时间内沉默NgR基因的表达在宫内感染所致早产大鼠脑损伤修复中可能具有神经保护作用。
神经行为学检测是目前全面综合判断动物脑损伤模型的常用方法,其中悬吊实验主要是反映上肢及躯干平衡功能的情况,斜坡实验可以反映大鼠的躯体运动功能的情况,旷场实验总路程和平均速度以及跨格次数被视为反映大鼠自发运动的主要数据,中心区运动时间和路程反映情绪及认知功能[14-15, 30]。本研究对各组早产大鼠P30时行神经行为学检测结果发现:模型组斜坡实验时间、旷场实验中心区活动的时间和路程明显高于对照组,悬吊实验评分、旷场实验活动总路程、平均速度和跨格次数小于对照组,且差异有统计学意义。表明脑损伤早产大鼠存在明显的躯体运动功能、平衡能力、协调能力、环境适应能力及认知能力的障碍。NgR-siRNA组在悬吊实验评分及旷场实验活动总路程、平均速度和跨格次数明显大于模型组和空载体组;但在中心区活动的时间和路程及斜坡实验时间上明显少于模型组和空载体组;与对照组比较差异均无统计学意义。提示siRNA沉默NgR基因表达可显著改善宫内感染所致脑损伤早产大鼠的肌力、平衡能力、协调能力、环境适应能力及认知能力。
总之,早期经侧脑室一次性注射NgR特异性siRNA可有效沉默CNS NgR基因表达,通过RhoA信号,抑制小胶质细胞活化、促进OPCs分化和成熟及神经元轴突生长和重塑,在宫内感染所致早产大鼠脑损伤修复中发挥神经保护作用。
| [1] | de Vries LS, Benders MJ, Groenendaal F. Progress in neonatal neurology with a focus on neuroimaging in the preterm infant[J]. Neuropediatrics , 2015, 46 (4) : 234–241. DOI:10.1055/s-00000041 |
| [2] | Mwaniki MK, Atieno M, Lawn JE, et al. Long-term neurodevelopmental outcomes after intrauterine and neonatal insults: a systematic review[J]. Lancet , 2012, 379 (9814) : 445–452. DOI:10.1016/S0140-6736(11)61577-8 |
| [3] | Pugni L, Pietrasanta C, Acaia B, et al. Chorioamnionitis and neonatal outcome in preterm infants: a clinical overview[J]. J Matern Fetal Neonatal Med , 2016, 29 (9) : 1525–1529. DOI:10.3109/14767058.2015.1053862 |
| [4] | Migale R, Herbert BR, Lee YS, et al. Specific lipopolysaccharide serotypes induce differential maternal and neonatal inflammatory responses in a murine model of preterm labor[J]. Am J Pathol , 2015, 185 (9) : 2390–2401. |
| [5] | Volpe JJ, Kinney HC, Jensen FE, et al. The developing oligodendrocyte: key cellular target in brain injury in the premature infant[J]. Int J Dev Neurosci , 2011, 29 (4) : 423–440. DOI:10.1016/j.ijdevneu.2011.02.012 |
| [6] | Borrie SC, Baeumer BE, Bandtlow CE. The Nogo-66 receptor family in the intact and diseased CNS[J]. Cell Tissue Res , 2012, 349 (1) : 105–117. DOI:10.1007/s00441-012-1332-9 |
| [7] | Yan J, Zhou X, Guo JJ, et al. Nogo-66 inhibits adhesion and migration of microglia via GTPase Rho pathway in vitro[J]. J Neurochem , 2012, 120 (5) : 721–731. DOI:10.1111/jnc.2012.120.issue-5 |
| [8] | Wills ZP, Mandel-Brehm C, Mardinly AR, et al. The nogo receptor family restricts synapse number in the developing hippocampus[J]. Neuron , 2012, 73 (3) : 466–481. DOI:10.1016/j.neuron.2011.11.029 |
| [9] | Cao Y, Dong YX, Xu J, et al. Spatiotemporal expression of Nogo-66 receptor after focal cerebral ischemia[J]. Neural Regen Res , 2016, 11 (1) : 132–136. DOI:10.4103/1673-5374.175059 |
| [10] | Israelsson C, Flygt J, Åstrand E, et al. Altered expression of myelin-associated inhibitors and their receptors after traumatic brain injury in the mouse[J]. Restor Neurol Neurosci , 2014, 32 (5) : 717–731. |
| [11] | Yin HL, Wang YL, Li JF, et al. Effects of curcumin on hippocampal expression of NgR and axonal regeneration in Aβ-induced cognitive disorder rats[J]. Genet Mol Res , 2014, 13 (1) : 2039–2047. DOI:10.4238/2014.March.24.8 |
| [12] | Pourabdolhossein F, Mozafari S, Morvan-Dubois G, et al. Nogo receptor inhibition enhances functional recovery following lysolecithin-induced demyelination in mouse optic chiasm[J]. PLoS One , 2014, 9 (9) : e106378. DOI:10.1371/journal.pone.0106378 |
| [13] | Burd I, Balakrishnan B, Kannan S. Models of fetal brain injury, intrauterine inflammation, and preterm birth[J]. Am J Reprod Immunol , 2012, 67 (4) : 287–294. DOI:10.1111/j.1600-0897.2012.01110.x |
| [14] | Wilson MD. Animal models of cerebral palsy: hypoxic brain injury in the newborn[J]. Iran J Child Neurol , 2015, 9 (2) : 9–16. |
| [15] | 陈光福, 张蕴芳, 龙琦, 等. 丰富环境干预促进缺氧缺血性 脑损伤新生大鼠神经元细胞增殖和功能修复[J]. 中国当代儿 科杂志 , 2012, 14 (2) : 139–143. |
| [16] | Burd I, Chai J, Gonzalez J, et al. Beyond white matter damage: fetal neuronal injury in a mouse model of preterm birth[J]. Am J Obstet Gynecol , 2009, 201 (3) : 279.e1–279.e8. DOI:10.1016/j.ajog.2009.06.013 |
| [17] | Pernet V, Schwab ME. The role of Nogo-A in axonal plasticity, regrowth and repair[J]. Cell Tissue Res , 2012, 349 (1) : 97–104. DOI:10.1007/s00441-012-1432-6 |
| [18] | Shen Y. Traffic lights for axon growth: proteoglycans and their neuronal receptors[J]. Neural Regen Res , 2014, 9 (4) : 356–361. DOI:10.4103/1673-5374.128236 |
| [19] | McDonald CL, Bandtlow C, Reindl M. Targeting the Nogo receptor complex in diseases of the central nervous system[J]. Curr Med Chem , 2011, 18 (2) : 234–244. DOI:10.2174/092986711794088326 |
| [20] | Schmandke A, Mosberger AC, Schmandke A, et al. The neurite growth inhibitory protein Nogo-A has diverse roles in adhesion and migration[J]. Cell Adh Migr , 2013, 7 (6) : 451–454. |
| [21] | Baburamani AA, Supramaniam VG, Hagberg H, et al. Microglia toxicity in preterm brain injury[J]. Reprod Toxicol , 2014, 48 : 106–112. DOI:10.1016/j.reprotox.2014.04.002 |
| [22] | Kleinsimlinghaus K, Marx R, Serdar M, et al. Strategies for repair of white matter: influence of osmolarity and microglia on proliferation and apoptosis of oligodendrocyte precursor cells in different basal culture media[J]. Front Cell Neurosci , 2013, 7 : 277. |
| [23] | Boudreau RL, Rodríguez-Lebrón E, Davidson BL. RNAi medicine for the brain: progresses and challenges[J]. Hum Mol Genet , 2011, 20 (R1) : R21–R27. DOI:10.1093/hmg/ddr137 |
| [24] | Huang JY, Wang YX, Gu WL, et al. Expression and function of myelin-associated proteins and their common receptor NgR on oligodendrocyte progenitor cells[J]. Brain Res , 2012, 1437 : 1–15. DOI:10.1016/j.brainres.2011.12.008 |
| [25] | Pedraza CE, Taylor C, Pereira A, et al. Induction of oligodendrocyte differentiation and in vitro myelination by inhibition of rho-associated kinase[J]. ASN Neuro , 2014, 6 (4) : 1–17. |
| [26] | Sypecka J, Sarnowska A. The neuroprotective effect exerted by oligodendroglial progenitors on ischemically impaired hippocampal cells[J]. Mol Neurobiol , 2014, 49 (2) : 685–701. DOI:10.1007/s12035-013-8549-9 |
| [27] | Stankiewicz TR, Linseman DA. Rho family GTPases: key players in neuronal development, neuronal survival, and neurodegeneration[J]. Front Cell Neurosci , 2014, 8 : 314. |
| [28] | Sanno H, Shen X, Kuru N, et al. Control of postnatal apoptosis in the neocortex by RhoA-subfamily GTPases determines neuronal density[J]. J Neurosci , 2010, 30 (12) : 4221–4231. DOI:10.1523/JNEUROSCI.3318-09.2010 |
| [29] | Petrinovic MM, Duncan CS, Bourikas D, et al. Neuronal Nogo-A regulates neurite fasciculation, branching and extension in the developing nervous system[J]. Development , 2010, 137 (15) : 2539–2550. DOI:10.1242/dev.048371 |
| [30] | Shehadah A, Chen J, Cui X, et al. Combination treatment of experimental stroke with Niaspan and Simvastatin, reduces axonal damage and improves functional outcome[J]. J Neurol Sci , 2010, 294 (1-2) : 107–111. DOI:10.1016/j.jns.2010.03.020 |
 2016, Vol. 18
2016, Vol. 18