新生儿窒息常可引起多种组织脏器损伤(如心、脑、肾上腺、肠等)。心脏属于高代谢、高耗氧器官,极易受缺氧因素影响,出现细胞水肿、凋亡、变性坏死等一系列病理变化,其中细胞凋亡是心肌细胞发生缺氧损伤的重要形式之一[1]。
钙依赖中性蛋白酶(calpain-1)是一种钙离子依赖性的半胱氨酸蛋白水解酶,参与细胞凋亡过程。正常情况下,calpain-1的酶活性处于抑制状态,但当机体受到缺氧等刺激时,calpain-1因Ca2+超载而被活化,能够产生一些可诱导细胞凋亡的信号及载体,最终导致细胞凋亡坏死[2]。
瘦素是一种具有类似于一些细胞因子结构的内分泌激素,由肥胖基因(Ob基因)编码,具有调节能量代谢、抑制摄食、参与激素分泌、促进细胞生长生殖、造血和调节免疫反应等多种功能[3-4]。
心脏作为瘦素的重要靶器官之一,瘦素与心脏相关疾病的研究成为近年来研究的热点,大量实验表明瘦素对心脏有直接保护作用,但是关于瘦素对calpain-1的影响目前尚无研究。因此本实验通过建立窒息新生鼠模型,检测心肌组织calpain-1及B淋巴细胞瘤-2(Bcl-2)蛋白表达变化及心肌细胞凋亡情况,并观察瘦素及calpain-1抑制剂处理后各指标的变化,以探讨瘦素是否可通过抑制calpain-1的活化而上调Bcl-2表达,进而减少心肌细胞凋亡。
1 材料与方法 1.1 实验动物及分组48只健康7日龄新生Sprague-Dawley(SD)大鼠,随机分为正常对照组、窒息组、瘦素处理组和calpain-1抑制剂组(CAI-1)组,其中瘦素处理组依据给予瘦素腹腔注射的浓度不同分为L20组、L80组和L160组,每组8只。
1.2 药品及主要试剂瘦素(200 μg)购于美国Peprotech公司,凋亡试剂盒购于北京中杉金桥生物公司,calpain-1抑制剂(5 mg)购于美国Sigma公司,兔抗鼠calpain-1抗体及Bcl-2单克隆抗体购于武汉三鹰生物公司。
1.3 动物模型制备及给药参照文献王彩霞等[5]报道的方法制备新生大鼠常压窒息模型,将新生鼠分别置于含有5 g钠石灰、容量为55 mL的磨口瓶中,其中窒息组、瘦素处理组、CAI-1组均用凡士林涂抹瓶口,塞瓶塞,密闭窒息30 min取出,复氧2 h,而对照组仅模拟该模型,不塞瓶口。其中瘦素处理组(L20组、L80组、L160组)在窒息后立即分别给予瘦素20、80、160 μg/kg进行腹腔注射[6],CAI-1组窒息后立即给予calpain-1抑制剂10 mg/kg腹腔注射[7]。
1.4 标本留置及制作各组新生大鼠在复氧2 h后,用1%的戊巴比妥钠腹腔注射进行麻醉,开胸取出心脏,每组8个标本,PBS液冲洗(尽量去除血管及脂肪组织),取心尖部组织,用10%甲醛固定24 h,石蜡包埋、切片,分别进行苏木精-伊红(HE)染色,免疫组化及Tunel法检测。
1.5 免疫组化法检测心肌组织calpain-1、Bcl-2的表达每个标本随机取3张切片,参照实验试剂盒说明书进行常规脱蜡、水化,3% H2O2液浸泡,高压热修复抗原,滴加一抗、二抗,DAB显色,复染等操作后,封片置于显微镜下观察。Calpain-1及Bcl-2在胞浆内均有表达,阳性免疫反应产物呈棕黄色,在放大400倍条件下随机选取5个不重叠视野进行拍照,采用Image-Pro Plus 6.0图像分析系统,统计各组累计光密度值(IOD),取平均值作为检测值,分别对calpain-1及Bcl-2的表达进行定量分析。
1.6 Tunel法检测心肌细胞凋亡每个标本随机取3张切片,按北京中杉金桥公司Tunel试剂盒说明书进行操作,对切片进行DAB显色后,将切片置于400倍光镜下观察,当细胞核内出现棕黄色颗粒即为凋亡细胞,随机选取5个不重叠视野进行拍照并分析图像,计算凋亡指数。
1.7 统计学分析采用SPSS 22.0统计软件对数据进行统计学分析,计量资料以均数±标准差(x±s)表示,多组间比较采用单因素方差分析,组间两两比较采用SNK-q检验;相关性分析采用Pearson相关性分析,P<0.05为差异有统计学意义。
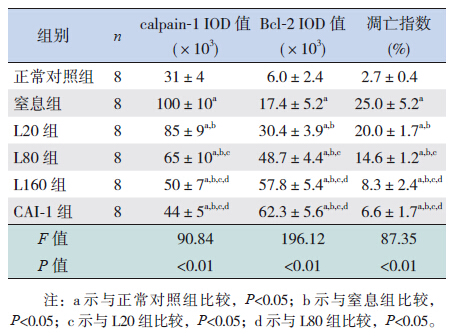
2 结果 2.1 各组新生鼠心肌组织病理改变正常对照组心肌细胞排列整齐,细胞质均匀淡染,细胞核清晰,偶见炎性细胞浸润;窒息组可见心肌细胞排列紊乱,不规则,部分细胞核浓缩、碎裂、消失,间质充血水肿,可见较多炎性细胞浸润;各瘦素处理组及CAI-1组上述病理改变较窒息组明显减轻,少量细胞排列紊乱,可见少量炎性细胞浸润,心肌坏死不明显,其中L160组及CAI-1组病变最轻微。见图 1。
|
图 1 各组新生鼠心肌组织病理改变(HE 染色,×200) 各组新生鼠心肌组织病理改变(HE 染色,×200) |
2.2 各组新生鼠心肌组织calpain-1和 Bcl-2表达
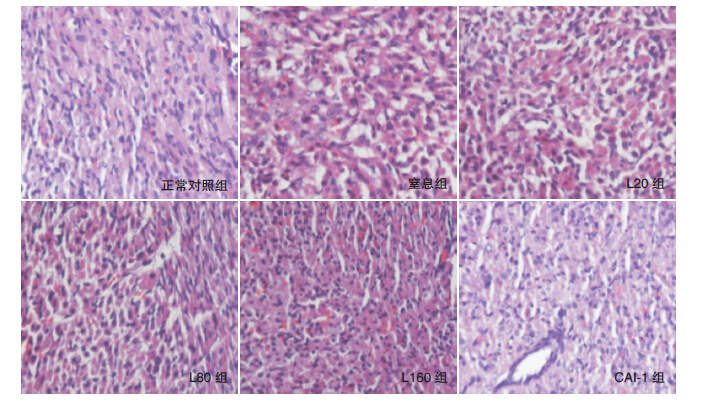
与正常对照组相比,窒息组、各瘦素处理组及CAI-1组calpain-1表达均显著升高(P<0.05);与窒息组比较,各瘦素处理组及CAI-1组calpain-1表达均显著下降(P<0.05),其中CAI-1组calpain-1表达最低,但与L160组之间比较差异无统计学意义(P>0.05)。见表 1,图 2。
| 表 1 各组新生鼠心肌组织calpain-1 和Bcl-2 的表达及心 肌细胞凋亡指数比较 (x±s) |
|
图 2 各组新生鼠心肌组织calpain-1 表达(免疫组化,×400) Calpain-1 表达阳性产物呈棕黄色。正常对照组 可见少许calpain-1 表达;窒息组明显增多;瘦素各处理组及CAI-1 组calpain-1 表达较窒息组减少,其中L160 组及CAI-1 组 calpain-1 表达减少最明显。 |
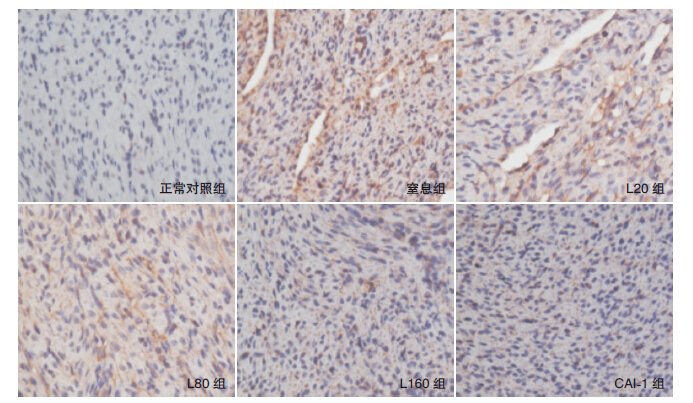
与正常对照组相比,窒息组、瘦素各处理组及CAI-1组Bcl-2表达均显著升高(P<0.05);与窒息组比较,各瘦素处理组及CAI-1组Bcl-2表达均显著升高(P<0.05),其中CAI-1组Bcl-2表达最高,但与L160组之间比较差异无统计学意义(P>0.05)。见表 1,图 3。
|
图 3 各组新生鼠心肌组织Bcl-2 表达(免疫组化,×400) Bcl-2 表达阳性产物呈棕黄色。正常对照组可见少 许Bcl-2 表达;窒息组、瘦素各处理组及CAI-1 组较对照组Bcl-2 表达均增多,其中L160 组及CAI-1 组Bcl-2 表达增多最显著。 |
2.3 各组新生鼠心肌细胞凋亡变化
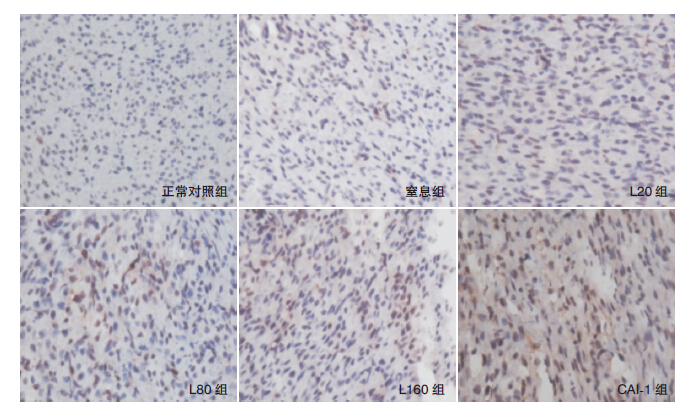
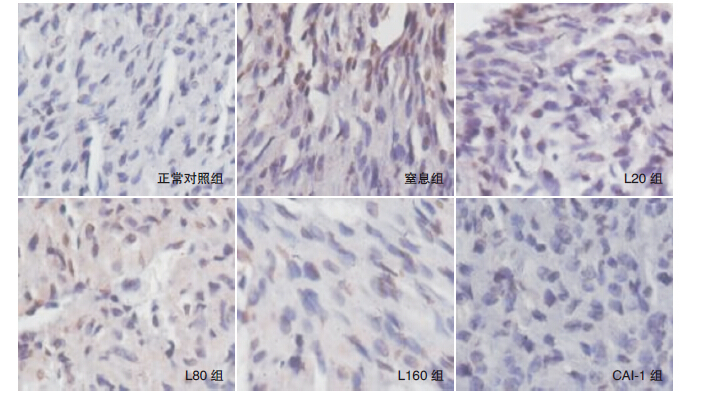
正常对照组仅见少数几个凋亡细胞,窒息组凋亡细胞最多,瘦素各处理组及CAI-1组凋亡细胞均较窒息组减少,其中L160组与CAI-1组凋亡细胞减少最明显。见图 4。
|
图 4 TUNEL 法检测各组新生鼠心肌细胞凋亡(DAB 显色,×400) 凋亡细胞显示为棕黄色。正常对照组可 见少许凋亡细胞;窒息组凋亡细胞明显增多;瘦素各处理组及CAI-1 组凋亡细胞较窒息组减少,其中L160 组与CAI-1 组凋亡 细胞减少最明显。 |
与正常对照组相比,窒息组、瘦素各处理组及CAI-1组凋亡指数均明显升高(P<0.05);与窒息组比较,瘦素各处理组及CAI-1组凋亡指数均显著下降(P<0.05),以CAI-1组凋亡指数下降最明显,但与L160组之间比较差异无统计学意义(P>0.05)。见表 1。
2.4 相关性分析窒息组、L20组、L80组、L160组及CAI-1组calpain-1表达与凋亡指数均呈正相关(分别r=0.73、0.77、0.79、0.81、0.87,P<0.05);窒息组、L20组、L80组、L160组及CAI-1组Bcl-2表达与凋亡指数均呈负相关(分别r=-0.84、-0.78、 -0.82、-0.73、-0.83,P<0.05);窒息组、L20组、L80组、L160组及CAI-1组calpain-1表达与Bcl-2表达均呈负相关(分别r=-0.71、-0.80、-0.81、 -0.86、-0.89,P<0.05)。
3 讨论新生儿窒息后心肌组织发生缺氧及酸中毒、细胞内钙超载、氧自由基生成过多等病理变化,而这些病理改变可直接造成细胞膜及细胞损伤,导致心肌细胞凋亡坏死。
研究表明calpain-1参与心肌细胞凋亡过程,窒息后,胞内钙超载,calpain-1被活化,开始心肌损伤过程。如Zhao等[8]发现,当用TNF-α诱导H9c2心肌细胞凋亡时,胞内calpain-1表达增多,而给予钙蛋白酶抑制剂处理后,胞内calpain-1表达降低,细胞凋亡减少。另外Zheng等[9]亦证实calpain-1可通过内质网应激途径,参与心肌缺氧/复氧过程中的心肌损伤,而抑制其酶活性,可明显减少心肌细胞凋亡,减轻心肌损伤。本实验亦发现新生鼠窒息后心肌组织calpain-1表达及凋亡指数明显升高,分别为正常对照组的3.2倍及9.3倍;而当新生鼠窒息后给予CAI-1处理后,calpain-1表达及凋亡指数明显下降,分别降为正常对照组的1.4倍及2.4倍。实验结果说明calpain-1参与了窒息新生鼠心肌细胞凋亡的过程,且具有促进作用。
Bcl-2是目前研究较广泛的一种抗凋亡蛋白,Bcl-2主要是通过减少氧自由基生成、抑制Ca2+跨膜流动、改变线粒体通透性、结合其家族中促凋亡相关蛋白等机制抑制细胞凋亡。本实验发现新生鼠窒息后心肌组织Bcl-2表达增多,且窒息组、L20组、L80组、L160组及CAI-1组Bcl-2表达与凋亡指数具有负相关性。说明Bcl-2的表达对窒息新生鼠心肌细胞凋亡具有抑制作用。
大量研究已经证实瘦素参与诸多心脏疾病(如心律失常、心肌缺血再灌注、慢性心衰等)的病理发展过程,对心脏有直接保护作用[10-12]。近年来还发现,瘦素对心肌细胞具有抗凋亡作用。如王文艳等[13]发现瘦素能控制大鼠心肌缺血再灌注损伤的炎症反应,促进相关抑凋亡蛋白表达并维持细胞生存,其可能经PI3K/AKT/NF-κB信号通路减轻心肌缺血再灌注损伤。Yu等[14]实验发现瘦素可抑制细胞色素C的释放,上调Bcl-2的表达,从而减少TNF-α诱导的心肌细胞凋亡,其分子机制可能为通过P38MAPK、NF-κB信号通路发挥对心脏的保护作用。上述研究结果与本实验结果一致,窒息后心肌细胞凋亡指数明显增多,为对照组的9.3倍;给予不同浓度瘦素(20 μg/kg、80 μg/kg、160 μg/kg)处理后,凋亡指数逐渐下降,依次为对照组的7.4倍、5.4倍、3.1倍;与窒息组比较,瘦素处理后calpain-1表达下降,Bcl-2表达增多;而将瘦素处理组与CAI-1组进行各实验指标比较,发现L160组与CAI-1组之间calpain-1及Bcl-2表达、凋亡指数等结果均无统计学意义,进一步证明了瘦素可抑制calpain-1的活化,上调Bcl-2表达,从而减少窒息新生鼠心肌细胞凋亡。
然而本实验仅对瘦素3个小剂量浓度进行研究,不能更确切的知道瘦素治疗的有效剂量范围,高剂量的瘦素浓度是否具有同样作用及其抗细胞凋亡的确切机制仍需更多的实验研究。
| [1] | Lee Y, Gustafsson AB. Role of apoptosis in cardiovascular disease[J]. Apoptosis , 2009, 14 (4) : 536–548. DOI:10.1007/s10495-008-0302-x |
| [2] | Patterson C, Portbury AL, Schisler JC, et al. Tear me down: role of calpain in the development of cardiac ventricular hypertrophy[J]. Circ Res , 2011, 109 (4) : 453–462. DOI:10.1161/CIRCRESAHA.110.239749 |
| [3] | 刘芹, 李云, 甘立霞. 瘦素在肝脏中的生理功能及其在肝脏 疾病中的作用[J]. 现代医药卫生 , 2012, 28 (6) : 876–879. |
| [4] | Smith CC, Yellon DM. Adipocytokines, cardiovascular pathophysiology and myocardial protection[J]. Pharmacol Ther , 2011, 129 (2) : 206–219. DOI:10.1016/j.pharmthera.2010.09.003 |
| [5] | 王彩霞, 徐淑珍, 姜长青, 等. 基质金属蛋白酶活性与新生 鼠窒息后心肌损害的相关性研究[J]. 中国新生儿杂志 , 2006, 21 (3) : 152–154. |
| [6] | Lin YC, Huang J, Hileman S, et al. Leptin decreases heart rate associated with increased ventricular repolarization via its receptor[J]. Am J Physiol Heart Circ Physiol , 2015, 309 (10) : H1731–H1739. |
| [7] | 陈思曾, 曹少祥. 钙蛋白酶抑制剂、α-硫辛酸单用及联用 治疗癌性恶病质[J]. 中华实验外科杂志 , 2013, 30 (8) : 1668–1671. |
| [8] | Zhao M, Yang Y, Bi X, et al. Acetylcholine attenuated TNF-α induced apoptosis in H9c2 cells: role of calpain and the p38-MAPK pathway[J]. Cell Physiol Biochem , 2015, 36 (5) : 1877–1889. DOI:10.1159/000430157 |
| [9] | Zheng D, Wang G, Li S, et al. Calpain-1 induces endoplasmic reticulum stress in promoting cardiomyocyte apoptosis following hypoxia/reoxygenation[J]. Biochim Biophys Acta , 2015, 1852 (5) : 882–892. DOI:10.1016/j.bbadis.2015.01.019 |
| [10] | Ghantous CM, Azrak Z, Hanache S, et al. Differential role of leptin and adiponectin in cardiovascular system[J]. Int J Endocrinol , 2015, 2015 : 534320. |
| [11] | Lin YK, Chen YC, Huang JH, et al. Leptin modulates electrophysiological characteristics and isoproterenol-induced arrhythmogenesis in atrial myocytes[J]. J Biomed Sci , 2013, 20 : 94. DOI:10.1186/1423-0127-20-94 |
| [12] | Hall ME, Harmancey R, Stec DE. Lean heart: role of leptin in cardiac hypertrophy and metabolism[J]. World J Cardiol , 2015, 7 (9) : 511–524. |
| [13] | 王文艳, 徐彤彤, 曾文轩, 等. 瘦素经PI3K-AKT-NFκB 通路 对大鼠心肌缺血再灌注损伤的影响[J]. 临床心血管病杂志 , 2015, 31 (12) : 1336–1339. |
| [14] | Yu L, Zhao Y, Xu S, et al. Leptin confers protection against TNF-α-induced apoptosis in rat cardiomyocytes[J]. Biochem Biophys Res Commun , 2014, 455 (1-2) : 126–132. DOI:10.1016/j.bbrc.2014.10.134 |
 2016, Vol. 18
2016, Vol. 18

 , 张丽娜
, 张丽娜