二烯丙基二硫(diallyl disulfide,DADS)是从大蒜中提取的含硫化合物,具有诱导癌细胞凋亡、抵抗病原体、调节机体免疫、预防心血管病等特性[1-2]。PI3K/AKT信号通路是细胞内阻碍肿瘤细胞凋亡的主要信号通路之一[3]。研究表明,慢性粒细胞白血病融合基因BCR/ABL可持久性地活化PI3K/AKT信号通路,从而阻碍白血病细胞凋亡,导致慢粒发生[4]。本课题组前期研究表明[5],DADS可诱导 K562细胞发生凋亡,并具有时间、剂量依赖性。但DADS 诱导 K562 细胞凋亡过程中 PI3K/AKT 信号通路所起的作用尚不清楚。本文旨在进一步探讨 DADS 诱导 K562 细胞发生凋亡的作用机制,为 DADS 应用于临床提供实验基础。
1 材料与方法 1.1 主要材料人K562细胞株购于中国典型培养物保藏中心。DADS从Fluka公司购买;小牛血清:杭州四季青;RPMI1640:美国HyClone;AnnexinV-FITC/PI双染试剂盒、吖啶橙/溴化乙啶(AO/EB)染液、蛋白磷酸酶抑制剂:北京索莱宝;兔抗人PI3K(S-473)一抗:美国Cell Signaling Technology;兔抗人Caspases-3一抗:美国Epitomics; 兔抗人β-actin一抗、山羊抗兔IgG:北京博奥森公司。
1.2 细胞培养及分组细胞培养基为含有10%新生小牛血清的RPMI 1640。在 37℃,饱和湿度,5%CO2孵箱中培养,每 3~4 d 换液传代。取对数生长期的 K562 细胞,调整细胞浓度至2.0×106/mL,接种于6孔板,分3组进行处理:空白对照组的K562细胞不予任何处理;溶媒对照组,加入实验组等体积的二甲基亚砜(DMSO);实验组,DADS加入培养的细胞中,终浓度分别为 10、20、40、80 mg/L。各处理组继续孵育48 h,倒置显微镜观察并摄片。每组3个复孔,实验重复3次。
1.3 AO/EB染色法观察DADS诱导K562细胞凋亡的形态学变化各处理组继续培养48 h后调整细胞浓度至5×106/mL,取1 mL细胞悬液,800转/min离心10 min,留取沉淀,加入25 μL PBS混悬,再加入2 μL AO/EB液混匀,取10 μL滴于载玻片,封片后在荧光显微镜下观察并拍片。
1.4 流式细胞术检测细胞凋亡各处理组培养48 h后收集细胞,冷PBS洗3次,调整细胞浓度至1×106/mL,600转/min、4℃离心5 min,留取沉淀,加入200 μL Binging Buffer、10 μL Annexin V-FITC和10 μL碘化丙锭,混匀,避光、冰上反应30 min,上机前再加入300 μL Binging Buffer,1 h内流式细胞仪检测细胞凋亡。
1.5 Western blot检测AKT、p-AKT、Caspases-3 蛋白的表达各处理组培养48 h后收集细胞,1 000转/min离心6 min,冰上裂解30 min。BCA 法测定蛋白浓度。点样行凝胶电泳,将分离出的蛋白转移至PVDF 膜,封闭膜2 h。加入β-actin兔一抗(1 : 500)、p-AKT兔一抗(1 : 1 000) 和AKT兔一抗(1 : 200),4 ℃过夜。洗膜,加辣根过氧化物酶标记的二抗(1 : 1 000),室温作用2 h。洗膜、显影并拍摄照片。
1.6 统计学分析采用SPSS 13.0统计软件对数据进行统计学处理。计量资料采用均数±标准差(x±s)表示,多组间比较采用单因素方差分析,两组间比较采用t检验。P<0.05 为差异具有统计学意义。
2 结果 2.1 形态学变化倒置显微镜下空白对照、溶媒对照组的细胞大小较均一、呈圆形,细胞膜完整,细胞内未见明显颗粒;随DADS浓度增加,实验组细胞体积缩小、大小不一,数量减少、胞内颗粒明显增加,可见椭圆形、杆状形细胞,胞膜外突的细胞增多。见图 1。

|
图 1 倒置显微镜观察各组细胞(×200) A:空白对照组;B:溶媒对照组;C~F:DADS 10 mg/L、20 mg/L、40 mg/L、 80 mg/L 组。A~B:细胞呈圆形,大小均一;C:细胞体积稍小,形态稍不规则(箭头所示);D:细胞数量稍减少,见少量胞 膜突出的细胞、形态呈杆形(箭头所示);E:细胞数量明显减少,失去正常形态,胞内颗粒明显增多(箭头所示);F:细 胞数量进一步减少,大小不一,可见数颗肿胀的细胞(箭头所示)。 |
2.2 AO/EB染色
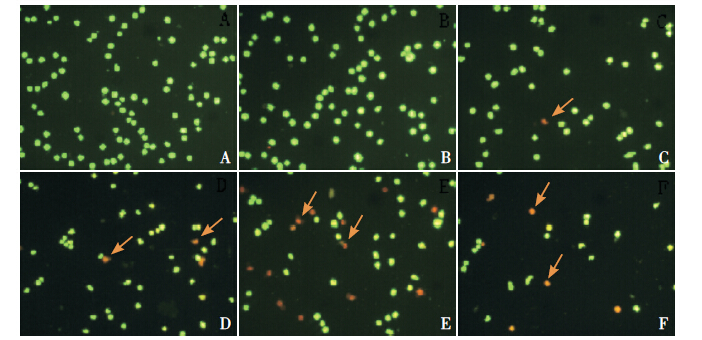
荧光显微镜观察各组细胞:对照组细胞呈圆形或椭圆形,大小均一,胞膜正常,细胞核呈绿色荧光,未见凋亡细胞。实验组随DADS浓度增大,细胞数量减少、体积缩小,细胞核染色质凝集发出的橘红色荧光逐渐增多,即核固缩的凋亡细胞增多;以40 mg/L DADS处理组凋亡细胞增多最明显;以80 mg/L DADS处理组细胞数量最少、可见肿胀的坏死细胞。见图 2。
|
图 2 AO/EB 染色法观察各组K562 细胞凋亡的形态学变化(×100) A 空白对照组;B 溶媒对照组;C~F: DADS 10、20、40、80 mg/L 组。A~B:正常细胞,细胞核染色质发绿色荧光;C~F:细胞体积逐渐缩小,数量减少,凋亡细胞 核染色凝集发红色荧光,呈固缩状、圆珠状(箭头所示)。 |
2.3 流式细胞术检测各组的细胞凋亡率
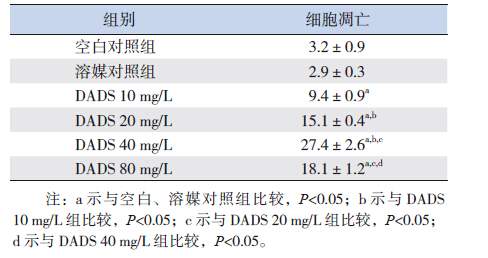
10、20、40、80 mg/L的DADS作用于K562细胞48 h后,其凋亡率分别为(9.4±0.9)%、(15.1±0.4)%、(27.4±2.6)%、(18.1±1.2)%,凋亡率逐渐增高呈剂量依赖性趋势(80 mg/L DADS组稍有下降,与K562细胞死亡多有关),并且均高于空白组[(3.2± 0.9)%]和溶媒对照组[(2.9±0.3)%],差异有统计学意义(P<0.05);空白对照组和溶媒对照组间的凋亡率差异无统计学意义(P>0.05)。见表 1。
| 表 1 各组K562 细胞的凋亡率 (n=3,x±s,%) |
2.4 各组K562细胞的AKT、p-AKT、Caspases-3蛋白表达
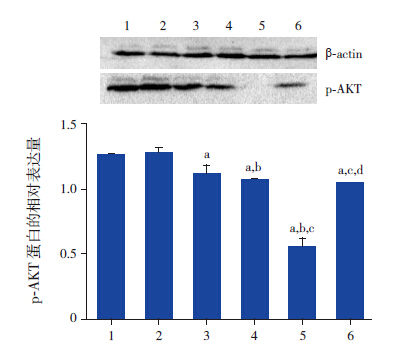
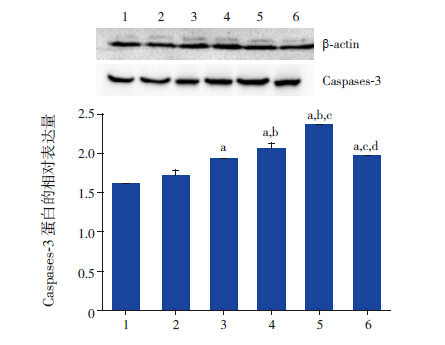
DADS处理组的AKT表达与空白对照组、溶媒对照组比较,差异无统计学意义(P>0.05),不同浓度DADS处理组的AKT表达差异无统计学意义(P>0.05)。p-AKT、Caspases-3蛋白的表达在空白对照组和溶媒对照组之间的差异无统计学意义(P>0.05);DADS处理组的p-AKT蛋白表达低于空白对照组和溶媒对照组,差异具有统计学意义(P<0.05),并且随着DADS浓度增加有减少趋势;DADS处理组的Caspases-3蛋白表达高于两个对照组(P<0.05),并且随着DADS浓度增加有升高趋势,以DADS浓度为40 mg/L时差异最为显著(P<0.05)。见图 3~5。

|
图 3 各组K562 细胞的AKT 蛋白表达(n=3) 1 空 白对照组;2 溶媒对照组;3~6 分别为 DADS 10、20、40、80 mg/L 组。 |
|
图 4 各组K562 细胞的p-AKT 蛋白表达(n=3) 1 空白对照组;2 溶媒对照组; 3~6 分别为 DADS 10、20、40、 80 mg/L 组。a 示与空白、溶媒对照组较,P<0.05;b 示与DADS 10 mg/L 组比较,P<0.05;c 示与DADS 20 mg/L 组比较,P<0.05; d 示与DADS 40 mg/L 组比较,P<0.05。 |
|
图 5 各组K562 细胞的 Caspases-3 蛋白表达(n=3) 1 空白对照组;2 溶媒对照组;3~6 分别为DADS 10、20、 40、80 mg/L 组。a 示与空白、溶媒对照组比较,P<0.05;b 示与 DADS 10 mg/L 组比较,P<0.05;c 示与DADS 20 mg/L 组比较, P<0.05;d 示与DADS 40 mg/L 组比较,P<0.05。 |
3 讨论
白血病是一类恶性疾病,化疗仍是治疗白血病必不可少的手段之一,癌细胞对化疗是否敏感是决定化疗效果的关键,但目前临床上使用的多种化疗药物呈现出内源性或获得性的药物耐受性,即多药耐药。因此寻找新的有效药物具有重大的意义。
近年来通过从植物中寻找天然的有效抗癌成分是肿瘤研究的新方向。DADS是从大蒜中提取出来的含硫化合物,可以导致多种癌细胞凋亡[6-8]。本实验倒置显微镜下可见,DADS处理组细胞体积缩小、胞浆浓缩、胞膜突出,细胞呈杆形、哑铃形,胞浆内颗粒增多;AO/EB染色法观察到:DADS处理组的细胞核染色质凝集为固缩状、圆珠状,染色发橘红色荧光的凋亡细胞逐渐增多,均从形态学上证明了DADS诱导K562细胞凋亡。流式细胞仪的检测进一步验证了DADS诱导K562细胞发生凋亡。
国内外研究显示,PI3K/AKT信号传导途径的活化能够促使肿瘤生长、繁殖、抗凋亡、促侵袭转移等一系列生物学活动。在人体多种癌症如卵巢癌、胰腺癌、乳腺癌和胃癌等中,PI3K 和 AKT 的过表达与异常激活参与了肿瘤的发生、发展[9-11]。AKT是PI3K/AKT信号通路的核心。活化的AKT蛋白向下游底物传递信号调控相关基因的表达,通过灭活Caspases和调控Bcl-2家族成员之间表达的平衡,从而起到促进肿瘤存活、增殖、抗凋亡的作用。Caspases家族在细胞凋亡过程中扮演关键性的角色,位于PI3K/AKT通路下游。Caspases-3是凋亡的主要执行者,可特异性水解底物从而促使细胞发生凋亡,所以,Caspases-3经常用作判断细胞凋亡的指标。本实验验证了 DADS 可有效的抑制 K562 细胞生长、增殖,促进其凋亡,并且在一定程度呈剂量依赖性,而且DADS 可显著降低 K562 细胞的 p-AKT 蛋白表达,并具有一定浓度依赖性,而 AKT 的磷酸化水平可以反映 PI3K 信号通路的活性;Caspases-3 蛋白的表达则随 DADS 浓度的增加逐渐升高。提示 DADS 可能通过抑制 PI3K/ AKT 信号通路及其下游,从而起到促进 K562 细胞凋亡的作用。
综上,DADS诱导K562细胞发生凋亡的分子机制可能与抑制PI3K/AKT信号途径有关。随着对DADS诱导白血病细胞发生凋亡的机制逐渐阐明,为其将来应用于临床提供实验基础,同时为白血病的治疗提供新的靶点。
| [1] | Yi L, Su Q. Molecular mechanisms for anticancer effect of diallyl disulfide[J]. Food Chem Toxicol , 2013, 57 : 362–370. DOI:10.1016/j.fct.2013.04.001 |
| [2] | Miao RZ, Liu LQ, Chen L, et al. Activity of heme oxygenase-1 affects expression levels of hypoxia inducible factor-1 gene in vitro[J]. Chin Med J (Engl) , 2012, 125 (7) : 1310–1315. |
| [3] | Hollander MC, Blumenthal GM, Dennis PA. PTEN loss in the continuum of common cancers, rare syndromes and mouse models[J]. Nat Rev Cancer , 2011, 11 (4) : 289–301. DOI:10.1038/nrc3037 |
| [4] | Pandurangan AK. Potential targets for prevention of colorectal cancer: a focus on PI3K/Akt/mTOR and Wnt pathways[J]. Asian Pac J Cancer Prev , 2013, 14 (4) : 2201–2205. DOI:10.7314/APJCP.2013.14.4.2201 |
| [5] | 殷小成, 肖正香, 彭艳辉. Fas/FasL 信号传导通路在DADS 诱导K562 细胞凋亡中的作用[J]. 中国实验血液学杂志 , 2011, 19 (3) : 634–637. |
| [6] | Yi L, Su Q. Molecular mechanisms for the anti-cancer effects of diallyl disulfide[J]. Food Chem Toxicol , 2013, 57 : 362–370. DOI:10.1016/j.fct.2013.04.001 |
| [7] | Ji C, Ren F, Ma H, et al. The roles of p38MAPK and caspase-3 in DADS-induced apoptosis in human HepG2 cells[J]. J Exp Clin Cancer Res , 2010, 29 : 50. DOI:10.1186/1756-9966-29-50 |
| [8] | Altonsy MO, Andrews SC. Diallyl disulphide, a beneficial component of garlic oil, causes a redistribution of cell-cycle growth phases, induces apoptosis, and enhances butyrateinduced apoptosis in colorectal adenocarcinoma cells(HT-29)[J]. Nutr Cancer , 2011, 63 (7) : 1104–1113. DOI:10.1080/01635581.2011.601846 |
| [9] | Riggio M, Polo ML, Blaustein M, et al. PI3K/AKT pathway regulates phosphorylation of steroid receptors, hormone independence and tumor differentiation in breast cancer[J]. Carcinogenesis , 2012, 33 (3) : 509–518. DOI:10.1093/carcin/bgr303 |
| [10] | Carden CP, Stewart A, Thavasu P, et al. The association of PI3 kinase signaling and chemoresistance in advanced ovarian cancer[J]. Mol Cancer Ther , 2012, 11 (7) : 1609–1617. DOI:10.1158/1535-7163.MCT-11-0996 |
| [11] | Papadimitrakopoulou V. Development of PI3K/AKT/mTOR pathway inhibitors and their application in personalized therapy for non-small-cell lung cance[J]. J Thorac Oncol , 2012, 7 (8) : 1315–1326. DOI:10.1097/JTO.0b013e31825493eb |
 2016, Vol. 18
2016, Vol. 18

 , 曹强强1
, 曹强强1