2. 深圳市妇幼保健院新生儿科, 广东 深圳 5180173 ;
3. 深圳市人民医院新生儿科, 广东 深圳 518001 ;
4. 深圳市人民医院新生儿科, 广东 深圳 518001
近年来研究发现,脑组织内人类促红细胞生成素(erythmpoietin,EPO)及其受体(EPOR)的表达水平在早产儿脑发育和脑损伤中具有重要的作用和地位,早期应用大剂量足疗程EPO可预防、减轻早产儿脑损伤的发生[1-3]。但外源性EPO在改善早产儿脑损伤的同时也可能干扰内源性EPO表达水平而扰乱正常的发育模式,并可引起红细胞增多、高血压和血栓,还可能促进早产儿视网膜病(ROP)的发生[4-5]。因此,早产儿EPO的表达水平、神经保护作用机制、临床应用剂量、时间窗、疗程和安全性还需要进一步探讨[6]。研究表明,神经元、星形胶质细胞、小胶质细胞和少突胶质细胞都可表达EPO和EPOR,通过自分泌或旁分泌发挥神经保护作用。有报道新生儿缺氧缺血后内源性EPO表达增加,从而保护神经细胞,促进脑损伤修复[7]。因此,推测早产儿脑损伤的个体易感性可能与内源性EPO水平有关,本研究通过对早产儿血清EPO水平与脑损伤进行检测和相关性分析,旨在探讨早产儿内源性EPO水平与脑损伤的关系,为外源性合理应用EPO防治早产儿脑损伤提供依据。
1 资料与方法 1.1 研究对象选取2014年10月至2015年9月在深圳市第二人民医院、深圳市妇幼保健院、深圳市人民医院和龙华新区人民医院新生儿科住院的胎龄28~34周早产儿作为研究对象。根据生后4~14 d颅脑B超和(或)核磁共振(MRI)扫描结果,将早产儿分为出血性脑损伤、缺血性脑损伤、出血+缺血性脑损伤及无脑损伤4组。
排除标准:(1)严重先天性畸形、遗传代谢性紊乱所致脑损害、低血糖脑病、胆红素脑病、中枢神经系统感染等特定中枢神经系统疾病;(2)颅脑B超或MRI检查提示单纯脑室稍扩大的早产儿。本研究获得家长书面知情同意及医院伦理委员会批准。
1.2 早产儿脑损伤的诊断分类标准早产儿脑损伤包括出血性和非出血性损伤两类。出血性损伤常见为生发基质-脑室内出血,脑室周围出血-梗死,蛛网膜下腔出血,小脑出血及其他部位出血;非出血性损伤主要为脑白质损伤(white matter damage,WMD),其为缺血性病变,也与宫内感染及其他因素有关[8-9]。
(1)出血性脑损伤:颅脑MRI表现为T1WI高信号,T2WI低信号。2周以上的陈旧性出血,T1WI和T2WI均呈高信号。颅脑B超表现为强回声团块、脑室扩大。
(2)缺血性脑损伤:脑白质T2WI弥漫性高信号,皮质、皮质下及深部白质T1WI呈高信号;丘脑、基底核T1WI为异常不均匀高信号,原有的内囊后支高信号消失;大脑边缘片状、楔形病灶,T1WI低信号,T2WI高信号。颅脑B超表现为侧脑室前角附近、后角三角区旁及侧脑室外侧半卵圆中心、后角三角区附近白质不均匀性回声异常增强和(或)囊腔。
1.3 资料收集(1)产前因素:宫内感染、妊娠期高血压、妊娠期糖尿病、胎膜早破、胎盘异常;(2)产时因素:性别、胎龄、出生体重、分娩方式、多胎妊娠、羊水污染、围产期窒息;(3)产后因素:新生儿呼吸窘迫综合征(NRDS)、吸氧时间、使用经鼻持续气道正压通气(nCPAP)时间、机械通气时间、肠道外营养时间、早产儿贫血、脓毒症、低血糖、高胆红素血症、坏死性小肠结肠炎(NEC)、酸中毒等。
1.4 指标检测采集所有患儿入院第3天外周静脉血 2 mL进行离心处理,并将血清置于-70℃冰箱保存。采用 ELISA 法测定血清EPO、S-100B蛋白、神经元特异性烯醇化酶(NSE) 和髓鞘碱性蛋白(MBP)浓度,EPO试剂盒由 R&D Systems公司提供,S-100B蛋白试剂盒由Biovendor公司提供,NSE和MBP试剂盒由上海蓝基生物科技有限公司提供,严格按说明书进行操作。
1.5 统计学分析应用 SPSS 20.0 统计软件进行统计学分析。正态分布计量资料以均数±标准差(x±s)表示,两组间均数比较采用t检验,多组间均数比较采用单因素方差分析,组间两两比较采用SNK-q检验;计数资料以百分率(%)表示,两组间比较采用χ2检验;排除混杂高危因素的干扰后,采用多因素logistic回归模型进行风险度和关联性分析,计算比值比(OR),P<0.05为差异有统计学意义。
2 结果 2.1 一般资料共纳入304例早产儿作为研究对象。男172例,女132例;胎龄28~34周,平均30.9±1.3周,其中胎龄<32周149例,32~34周155例;出生体重800~2 740 g,平均1 656±389 g,其中<1 500 g 110例,≥1 500 g 194例;多胎妊娠25例;围产期窒息33例;自然分娩101例,剖宫产203例;孕母妊娠期并发症46例(感染10例,糖尿病11例,高血压25例),胎盘早剥16例,前置胎盘24例;胎膜早破63例;NRDS 87例;使用nCPAP/机械通气131例;感染(新生儿肺炎、败血症、NEC)96例;低血糖23例;贫血75例。
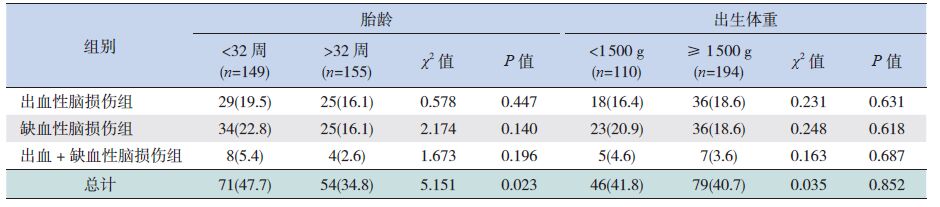
2.2 早产儿脑损伤发生率304例早产儿中,诊断早产儿脑损伤125例(41.1%)。其中出血性脑损伤54例(17.8%),缺血性脑损伤59例(19.4%),出血+缺血性脑损伤12例(4.0%)。出生胎龄越小,脑损伤发生率越高,<32周胎龄早产儿脑损伤发生率高于>32周早产儿(P<0.05);出生体重与脑损伤发生率无关(P>0.05)。见表 1。
| 表 1 不同脑损伤组患儿胎龄和体重比较 [例(%)] |
2.3 不同血清EPO水平早产儿的脑损伤发生率
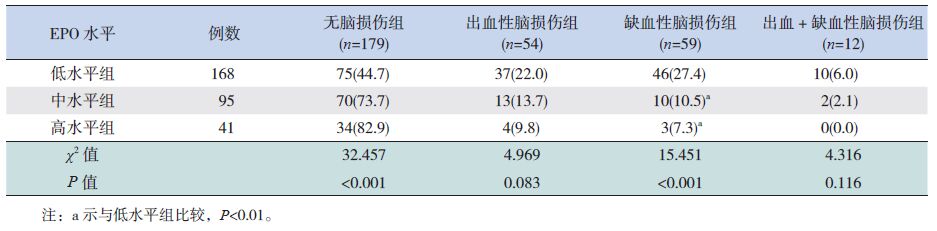
将血清EPO分为低水平(<5.0 mIU/mL)、中水平(5.0~10.0 mIU/mL)和高水平(>10.0 mIU/mL)3组,比较各组脑损伤的发生率,结果显示低水平EPO组缺血性脑损伤发生率明显高于中高水平EPO组(P<0.01),见表 2。
| 表 2 不同血清EPO水平早产儿的脑损伤发生率 [例(%)] |
2.4 各组早产儿血清EPO及脑损伤生化指标水平比较
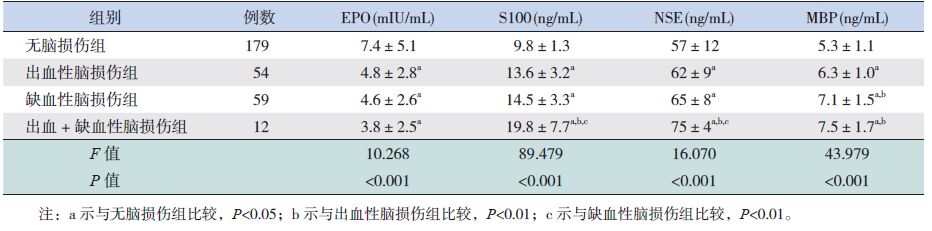
无脑损伤组血清EPO水平明显高于各种脑损伤组(P<0.05),而脑损伤组间差异无统计学意义(P>0.05);3组脑损伤早产儿血清S100蛋白、NSE、MBP水平均高于无脑损伤组(P<0.01),其中出血+缺血性脑损伤组血清S100蛋白、NSE水平高于出血性脑损伤和缺血性脑损伤组(P<0.01),出血性脑损伤组血清MBP水平低于缺血性脑损伤组和出血+缺血性脑损伤组(P<0.01)。见表 3。
| 表 3 各组早产儿血清各指标水平比较 (x±s) |
2.5 相关性分析
血清EPO水平与S100蛋白浓度(r=-0.326,P=0.000)、NSE水平(r=-0.143,P=0.012)均呈负相关,与MBP浓度无明显相关(r=-0.026,P=0.646)。
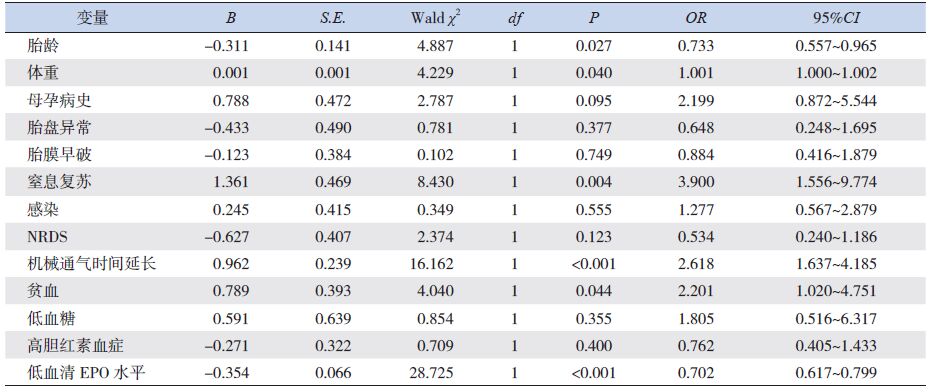
应用二分类反应变量回归分析校正了传统危险因素后,结果显示低胎龄、低出生体重、窒息复苏、机械通气时间延长、贫血、低血清EPO水平均是脑损伤的独立危险因素,见表 4。
| 表 4 EPO水平与早产儿脑损伤的多因素回归分析 |
3 讨论
早产儿脑损伤主要包括WMD和脑室周围-脑室内出血(periventricular-intraventricular hemorrhage,PIVH),WMD是早产儿脑损伤的主要形式,分为局灶型白质损伤(囊性PVL、非囊性PVL)和弥漫性白质损伤(DWMD)[10]。
早产儿发生率在美国为10%~12%,我国在8%左右,其中50%的低出生体重早产儿会发生脑白质损伤,病理研究发现胎龄23~32周的早产儿脑白质损伤高达75%[11-12]。近年来,随着神经影像学技术的进展,尤其是弥散加权成像(diffusion weighted imaging,DWI)、弥散张量成像(diffuse tensor imaging,DTI)和磁敏感加权成像(susceptibility weighted imaging,SWI)技术等在早产儿生后早期的临床应用,提高了早产儿脑损伤的检出率,其表现形式也发生了改变。研究显示,早产儿WMD中囊性PVL发生率在减少,仅占早产儿脑损伤的5%左右,而非囊性PVL及弥漫性的WMD逐渐成为损伤的主要形式,生发层基质和脑室内出血可与PVL共存[13]。法国一项多中心研究表明,胎龄≤33周、极低出生体重的早产儿有10%~14%会发生脑性瘫痪,40%~50%会出现认知缺陷、行为/心理障碍、癫癎和视听障碍,导致这些问题的脑白质损伤发生率高达75%[14]。本研究结果低于文献报道,可能与部分病例只应用常规MRI检查对局灶性WMD和弥漫性WMD急性期的诊断作用不足有关。
研究发现,EPO及其受体在脑组织中均有低水平的表达,并在脑缺氧或脑损伤后表达增加,可能对神经系统发育有重要作用[5]。动物模型研究显示,EPO对发育期脑损伤有神经保护作用[5]。其对于神经系统的保护作用主要是减少缺氧缺血性脑损伤,减少脑梗塞形成,减少出血灶,减轻血管收缩和抑制脑细胞凋亡[15]。近年来部分学者开展了早期即生后 3 d内给予人EPO对早产儿神经系统保护作用的研究,实验表明外源性EPO能对抗自由基损伤,减少脑细胞凋亡,抑制兴奋性氨基酸的毒性作用,尤其对于海马和大脑皮层的神经元有更好的保护作用[16-17]。本研究也显示,早产儿血清EPO水平越低,脑损伤发生率越高。研究表明,EPO基因存在许多单核苷酸多态性位点,其中rs1617640位于EPO基因启动子区,其G/G基因型与EPO基因的转录活性及血清中EPO的水平降低有关[18]。而EPO高水平可能通过发挥抗炎、抗氧化以及抗凋亡等多重效应,对未成熟脑产生保护作用,从而减少脑损伤的发生率。
早产儿脑损伤血脑屏障破坏,S100B蛋白迅速从大脑星形胶质细胞释放到脑脊液和血液中,其含量变化与临床症状、体征及影像学改变密切相关[19]。脑损伤影响神经元细胞的代谢,导致细胞膜功能与结构受损,NSE从细胞质释放至细胞间隙和脑脊液中,穿过破损的血脑屏障进入血液循环,可作为评判早产儿脑损伤的重要指标,且与神经元的损伤呈正相关。MBP是中枢神经系统所特有的蛋白质,检测MBP在血清及脑脊液中的浓度,可作为一种判断神经损伤严重程度、损伤范围、病情转归和预后的直接定量指标[20]。Rees等[21]研究发现,重组促人红细胞生成素(rhEPO)可以减轻脂多糖导致的早产绵羊中枢神经系统损伤,其作用与减轻轴突损伤、减少脑白质小胶质细胞及星形胶质细胞增生,增加少突胶质细胞的表达及促进髓鞘形成有关。EPO也可通过上调新生脑缺血后小胶质细胞中 Bcl/Bax比值和抑制半胱天冬酶(caspase)激活而发挥神经保护作用[22]。本研究发现血清S100蛋白、NSE和MBP浓度与早产儿脑损伤密切相关。研究报道血清S100蛋白、NSE和MBP浓度可早期反映脑损伤的类型和严重程度,作为内源性细胞因子激素的EPO可保护受损伤神经细胞,减轻脑神经细胞的损伤程度,并促进神经功能的恢复[23]。
引起早产儿脑损伤的因素很多,发病机制尚不完全清楚,近年研究表明,其与早产儿脑发育不成熟而导致易损性增加、围生期窒息、缺氧缺血、宫内感染以及免疫学机制等有关。王晓琴等[6]发现,小胎龄、感染/炎症、窒息缺氧及机械通气等影响脑血流因素与早产儿脑损伤的发生密切相关。低氧血症、窒息复苏及机械通气均可影响早产儿脑血流自主调节功能,致血流动力学不稳定和炎症反应,从而导致或加重脑损伤[24]。本研究发现低胎龄、窒息复苏、机械通气时间延长、贫血和低血清EPO水平均是脑损伤发病的独立危险因素,血清EPO水平越高脑损伤发病率越低,其机制可能是通过促进抗凋亡基因表达和促凋亡基因的下调,抑制神经细胞凋亡;促血管新生;降低炎症细胞浸润及炎症细胞因子的表达,促进神经干细胞增殖,并向神经元和少突胶质细胞分化等脑保护作用,从而降低或减轻早产儿脑损伤,包括减轻缺氧、宫内感染导致的脑损伤[25]。
本研究尚存在一定的不足,由于知情同意的原因,本研究尚缺乏脑脊液EPO水平,以及血清EPO动态水平变化的证据;由于时间的限制,本研究缺乏系统随访资料。因此,早产儿血清EPO水平与神经学预后的关系有待更深入的研究。
| [1] | 中国医师协会新生儿专业委员会. 早产儿脑损伤诊断与防治 专家共识[J]. 中国当代儿科杂志 , 2012, 14 (12) : 883–884. |
| [2] | Juul SE, Ferriero DM. Pharmacologic neuroprotective strategies in neonatal brain injury[J]. Clin Perinatol , 2014, 41 (1) : 119–131. DOI:10.1016/j.clp.2013.09.004 |
| [3] | Mazur M, Miller RH, Robinson S. Postnatal erythropoietin treatment mitigates neural cell loss after systemic prenatal hypoxic-ischemic injury[J]. J Neurosurg Pediatr , 2010, 6 (3) : 206–221. DOI:10.3171/2010.5.PEDS1032 |
| [4] | Sirén AL, Fasshauer T, Bartels C, et al. Therapeutic potential of erythropoietin and its structural or functional variants in the nervous system[J]. Neurotherapeutics , 2009, 6 (1) : 108–127. DOI:10.1016/j.nurt.2008.10.041 |
| [5] | 龙莎莎, 程国强. 早产儿脑白质损伤治疗的循证医学进展[J]. 临床儿科杂志 , 2015, 33 (3) : 287–290. |
| [6] | 王晓琴, 王莹, 李红. 早产儿脑损伤的危险因素[J]. 中国新生 儿科杂志 , 2015, 30 (4) : 286–288. |
| [7] | Hassell KJ, Ezzati M, Alonso-Alconada D, et al. New horizons for newborn brain protection: enhancing endogenous neuroprotection[J]. Arch Dis Child Fetal Neonatal Ed , 2015, 100 (6) : F541–F552. DOI:10.1136/archdischild-2014-306284 |
| [8] | 中华医学会儿科学分会新生儿学组, 《中华儿科杂志》编辑委员会. 早产儿脑室周围-脑室内出血与脑室周围白质软化 的诊断建议[J]. 中华儿科杂志 , 2007, 45 (1) : 34–36. |
| [9] | 马力, 温晓红, 杨海波, 等. 影响早产儿脑损伤的相关因素 分析[J]. 中国当代儿科杂志 , 2016, 18 (6) : 471–475. |
| [10] | 周丛乐. 早产儿脑白质损伤[M]//周丛乐. 新生儿神经病学. 第1 版. 人民卫生出版社, 2012: 376-383. |
| [11] | Panigrahy A, Wisnowski JL, Furtado A, et al. Neuroimaging biomarkers of preterm brain injury: toward developing the preterm connectome[J]. Pediatr Radiol , 2012, 42 (Suppl 1) : S33–S61. |
| [12] | Jantzie LL, Miller RH, Robinson S. Erythropoietin signaling promotes oligodendrocyte development following prenatal systemic hypoxic-ischemic brain injury[J]. Pediatr Res , 2013, 74 (6) : 658–667. DOI:10.1038/pr.2013.155 |
| [13] | 张冬梅, 王来栓. 早产儿脑病研究进展[J]. 国际儿科学杂志 , 2012, 39 (2) : 173–176. |
| [14] | Marret S, Marchand-Martin L, Picaud JC, et al. Brain injury in very preterm children and neurosensory and cognitive disabilities during childhood: the EPIPAGE cohort study[J]. PLoS One , 2013, 8 (5) : e62683. DOI:10.1371/journal.pone.0062683 |
| [15] | Wu YW, Gonzalez FF. Erythropoietin: a novel therapy for hypoxic-ischaemic encephalopathy?[J]. Dev Med Child Neurol , 2015, 57 (Suppl 3) : 34–39. |
| [16] | Traudt CM, Juul SE. Erythropoietin as a neuroprotectant for neonatal brain injury: animal models[J]. Methods Mol Biol , 2013, 982 : 113–126. DOI:10.1007/978-1-62703-308-4 |
| [17] | Leuchter RH, Gui L, Poncet A, et al. Association between early administration of high-dose erythropoietin in preterm infants and brain MRI abnormality at term-equivalent age[J]. JAMA , 2014, 312 (8) : 817–824. DOI:10.1001/jama.2014.9645 |
| [18] | Ma W, Kantarjian H, Zhang K, et al. Significant association between polymorphism of the erythropoietin gene promoter and myelodysplastic syndrome[J]. BMC Med Genet , 2010, 11 : 163. DOI:10.1186/1471-2350-11-163 |
| [19] | Douglas-Escobar M, Weiss MD. Biomarkers of brain injury in the premature infant[J]. Front Neurol , 2013, 3 : 185. |
| [20] | Hergenroeder GW, Redell JB, Moore AN, et al. Biomarkers in the clinical diagnosis and management of traumatic brain injury[J]. Mol Diagn Ther , 2008, 12 (6) : 345–358. DOI:10.1007/BF03256301 |
| [21] | Rees S, Hale N, De Matteo R, et al. Erythropoietin is neuroprotective in a preterm ovine model of endotoxin-induced brain injury[J]. J Neuropathol Exp Neurol , 2010, 69 (3) : 306–319. DOI:10.1097/NEN.0b013e3181d27138 |
| [22] | Lemus-Varela ML, Flores-Soto ME, Cervantes-Munguía R, et al. Expression of HIF-1 alpha, VEGF and EPO in peripheral blood from patients with two cardiac abnormalities associated with hypoxia[J]. Clin Biochem , 2010, 43 : 234–239. DOI:10.1016/j.clinbiochem.2009.09.022 |
| [23] | Alexander ML, Hill CA, Rosenkrantz TS, et al. Evaluation of the therapeutic benefit of delayed administration of erythropoietin following early hypoxic-ischemic injury in rodents[J]. Dev Neurosci , 2012, 34 (6) : 515–524. DOI:10.1159/000345645 |
| [24] | Yu Z, Tang L, Chen L, et al. Erythropoietin reduces brain injury after intracerebral hemorrhagic stroke in rats[J]. Mol Med Rep , 2013, 8 (5) : 1315–1322. |
| [25] | Barton SK, Tolcos M, Miller SL, et al. Ventilation-Induced Brain Injury in Preterm Neonates: A Review of Potential Therapies[J]. Neonatology , 2016, 110 (2) : 155–162. DOI:10.1159/000444918 |
 2016, Vol. 18
2016, Vol. 18