目前对早产儿出生时的免疫功能已有较多报道。普遍认为与足月儿相比,早产儿出生时多种免疫细胞如NK细胞、T细胞等数量较少[1-2]。我们的前期研究也发现NK细胞的减少与早期早产儿晚发型感染密切相关,并且出生时的淋巴细胞亚群水平受宫内感染、产前激素暴露、生产方式等多种因素影响[3]。但对于早产儿尤其是早期早产儿(出生胎龄<32周)免疫功能的动态变化认识不多。本研究进行早期早产儿出生后6个月内的淋巴细胞亚群水平动态监测,并分析多种围产因素对其的影响,以帮助了解早期早产儿淋巴细胞亚群的变化趋势及影响因素。
1 资料与方法 1.1 研究对象本研究为前瞻性队列研究。研究对象为2015年4月至2016年1月我院新生儿重症监护室住院的早期早产儿。入选标准:胎龄<32周的早期早产儿,出生后24 h内入院,住院时间>28 d,有完整的围生期资料。排除标准:未取得知情同意,严重畸形或者母亲有免疫性疾病者。符合入选标准的病例共61例,其中17例在排除失访、近期感染后完成生后6个月的淋巴细胞亚群动态监测。本研究经我院医学伦理委员会批准,并取得家属知情同意。
1.2 临床资料收集临床资料收集包括:(1)基本情况:姓名、出生胎龄、入院年龄、性别、出生体重、母亲产前激素使用情况;(2)围产期情况:脐带、胎盘、羊水、Apgar评分情况,以及有无解脲支原体(ureaplasma urealyticum,UU)定植、宫内感染等;(3)临床疾病如支气管肺发育不良(bronchopulmonary dysplasia,BPD)、新生儿败血症、呼吸窘迫综合征(respiratory distress syndrome,RDS)、新生儿坏死性小肠结肠炎(necrotizing enterocolitis of newborn,NEC)等发生情况。诊断严格按照第7版《实用新生儿学》标准进行[4]。
1.3 主要观察指标利用入院第1天、第7天、第14天、第28天,以及6个月查血常规后的剩余血样,于采血后12 h内进行淋巴细胞亚群检测,包括淋巴细胞(侧向角散射+ CD45+)、T细胞(CD3+)、辅助性T(T helper cells,Th)细胞(CD3+ CD4+)、抑制性T(suppressor T cell,Ts)细胞(CD3+CD8+)、自然杀伤(natural killer,NK)细胞(CD16 + CD56 +)和B细胞(CD19+)。
1.4 流式细胞术检测淋巴细胞亚群采用 BD公司的BD FACSCantoⅡ流式细胞分析仪和BD FACSCanto Software进行淋巴细胞亚群检测和数据分析。操作根据说明书进行[3]。吸取EDTA抗凝全血100 μL及BD Multitest 6 Color TBNK 20 μL加入 BD TruCount Tube,充分混匀,避光室温15 min。再加入1×BD FACSTM Lysing Solution 450 μL,充分混匀,避光室温15 min,2 h内上机检测。
1.5 统计学分析应用SPSS 19.0软件进行统计学处理。非正态分布的计量资料采用中位数(四分位间距)[M(P25,P75)]表示,计数资料采用百分率表示。计量资料的比较采用非参数检验的Mann-Whitney U 检验,计数资料的比较采用卡方检验或Fisher精确概率法,并采用多元线性回归模型对混杂因素进行控制分析。P<0.05为差异有统计学意义。
2 结果 2.1 一般资料61例早期早产儿中男性40例、女性21例;其中胎龄<28周的极早早产儿22例(36%)、28~<32 周者39例(64%);超低出生体重儿14例(23%),极低出生体重儿47例(77%);阴道分娩出生27例(44%),剖宫产出生34例(56%)。母亲产前(1~7 d)使用地塞米松促肺成熟的53例(87%)、宫内感染40例(66%)、UU定植31例(51%)。住院期间诊断为败血症(血培养阳性)的12例(20%,其中1例因合并感染性休克死亡、2例放弃治疗后死亡),BPD 31例(51%)、3级以上颅内出血6例(10%)、NEC 2例(3%)。
以出生胎龄28周分界,分为<28 周组和28~<32 周组,两组间的出生胎龄、出生体重、5 min Apgar评分、男性婴儿所占比例,和RDS、BPD、晚发型败血症发生率差异有统计学意义(P< 0.05),而在分娩方式、母亲产前激素使用、母亲胎膜早破、UU定植、宫内感染方面的差异无统计学意义(P≥0.05)。见表 1。
| 表 1 61例早期早产儿的基本临床资料 |
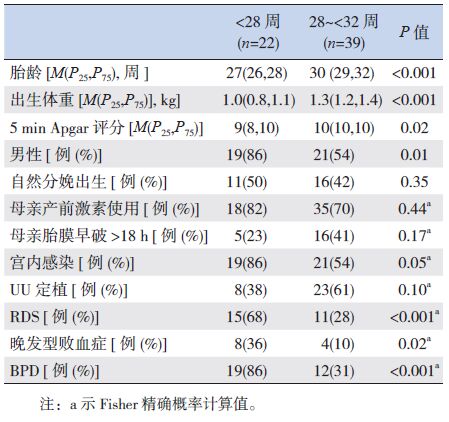
2.2 出生后6个月内淋巴细胞亚群的演变
早期早产儿生后第1天各亚群淋巴细胞绝对计数均处于最低水平;1周时除NK细胞以外的各亚群淋巴细胞均高于出生时水平;1周至28 d期间无明显上升,28 d至6个月期间又显著升高,并于6个月时达高峰。见图 1。
|
图 1 早期早产儿6个月以内的淋巴细胞亚群变化情况 |
2.3 围产期因素对早期早产儿6个月以内淋巴细胞亚群的影响
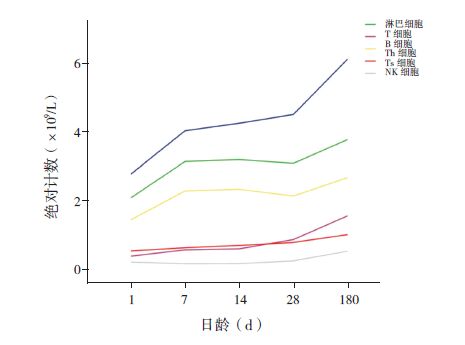
胎龄<28周和28~<32周的早期早产儿出生后第1天的各亚群淋巴细胞绝对计数差异均无统计学意义(P>0.05)。与胎龄<28周早期早产儿比较,≥28周组第7天的T细胞、Th细胞、NK细胞,以及第14天的T细胞和第28天的淋巴细胞、Th细胞绝对计数均较高(P<0.05)。见图 2。
|
图 2 出生胎龄对淋巴细胞亚群绝对计数的影响(n=61,其中第6个月n=17) a示与胎龄<28周组比较,P<0.05。 |
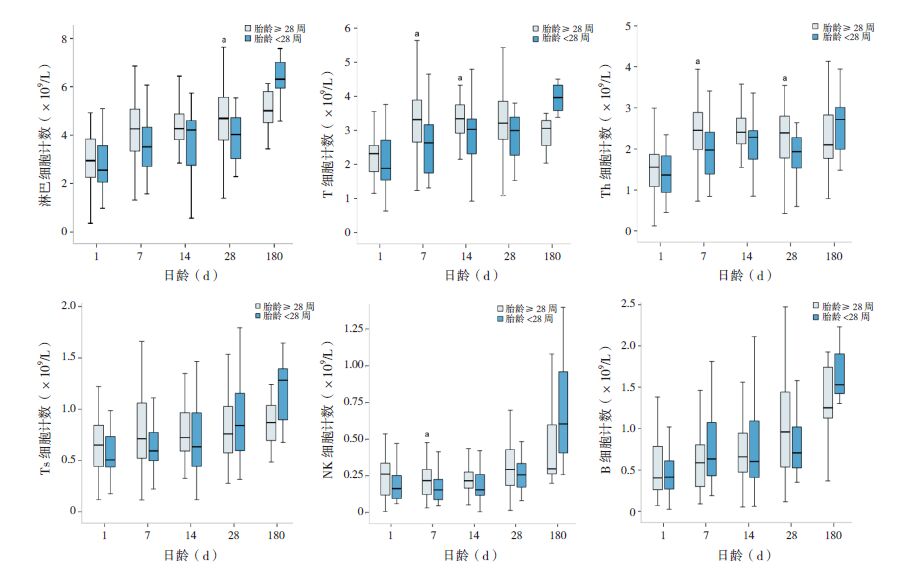
61例早期早产儿母亲产前激素使用比例高达87%。与未使用激素组比,激素组第7天的Ts细胞和第14天的淋巴细胞及所有亚群细胞绝对计数均有升高;第1天、28天及第6个月的两组间差异无统计学意义(P>0.05)。见图 3。采用多元线性回归模型对混杂因素进行控制分析,激素组第14天的淋巴细胞、T细胞、Th细胞、Ts细胞、NK细胞和B细胞绝对计数高于未使用激素组,差异有统计学意义(P<0.05),OR分别为1.73、0.94、0.58、0.38、0.10、0.51,95%CI分别为 0.83~2.63、 0.27~1.60、0.10~1.06、0.10~0.67、0.01~0.19和0.07~0.95。
|
图 3 产前使用激素对淋巴细胞亚群绝对计数的影响(n=61,其中第6个月n=17) a示与未使用激素组比较,P<0.05。 |
宫内感染组与非感染组出生第1天的淋巴细胞亚群绝对计数差异无统计学意义(P>0.05);宫内感染组第7、14天的B细胞绝对计数高于非感染组,第6个月时的NK细胞计数也高于非感染组。见图 4。采用多元线性回归模型对混杂因素进行控制分析,第6个月时两组的NK细胞计数差异不再有统计学意义(P>0.05),其他的组间差异依然有统计学意义(OR分别为0.33、0.33,95%CI分别为0.11~0.55、0.36~0.63)。
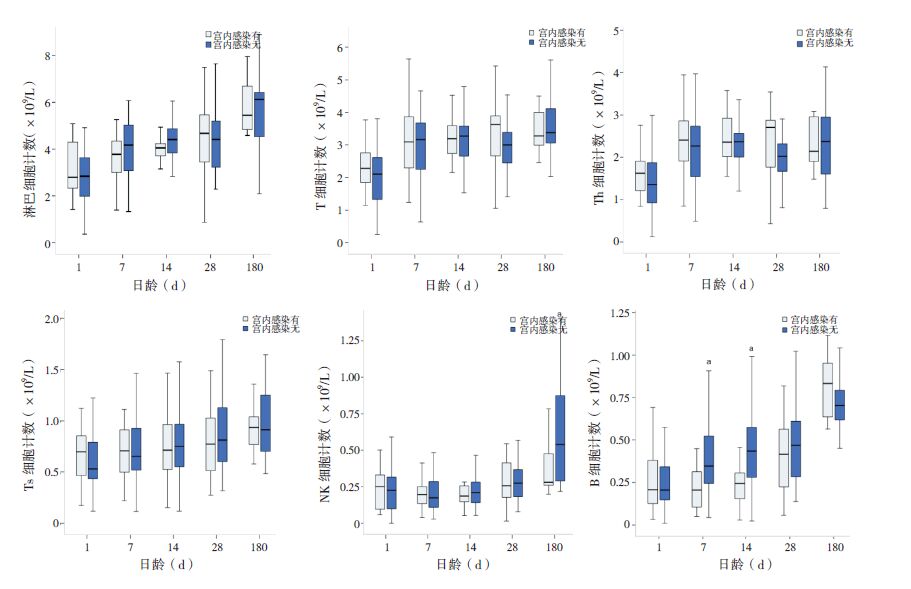
|
图 4 宫内感染对淋巴细胞亚群绝对计数的影响(n=61,其中第6个月n=17) a示与宫内感染组比较,P<0.05。 |
根据UU是否阳性,分为UU定植组和无定植组,51例患儿中UU阳性27例(53%),其中7例完成了第6个月的随访。UU定植组出生第1天的淋巴细胞、T、Th、Ts和B细胞以及第14天的淋巴细胞、B和NK细胞,第6个月的NK细胞绝对计数水平均高于无定植组。见图 5。采用多元线性回归模型对混杂因素进行控制分析,第1天的B细胞、第14天的淋巴细胞、NK 细胞和第6个月的NK细胞计数在两组间的差异不再有统计学意义(P>0.05),其他变量在两组间的差异依然有统计学意义,OR分别为1.03、0.74、0.18、0.21、0.52,95%CI分别为0.41~1.66、0.27~1.20、0.04~0.31、0.03~0.38、0.17~0.87。

|
图 5 解脲支原体(UU)定植对淋巴细胞亚群绝对计数的影响(n=61,其中第6个月n=17) a示与无UU定植组比较,P<0.05。 |
3 讨论
与足月新生儿相比,早产儿更易发生感染性疾病,早产儿多种先天性免疫细胞如NK细胞的绝对和相对数量较少[5],但对于早产儿特别是早期早产儿出生后的淋巴细胞水平缺乏动态研究。Walker等[6]比较了38例早产儿和8例足月儿出生时及生后第1周、6周、12周的淋巴细胞亚群,结果表明,早产儿表现出与足月儿相似的淋巴细胞亚群动态变化趋势。但Walker的样本量较小,且32周以下的早产儿仅13例,很难代表早期早产儿这一独特人群。我们的前期研究[3]证明,早期早产儿出生时淋巴细胞亚群计数低于健康足月儿。本研究发现,早期早产儿出生时除NK细胞以外的各亚群淋巴细胞绝对计数均处于最低水平,1周时迅速升高,经过7~28 d的平稳期后,6个月时上升到健康婴儿水平;NK细胞计数只到6个月才增高。说明早期早产儿虽然出生时免疫细胞数量不足,但出生后逐渐增多,6个月左右达到健康婴儿水平。
早产通常有一些围产期诱因,例如产妇子痫前期或宫内感染,而产前激素广泛用于早产的预防。有研究[7-10]发现这些围产因素可影响新生儿出生时的淋巴细胞亚群水平。Walker等[6]发现出生胎龄越小的早产儿Th细胞计数越低,并且在3月龄仍未能达到足月儿水平。Berrington等[11]发现早产儿生后7个月的淋巴细胞亚群水平仍低于正常,Pelkonen等[12]甚至发现早产儿8岁时的Th 细胞和B细胞仍相对较低。Chabra 等[8]发现母亲产前使用过激素的新生儿脐带血淋巴细胞、Th细胞和调节性T细胞显著低于未使用激素组;Kavelaars等[9]
发现母亲产前使用过激素的出生胎龄26~31周的早产儿T细胞减少、NK细胞活性增加。Kotiranta-Ainamo等[13]发现宫内感染可导致早产儿出生时外周血不成熟的B细胞和T细胞及其亚型增加,分析这可能是一种感染应激。本研究在早产儿出生第1天没有观察到相似的结果,但宫内感染组第7、14天的B细胞绝对计数高于非宫内感染组,提示机体免疫系统尤其是体液免疫对感染产生适应性反应。本研究也发现出生胎龄、母亲产前使用激素、宫内感染等围产因素对淋巴细胞亚群水平造成较长时间的影响。
有关UU定植与淋巴细胞亚群水平的相关性研究未见报道。本研究在控制了可能的混杂因素后UU定植组表现出与非定植组在多个时间点上的淋巴细胞亚群的差异。其原因和机制尚需进一步研究,亦需要更大样本进一步证实。
总之,本研究表明早期早产儿出生时免疫细胞数量不足,以后逐渐增多,6个月左右达健康婴儿水平。淋巴细胞亚群水平在不同胎龄早期早产儿出生时差异不大,但胎龄越低,生后1个月内的上升幅度越低,至生后6个月左右均可达正常水平。
| [1] | Azizia M, Lloyd J, Allen M, et al. Immune status in very preterm neonates[J]. Pediatrics , 2012, 129 (4) : e967–974. DOI:10.1542/peds.2011-1579 |
| [2] | Correa-Rocha R, Pérez A, Lorente R, et al. Preterm neonates show marked leukopenia and lymphopenia that are associated with increased regulatory T-cell values and diminished IL-7[J]. Pediatr Res , 2012, 71 (5) : 590–597. DOI:10.1038/pr.2012.6 |
| [3] | Ma L, Chen R, Liu F, et al. Reduced NK cell percentage is associated with late onset infection in very preterm neonates[J]. Scand J Immunol , 2014, 80 (1) : 50–56. DOI:10.1111/sji.2014.80.issue-1 |
| [4] | 邵肖梅, 叶鸿瑁, 邱小汕. 实用新生儿学[M].第4 版. 北京: 人民卫生出版社, 2011 : 342, 396, 419 -420. |
| [5] | Colombo F, Cattaneo A, Lopa R, et al. Evaluation of a multicolor, single-tube technique to enumerate lymphocyte subpopulations[J]. Clin Vaccine Immunol , 2008, 15 (7) : 1124–1127. DOI:10.1128/CVI.00481-07 |
| [6] | Walker JC, Smolders MA, Gemen EF, et al. Development of lymphocyte subpopulations in preterm infants[J]. Scand J Immunol , 2011, 73 (1) : 53–58. DOI:10.1111/sji.2010.73.issue-1 |
| [7] | Melville JM, Moss TJ. The immune consequences of preterm birth[J]. Front Neurosci , 2013, 7 : 79. |
| [8] | Chabra S, Cottrill C, Rayens MK, et al. Lymphocyte subsets in cord blood of preterm infants: effect of antenatal steroids[J]. Biol Neonate , 1998, 74 (3) : 200–207. DOI:10.1159/000014025 |
| [9] | Kavelaars A, van der Pompe G, Bakker JM, et al. Altered immune function in human newborns after prenatal administration of betamethasone: enhanced natural killer cell activity and decreased T cell proliferation in cord blood[J]. Pediatr Res , 1999, 45 (3) : 306–312. DOI:10.1203/00006450-199903000-00003 |
| [10] | Serwatowska-Bargieł A, Wąsik M, Katarzyna Kornacka M, et al. T-cell subpopulations αβ and γδ in cord blood of very preterm infants: the influence of intrauterine infection[J]. Arch Immunol Ther Exp (Warsz) , 2013, 61 (6) : 495–501. DOI:10.1007/s00005-013-0244-z |
| [11] | Berrington JE, Barge D, Fenton AC, et al. Lymphocyte subsets in term and significantly preterm UK infants in the first year of life analysed by single platform flow cytometry[J]. Clin Exp Immunol , 2005, 140 (2) : 289–292. DOI:10.1111/cei.2005.140.issue-2 |
| [12] | Pelkonen AS, Suomalainen H, Hallman M, et al. Peripheral blood lymphocyte subpopulations in schoolchildren born very preterm[J]. Arch Dis Child Fetal Neonatal Ed , 1999, 81 (3) : F188–193. DOI:10.1136/fn.81.3.F188 |
| [13] | Kotiranta-Ainamo A, Apajasalo M, Pohjavuori M, et al. Mononuclear cell subpopulations in preterm and full term neonates: independent effect of gestational age, neonatal infection, maternal pre-eclampsia, maternal betamethason therapy, and mode of delivery[J]. Clin Exp Immunol , 1999, 115 (2) : 309–314. DOI:10.1046/j.1365-2249.1999.00795.x |
 2016, Vol. 18
2016, Vol. 18