随着新生儿重症监护室(neonatal intensive care unit,NICU)的发展,极低出生体重儿(very low birth weight infant,VLBW)的存活率不断提高[1-2],早产儿颅内出血(intracranial hemorrhage,ICH)是其严重并发症,其中脑室周围-脑室内出血(periventricular-intraventricular hemorrhage,PIVH)至少占新生儿ICH的80%以上[3],其中中重度出血的发生率仍居较高水平[4-5],且部分患儿预后不良[6-7]。近年来振幅整合脑电图(amplitude integrated electroencephalogram,aEEG)逐渐被应用到NICU中,发现早产儿PIVH程度越重,aEEG的异常改变越明显,并且发现aEEG对神经系统预后评估有重要价值[8-9]。为了更客观的评估ICH早产儿脑损伤的aEEG特点,本研究对胎龄为25~33周的PIVH早产儿aEEG结果进行分析,并结合aEEG评分,为早产儿PIVH的严重程度、脑发育成熟度评估及神经重症监护提供依据。
1 资料与方法 1.1 研究对象选取本院新生儿科2014年7月至2016年2月诊断为PIVH的住院早产儿56例,男33例,女23例,胎龄25~33周(平均29.5±2.1周),出生体重760~2 240 g(平均1 375±406 g)。其中胎龄25~28+6周23例,29~33周33例;选取同时期入院的31例同胎龄段无PIVH的31例早产儿为对照组,男21例,女10例,胎龄26.5~32.7周(平均30.2±1.9周),出生体重950~2 150 g(平均1 543±317 g),其中胎龄25~28+6周10例,29~33周21例。
纳入标准:(1)胎龄25~33周的早产儿,生后7 d内行颅脑超声检查,明确为PIVH。(2)住院资料完整。
排除标准:脑室周围白质软化、新生儿窒息、染色体疾病、先天性发育异常、神经系统感染性疾病、遗传代谢病及其他原因所致抽搐者。
将87例早产儿分为“25~28+6周组”(n=33)和“29~33周组”(n=54),另按照颅脑超声结果根据Papile等[10]的分级标准将56例PIVH患儿分为轻度组(Ⅰ、Ⅱ级,n=33)和中重度组(Ⅲ、Ⅳ级,n=23)。
1.2 颅脑超声及振幅整合脑电图检查所有患儿在生后24~48 h内行床旁颅脑超声检查明确有无PIVH及其程度,并根据临床情况予以复查。于生后7 d内进行aEEG检查(美国NicoletOneTM脑功能监护仪(Nicolet Biomedical-VIASYS-Cardinal Health,Dublin,OH)。实验组平均检查时间为生后3.0±1.6 d,对照组平均检查时间为2.6±1.4 d,aEEG记录至少8 h。
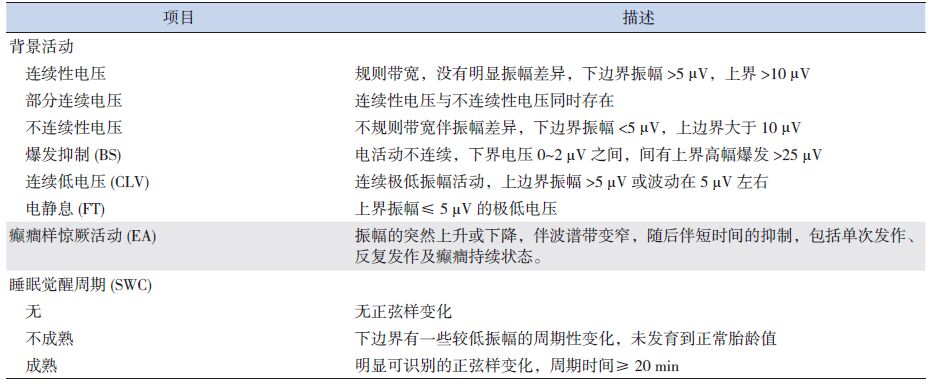
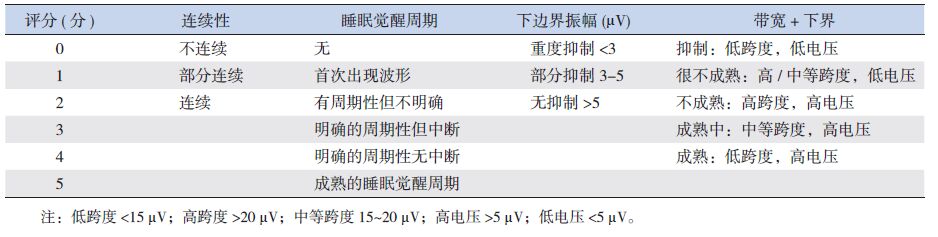
1.3 aEEG结果判读按照2006年Hellström-Westas等[11]提出的aEEG判读标准进行(表 1),另根据Burdjalov等[12]提出的评分系统进行脑发育成熟度的评估,该评分采用半定量的方法使aEEG结果更加客观,且分值越高,说明脑发育越成熟。见表 2。
| 表 1 aEEG判读标准 |
| 表 2 aEEG评分表 |
1.4 统计学分析
应用SPSS 22.0软件进行处理,非正态分布计量资料以中位数及四分位数[M(P25,P75)]表示,组间比较采用秩和检验。计数资料用率(%)表示,组间比较采用χ2检验。三组间比较P<0.05为差异有统计学意义,进一步两组间比较则校正检验水准,P<0.017为差异有统计学意义。
2 结果 2.1 基本资料各胎龄组中,轻度组、中重度组与对照组比较,在胎龄、出生体重、发病时间、性别、娩出方式、机械通气、产前地塞米松的应用、孕母有无妊娠期高血压综合征及aEEG检查时间等方面差异均无统计学意义。
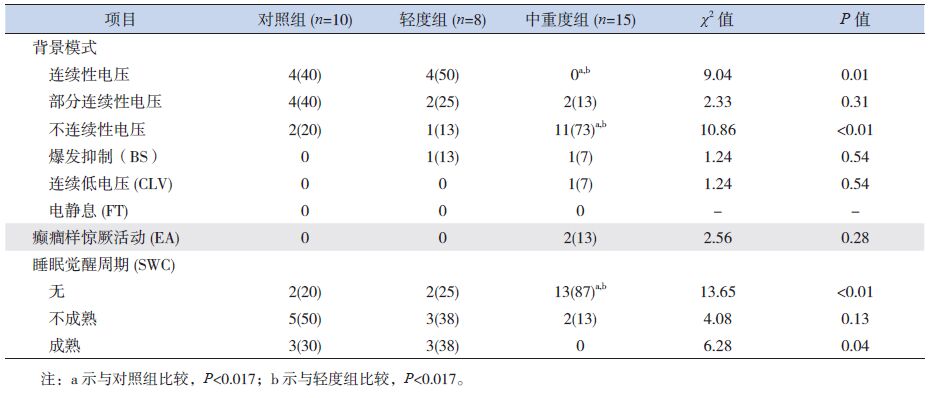
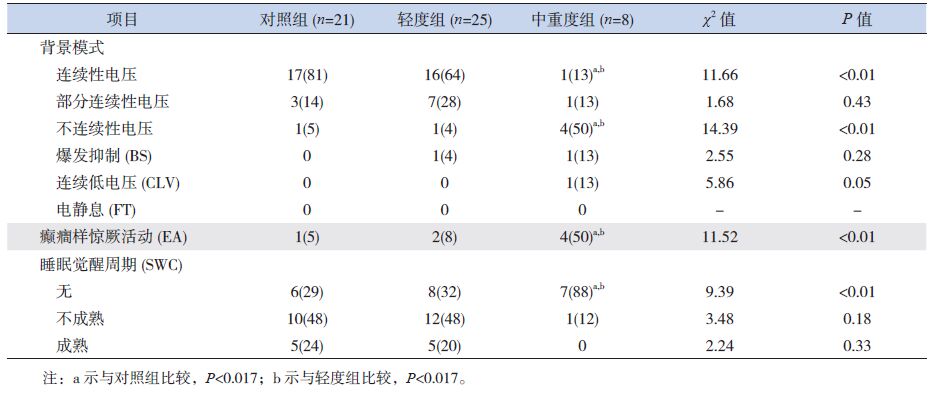
2.2 各组aEEG结果比较不同胎龄组中,轻度组与对照组比较,背景模式、睡眠觉醒周期(SWC)、癫癎样惊厥活动(EA)等方面的差异均无统计学意义;中重度出血组的连续性电压比例明显低于轻度出血组及对照组,而不连续性电压比例明显高于轻度出血组及对照组,背景活动更加不成熟,SWC趋向于缺失,差异有统计学意义(P<0.017);在爆发抑制(BS)、连续低电压(CLV)等方面比较无统计学差异(P>0.017)。同时胎龄在29~33周早产儿中,中重度出血组EA发生率明显高于其他两组(P<0.017)。见表 3、4及图 1~2。
| 表 3 25~28+6周早产儿各组aEEG结果比较 [n(%)] |
| 表 4 29~33周早产儿各组aEEG结果比较 [n(%)] |
|
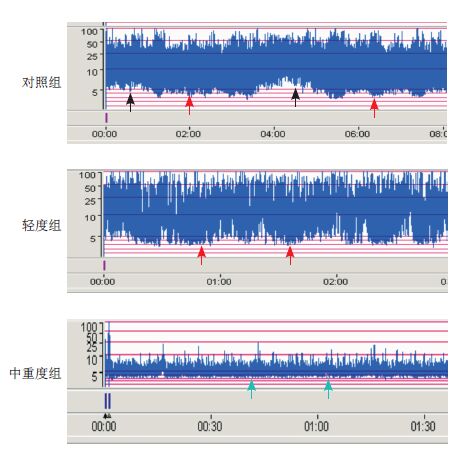
图 1
25~28+6周胎龄患儿各组aEEG结果
对照组部分性连续电压,SWC不成熟;轻度组不连续性电压,SWC不成熟;中重度组连续低电压,无SWC。 |
|
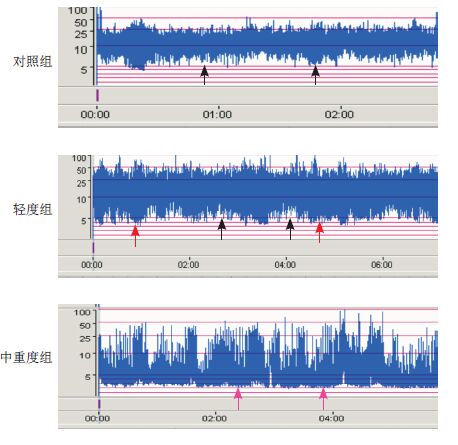
图 2
29~33周胎龄患儿各组aEEG结果
对照组连续性电压,SWC不成熟;轻度组部分连续性电压,SWC不成熟;中重度组爆发抑制,无SWC。 |
2.3 各组aEEG评分结果的比较
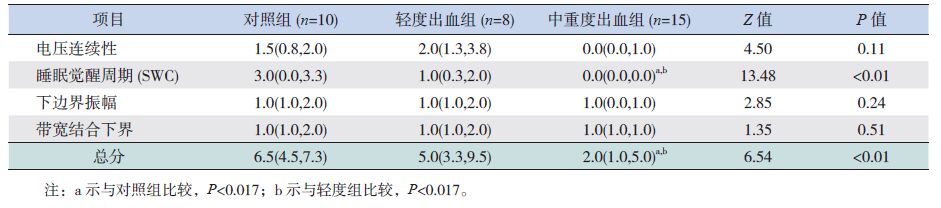
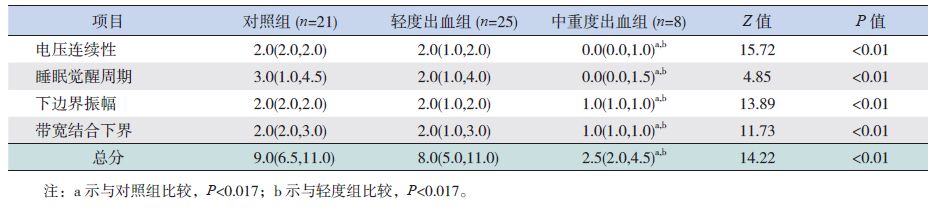
不同胎龄组中,轻度组与对照组之间,电压连续性、SWC、下界振幅、带宽及总分方面的差异均无统计学意义。25~28+6周早产儿中,中重度出血组的SWC以及总分明显低于其余两组,差异有统计学意义(P<0.017)。29~33周早产儿中,中重度出血组的aEEG各参数评分均低于其他两组(P<0.017),见表 5、表 6。
| 表 5 25~28+6周早产儿的aEEG评分 [M(P25,P75),分] |
| 表 6 29~33周早产儿的aEEG评分 [M(P25,P75),分] |
3 讨论
早产儿PIVH发病率高,且与神经系统不良预后密切相关,因此,在临床诊治过程中应给予脑功能监测。aEEG是一种简化、精确的床旁脑功能监测系统,可同步显示原始脑电图,不受低电压的影响,可操作性强。aEEG背景模式中电压的连续性主要依赖于中枢神经系统脑电活动的一般状态[12],随着早产儿脑发育的逐渐成熟,低电压活动时间缩短,爆发持续的时间相对延长,背景活动由不连续逐渐具有连续性[13-14]。由于重度PIVH对早产儿不成熟的大脑造成损伤,使得其aEEG的背景模式不如同胎龄早产儿成熟,连续性电压出现延迟[15]。本研究也发现不同胎龄早产儿随着出血程度的加重,连续性电压比率降低,且在29~33周早产儿中,发现中重度PIVH患儿电压连续性评分低于轻度组及对照组,提示电压的连续性与PIVH的严重程度有关,且中重度PIVH早产儿可能遗留神经系统后遗症,应给予积极干预治疗。但25~28+6周组早产儿中,连续性评分在各组间比较差异无统计学意义,可能与小胎龄早产儿脑发育极不成熟,连续性评分较低,即使发生PIVH使大脑受到损伤,但评分改变不明显有关。BS、CLV、电静息(FT)均为抑制性的脑电背景活动,是严重异常的脑电图表现,往往见于较重的脑损伤改变,且预后不佳[16]。本研究中,仅有2例PIVH患儿表现出BS,1例中重度组患儿表现出CLV,均未见FT样波形,且各组间差异均无统计学意义,考虑主要与早产儿大脑皮层发育不完善有关;另一方面也可能与本研究样本量过小,尤其是中重度患儿病例数少有关。
SWC是判断早产儿脑发育成熟度的最好指标,它的出现和稳定取决于高级中枢神经系统的整合水平,其缺失或不成熟为脑干功能受损的表现,可以用来判断神经系统受损的程度[14, 17-18]。有研究证明PIVH患儿SWC评分明显低于正常对照组,IV级PIVH患儿SWC在矫正胎龄36周时仍低于正常对照组[9]。在本研究中,随着出血程度的加重aEEG表现为SWC的缺如,且SWC评分在中重度组明显低于其他两组,而对照组与轻度组间无统计学差异,提示中重度PIVH对早产儿的脑损伤较重。
EA为各种原因所致的脑细胞功能紊乱,大脑神经元兴奋性过高,神经元突发性异常放电。有研究显示PIVH早产儿EA的出现主要与出血的严重程度有关[19-20]。本研究25~28+6周早产儿中,EA在各组间比较差异无统计学意义,一方面为该胎龄段早产儿大脑皮层发育不完善,神经元不成熟,即使由于PIVH导致脑细胞功能的损伤,但并无电惊厥发生;另一方面,早产儿ICH主要发生在脑室周围室管膜下生发基质,易损区为脑室旁白质部分,而轻度的出血损伤尚未到达神经元,故无异常放电表现。但随着脑发育的成熟,大脑神经元对外界的感知更加敏感,因此在29~33周患儿中,可见中重度组EA的发生率明显高于对照组及轻度组。
随着脑发育成熟度的提高,aEEG电压连续性、SWC、下界振幅、带宽呈现规律性变化。下界振幅随着胎龄增大而逐渐升高,在胎龄32周左右达到最大值 [12]。带宽同时反映了aEEG电压的跨度及受抑制的程度,随胎龄增加逐渐变窄,其分值增加;而总分被认为是目前最好的半定量评价脑发育的指标,更好的反映了整体脑的成熟度,可用于判断远期神经发育预后,指导临床诊断及治疗[19-21]。本研究显示29~33周患儿中,中重度出血组患儿的下边界振幅及带宽评分低于对照组及轻度出血组,但25~28+6周早产儿中两方面比较差异无统计学意义,可能与小早产儿脑发育不成熟,下边界振幅及带宽在此胎龄段评分较低有关,提示aEEG评分在29~33周PIVH患儿中的应用价值更大。同时本研究发现中重度出血组的aEEG总分明显低于其他两组,提示中重度PIVH影响了早产儿大脑发育。
综上,aEEG在早产儿PIVH脑功能的评估中具有重要意义,为临床评估脑损伤及其严重程度提供了新的方法。虽然aEEG对于一些短暂和局灶的惊厥活动不敏感,但它仍可作为一种辅助诊断方法。
| [1] | Costeloe KL, Hennessy EM, Haider S, et al. Short term outcomes after extreme preterm birth in England: comparison of two birth cohorts in 1995 and 2006 (the EPICure studies)[J]. BMJ , 2012, 345 : e7976. DOI:10.1136/bmj.e7976 |
| [2] | Doyle LW, Roberts G, Anderson PJ, et al. Outcomes at age 2 years of infants <28 weeks’ gestational age born in Victoria in 2005[J]. J Pediatr , 2010, 156 (1) : 49–53. DOI:10.1016/j.jpeds.2009.07.013 |
| [3] | 邵肖梅, 叶鸿帽, 丘小汕. 实用新生儿学[M].第4 版. 北京: 人民卫生出版社, 2011 : 706 -715. |
| [4] | Stoll BJ, Hansen NI, Bell EF, et al. Neonatal outcomes of extremely preterm infants from the NICHD Neonatal Research Network[J]. Pediatrics , 2010, 126 (3) : 443–456. DOI:10.1542/peds.2009-2959 |
| [5] | Moore T, Hennessy EM, Myles J, et al. Neurological and developmental outcome in extremely preterm children born in England in 1995 and 2006: the EPICure studies[J]. BMJ , 2012, 345 : e7961. DOI:10.1136/bmj.e7961 |
| [6] | Bassan H. Intracranial hemorrhage in the preterm infant: understanding it, preventing it[J]. Clin Perinatol , 2009, 36 (4) : 737–762. DOI:10.1016/j.clp.2009.07.014 |
| [7] | Murphy BP, Inder TE, Rooks V, et al. Posthaemorrhagic ventricular dilatation in the premature infant: natural history and predictors of outcome[J]. Arch Dis Child Fetal Neonatal Ed , 2002, 87 (1) : F37–F41. DOI:10.1136/fn.87.1.F37 |
| [8] | Olischar M, Klebermass K, Waldhoer T, et al. Background patterns and sleep-wake cycles on amplitude-integrated electroencephalography in preterms younger than 30 weeks gestational age with peri-/intraventricular haemorrhage[J]. Acta Paediatr , 2007, 96 (12) : 1743–1750. DOI:10.1111/apa.2007.96.issue-12 |
| [9] | Benavente-Fernández I, Lubián-López SP, Jiménez-Gómez G, et al. Low-voltage pattern and absence of sleep-wake cycles are associated with severe hemorrhage and death in very preterm infants[J]. Eur J Pediatr , 2015, 174 (1) : 85–90. DOI:10.1007/s00431-014-2360-0 |
| [10] | Papile LA, Burstein J, Burstein R, et al. Incidence and evolution of subependymal and intraventricular hemorrhage: a study of infants with birth weights less than 1,500 gm[J]. J Pediatr , 1978, 92 (4) : 529–534. DOI:10.1016/S0022-3476(78)80282-0 |
| [11] | Hellström-Westas L, Rosén I, de Vries LS, et al. Amplitudeintegrated EEG classification and interpretation in preterm and term infants[J]. Neoreviews , 2006, 7 (2) : e76–87. DOI:10.1542/neo.7-2-e76 |
| [12] | Burdjalov VF, Baumgart S, Spitzer AR. Cerebral function monitoring: a new scoring system for the evaluation of brain maturation in neonates[J]. Pediatrics , 2003, 112 (4) : 855–861. DOI:10.1542/peds.112.4.855 |
| [13] | 施亿赘, 程国强, 邵肖梅, 等. 正常早产儿振幅整合脑电图 特点的研究[J]. 中华儿科杂志 , 2011, 49 (9) : 648–654. |
| [14] | Hellström-Westas L, de Vries LS, Rosén L. Atlas of amplitudeintegrated EEGs in the newbom[M].2nd ed. London: Informa Healthcare, 2008 : 17 -18. |
| [15] | Sohn JA, Kim HS, Lee EH, et al. Developmental change of amplitude-integrated electroencephalographic activity in preterm infants with intraventricular hemorrhage[J]. Early Hum Dev , 2013, 89 (12) : 961–966. DOI:10.1016/j.earlhumdev.2013.09.009 |
| [16] | 刘晓燕. 临床脑电图学[M]. 北京: 人民卫生出版社, 2006 : 112 -124. |
| [17] | 程国强, 施亿赘, 邵肖梅, 等. 振幅整合脑电图评分系统评 价新生儿脑发育的临床价值[J]. 中华围产医学杂志 , 2012, 15 (4) : 234–237. |
| [18] | Thoresen M, Hellström-Westas L, Liu X, et al. Effect of hypothermia on amplitude-integrated electroencephalogram in infants with asphyxia[J]. Pediatrics , 2010, 126 (1) : e131–e139. DOI:10.1542/peds.2009-2938 |
| [19] | Connell J, de Vries L, Oozeer R, et al. Predictive value of early continuous electroencephalogram monitoring in ventilated preterm infants with intraventricular hemorrhage[J]. Pediatrics , 1988, 82 (3) : 337–343. |
| [20] | Levy ML, Masri LS, McComb JG. Outcome for preterm infants with germinal matrix hemorrhage and progressive hydrocephalus[J]. Neurosurgery , 1997, 41 (5) : 1111–1117. DOI:10.1097/00006123-199711000-00015 |
| [21] | Soubasi V, Mitsakis K, Nakas CT, et al. The influence of extrauterine life on the aEEG maturation in normal preterm infants[J]. Early Hum Dev , 2009, 85 (12) : 761–765. DOI:10.1016/j.earlhumdev.2009.10.004 |
 2016, Vol. 18
2016, Vol. 18