2. 厦门市妇幼保健院 医学检验科, 福建 厦门 361003
肺炎支原体(Mycoplasma pneumoniae,MP)是儿童急性呼吸道感染的常见病原。目前MP感染的诊断主要通过检测血清MP-IgM抗体,但其最佳窗口期为感染后7~10 d左右,不适于早期诊断。被动凝集法能够同时检测MP总抗体(IgG+IgM+IgA),具有精确度高、敏感度高、操作简便的特点,但同样不适于MP感染的早期诊断,更多地用于病例回溯性研究[1]。除此之外,血清学免疫检测还存在特异性低的问题[2]。实时荧光定量PCR检测MP-DNA则不受病程影响[3],有助于抗体尚未形成患者的早期诊断,亦有助于抗体滴度下降或者已经消失患者的诊断。但MP-DNA检测存在标本难以“标准化”的问题,而肺炎支原体载量指数(Mycoplasma pneumoniae load index,MPLI)作为新的MP-DNA诊断指标较好地克服了这个问题[4]。因此我们检测MP肺炎患儿不同阶段的MPLI与总抗体,评估其在MP肺炎中的诊断价值。
1 资料与方法 1.1 研究对象选取2012年1月至2015年12月厦门市妇幼保健院儿科115例肺炎支原体肺炎住院患儿作为研究对象,其中男67例、女48例,年龄1岁6个月至7岁11个月,平均年龄5.0±1.8岁。同期健康体检儿童400例作为对照组,男225例、女175例,年龄2岁6个月至5岁10个月,平均年龄4.8±1.5岁。根据病程第1周的MP-DNA载量,分为低载量组(MP-DNA拷贝数<103/mL),中载量组(拷贝数103/mL~106/mL),高载量组(拷贝数>106/mL)。根据第1周总抗体检测结果分为抗体阴性组(滴度<1 : 80)与阳性组(滴度≥1 : 80)。本研究获得医院医学伦理委员会批准及研究对象监护人的知情同意。
肺炎支原体肺炎的诊断和疗效判断参照支原体肺炎临床路径[5]。
1.2 MP-DNA定量检测收集患儿及对照组咽拭子用于MP-DNA检测。采样时间分别为入院当天,病程第1、2、4周和第8周。第1次采样前均无抗MP治疗史。
荧光定量PCR检测MP-DNA含量,试剂盒由中山大学达安基因股份有限公司提供。应用ViiA7Dx基因检测系统进行PCR扩增及数据处理,具体按说明书操作。PCR循环条件:93℃2 min,93℃45 s,55℃60 s,共10个循环;93℃30 s,55℃45 s,共30个循环。以H肌动蛋白DNA(H actin-DNA)作为内参,引物、探针由上海英潍捷基公司合成。H actin-DNA引物正向:5'-ACCGAGCGCGGCTACAG-3',反向:5'-CTTAATGTCACGCACGATTTCC-3',探针序列为:5'-TTCACCACCACGGCCGAGC-3'。H actin PCR循环条件:94℃4min预变性,93℃变性30 s,60℃退火延伸30 s,共40个循环。计算MP-DNA阳性样本的MP-DNA相对定量值,即MPLI。
MPLI=-lg(MP-DNA拷贝量/H actin-DNA拷贝量)。
1.3 被动凝集法检测MP总抗体采集患儿及对照组非抗凝静脉血,取血清用于MP总抗体检测。采样时间分别为入院当天及病程第1、2、4、8周。第1次采样前均无抗MP治疗用药史。
血清MP总抗体(IgG+IgM+IgA)检测采用被动凝集法,试剂盒采用日本富士瑞必欧株式会社的SE-RODIA-MYCO-Ⅱ型,严格按照说明书进行。
1.4 统计学分析应用SPSS 17.0统计学软件进行数据处理。正态分布的计量资料用均数±标准差(x±s)表示,组间比较采用单因素方差分析、t 检验。计数资料的比较采用卡方检验。P<0.05为差异有统计学意义。
2 结果 2.1 一般资料115例肺炎支原体肺炎患儿中男67例、女48例,年龄5.0±1.8岁。400例健康儿童中男225例、女175例,年龄4.8±1.5岁。两组之间年龄、性别构成比差异无统计学意义(t=0.876,χ2=0.582,P>0.05)。
2.2 MPLI的临界值400例健康儿童咽拭子MP-DNA拷贝数为62±13,H actin-DNA的平均拷贝数为(7±4)×108,MPLI为7.0±0.2。根据药监局体外生物诊断试剂申报技术要求[6]计算得出MPLI临界值为6.12,即MPLI>6.12的视为阴性、≤6.12的为阳性。所有肺炎支原体患儿在未予治疗时的MPLI均< 6.12,治愈后MPLI均转阴。
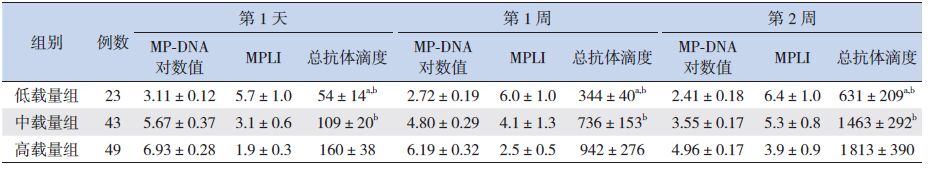
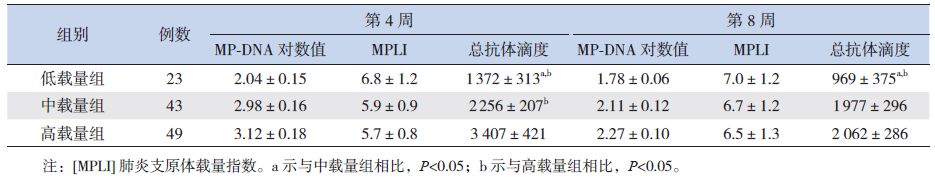
2.3 MP载量和抗体水平的动态变化各载量组的MP-DNA均随着病程而下降,115例MP肺炎患儿随访至第8周时MP-DNA均<1×103/mL;MPLI则随着病程而上升,其中低载量组至第2周即转阴(>6.12),中载量组和高载量组在第8周转阴。MP总抗体滴度随着病程而逐步上升,第4周达最高,第8周有所下降。低载量组的抗体滴度在整个病程中均低于中、高载量组(P<0.05);中载量组的抗体滴度在前4周低于高载量组(P<0.05),第8周中、高载量组的抗体滴度差异无统计学意义(P>0.05)。见表 1。
| 表 1 不同载量组MP-DNA拷贝数、MPLI和总抗体滴度水平的动态变化 (x±s) |
2.4 不同MP-DNA载量的MP肺炎热程比较
MP-DNA高载量组的MP肺炎患儿的热程(9.8±2.4 d)较中载量组(6.8±2.9 d)和低载量组(6.4±2.3 d)长(P<0.05),中、低载量组的热程差异无统计学意义(P>0.05)。
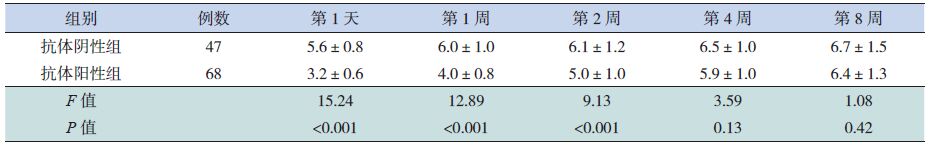
2.5 总抗体检测阴性或阳性组的MPLI水平比较根据肺炎支原体肺炎患儿入院第1周的MP总抗体结果分为抗体阳性组和阴性组。在病程前2周,抗体阴性组的MPLI均高于抗体阳性组(P<0.05);在第4和第8周,抗体阴性组的MPLI虽仍大于抗体阳性组,但差异没有统计学意义(P>0.05)。见表 2。
| 表 2 总抗体检测阴性和阳性组的肺炎支原体载量指数比较 (x±s) |
3 讨论
MP感染的诊断一般是采用免疫学方法检测机体产生的IgM、IgG等抗体,而IgM和IgG抗体常常在感染1~2周左右才出现;此外,由于婴幼儿免疫系统发育不完全,感染后抗体生成不足可能导致免疫学检测结果假阴性[7-8],因此MP抗体检测在婴幼儿MP感染的早期诊断中具有一定的局限性。PCR技术检测MP-DNA具有高度特异性和敏感性[8-12],使MP的早期诊断成为可能。MPLI则通过引入咽部上皮细胞的看家基因H actin 作内参实现了咽拭子MP-DNA检测的样本“标准化”问题,因为H actin的表达不受环境因素影响[13-14]。因此,通过测定咽部上皮细胞的H actin-DNA表达计算得到的MPLI克服了MP-DNA检测难以“标准化”的问题。
本研究显示,患儿MP总抗体在第1周滴度较低,随着病程进展,抗体滴度水平迅速升高并保持在较高水平,表明血清总抗体检测不适于MP肺炎早期诊断,但在病例回溯性研究有意义。本研究还显示,通过测定咽部上皮细胞的看家基因H actin-DNA表达计算MPLI,得出的MPLI临界值为6.12,与张瑾等的研究相接近[15]。所有患儿在入院当天的MPLI均呈阳性,而且MPLI随着病程而上升即逐渐转阴,MP-DNA载量则随病程而下降。提示MPLI可作为MP肺炎早期诊断的指标,并可通过动态监测以指导治疗调整。结果还显示,MP-DNA载量较高的患儿其抗体滴度也较高,总热程也较长;此外,入院2周内抗体阴性组患儿的MPLI显著高于抗体阳性组,这与类似研究的结果一致[16-19],提示MP肺炎患儿的MP-DNA载量、免疫应答及临床特征有一定的相关性。
综上所述,本研究引入一个新的肺炎支原体检测指标MPLI,发现了MP-DNA、总抗体滴度和MPLI在MP-肺炎患儿的动态变化规律,为MP肺炎的早期诊断和疗效监测提供了实验基础。
| [1] | 张健, 李莉, 王文龙, 等. 肺炎支原体抗体分型检测和被动 颗粒凝集检测结果比较[J]. 中华检验医学杂志 , 2012, 35 (7) : 639–642. |
| [2] | Xue G, Wang Q, Yan C, et al. Molecular characterizations of PCR-positive mycoplasma pneumoniae specimens collected from Australia and China[J]. J Clin Microbiol , 2014, 52 (5) : 1478–1482. DOI:10.1128/JCM.03366-13 |
| [3] | 宁瑶, 李红胜, 陈松劲. 实时荧光定量PCR 在肺炎支原体 DNA 检测中的应用[J]. 浙江临床医学 , 2014, 16 (5) : 810–811. |
| [4] | 胡大康, 张瑾, 刘池波, 等. 荧光PCR 法半定量肺炎支原体 的研究[J]. 中国卫生检验杂志 , 2009, 19 (4) : 755–760. |
| [5] | 中华医学会. 支原体肺炎临床路径( 县医院2013 年版)[DB/OL]. (2013-12-23).http://www.cma.org.cn/kjps/jsgf/. |
| [6] | 马玉楠. 体外生物诊断试剂申报技术要求[J]. 中国新药杂志 , 2003, 12 (6) : 482–485. |
| [7] | 吴跃平, 赵瑞珍. 小儿肺炎支原体感染IgM 抗体检测分析[J]. 国际检验医学杂志 , 2006, 27 (7) : 656–657. |
| [8] | 董晓艳, 陆权. 小儿肺炎支原体感染的诊治现状与进展[J]. 中华实用儿科临床杂志 , 2011, 26 (4) : 235–238. |
| [9] | 王晶, 甘轶文, 毛李征, 等. 实时荧光定量PCR 在儿童肺 炎支原体感染中的诊断价值[J]. 实用临床医药杂志 , 2015, 19 (15) : 91–93. |
| [10] | Xu D, Li S, Chen Z, et al. Detection of Mycoplasma pneumomiae in different respiratoryspecimens[J]. Eur J Pediatr , 2011, 170 (7) : 851–858. DOI:10.1007/s00431-010-1360-y |
| [11] | Wang M, Wang Y, Yan Y, et al. Clinical and laboratory profiles of refractory mycoplasma pneumoniae pneumonia in children[J]. Int J Infect Dis , 2014, 29 : 18–23. DOI:10.1016/j.ijid.2014.07.020 |
| [12] | 陈正荣, 严永东. 小儿肺炎支原体感染流行病学特征[J]. 中 国实用儿科杂志 , 2015 (3) : 180–183. |
| [13] | 钟礼立, 彭力, 黄寒, 等. 支气管肺泡灌洗液荧光定量PCR 对儿童肺炎支原体肺炎诊断研究[J]. 中国当代儿科杂志 , 2011, 13 (3) : 191–194. |
| [14] | Jiang W, Yan Y, Ji W, et al. Clinical significance of different bacterial load of mycoplasma pneumoniae in patients with mycoplasma pneumoniae pneumonia[J]. Braz J Infect Dis , 2014, 18 (2) : 124–128. DOI:10.1016/j.bjid.2013.06.004 |
| [15] | 张瑾, 胡大康. 肺炎支原体载量指数在儿童肺炎支原体感染 诊断中的应用[J]. 中华医院感染学杂志 , 2009, 19 (12) : 1613–1615. |
| [16] | Nilsson AC, Björkman P, Persson K. Polymerase chain reaction is superior to serology for the diagnosis of acute Mycoplasma pneumoniae infection and reveals a high rate of persistent infection[J]. BMC Micmbiol , 2008, 8 : 93. |
| [17] | 卢志威, 赵辉, 郑跃杰, 等. 三种方法对儿童肺炎支原体感 染诊断的动态评价[J]. 临床儿科杂志 , 2012, 30 (4) : 382–385. |
| [18] | 成云改, 李淑娴, 李雪静, 等. 肺炎支原体肺炎患儿肺泡灌 洗液病菌量与临床特征相关性研究[J]. 中华儿科杂志 , 2013, 51 (10) : 736–740. |
| [19] | 张晓波, 陆爱珍, 王立波, 等. 肺炎支原体荧光定量聚合酶 链反应在肺炎支原体感染中的诊断评价[J]. 中华儿科杂志 , 2008, 46 (6) : 442–445. |
 2016, Vol. 18
2016, Vol. 18